蛹虫草多糖促进CETP-tg小鼠胆固醇逆转运*
2020-11-04王效琰翟晓天刘伯言司艳红秦树存
邵 波, 李 英,, 王效琰, 翟晓天, 田 华 ,刘伯言, 张 颖 , 司艳红△, 秦树存,△
(山东第一医科大学 1基础医学院,2动脉粥样硬化研究所,3第二临床学院,山东泰安271000)
动脉粥样硬化(atherosclerosis,AS)性心脑血管疾病是临床常见病和多发病,可引起心肌梗塞、脑卒中等并发症,对人类造成了严重危害[1]。胆固醇逆向转运(reverse cholesterol transport,RCT)是机体抗AS 的重要机制之一。尽管他汀类等药物的应用降低了血脂,缓解了AS 的发展,却不能逆转动脉壁已形成的斑块。然而,细胞胆固醇外流和RCT 可将外周组织(包括AS 斑块)中过多的胆固醇转运至肝脏进行再循环或以胆汁酸的形式随粪便排出体外,是机体逆转AS 的重要途径[2]。因此,寻找并确证促RCT的活性成分具有重要的临床意义。
蛹虫草与冬虫夏草相似,具有多种保健作用。蛹 虫 草 多 糖(Cordyceps militarispolysaccharide,CMPS)作为蛹虫草的主要活性成分,其功效逐渐被国内外学者重视与研究。已有报道显示:CMPS粗品可明显降低C57BL/6 小鼠血浆非高密度脂蛋白胆固醇(non-high-density lipoprotein cholesterol,non-HDLC)浓度,并促进外周组织胆固醇经由粪便排出,但其具体机制尚未阐明[3]。本实验选用与人类血脂谱极为相似的胆固醇酯转运蛋白转基因(cholesterol ester transporter transgene,CETP-tg)小鼠作为动物模型,选用巨噬细胞源性泡沫细胞作为AS 细胞模型,评价了CMPS纯品对体内外RCT的影响。
材料和方法
1 材料和仪器
RAW264.7 细胞购自中国科学院上海细胞研究所。蛹虫草子实体购自泰安岱珍生物科技有限公司;CETP-tg 雄性小鼠由山东第一医科大学动脉粥样硬化研究所提供;高脂饲料购自小黍有泰(北京)生物科技有限公司;3H-胆固醇购自中国同位素公司;胎牛血清购自Gibco;DMEM 培养基和胰酶购自HyClone;BCA 蛋白浓度测定试剂盒和RIPA 裂解液购自北京索莱宝科技有限公司;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋 白 胆 固 醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)检测试剂盒购自南京建成生物工程研究所;油红O 粉末购自Sigma;清道夫受体B1(scavenger receptor B1,SR-B1)、LDL 受体(LDL receptor,LDLR)、胆固醇7α-羟化酶A1(cholesterol 7α-hydroxylase A1,CYP7A1)、载脂蛋白A1(apolipoprotein A1,ApoA1)、三磷酸腺苷结合盒转运体A1(ATP-binding cassette transporter A1, ABCA1)、ABCG1、肝 X 受体 α(liver X receptor α,LXRα)和过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)抗体购自Abcam;Ⅱ抗购自北京中杉金桥生物技术有限公司;氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)和高密度脂蛋白3(high-density lipoprotein 3,HDL3)购自广州奕元生物技术有限公司。
旋转蒸发仪(Heidolph);FD8508 真空冷冻干燥机(Ilshin);液闪计数仪(Perkin Elmer);Spectra Max iD3 多功能酶标仪(Molecular Devices);CO2培养箱(Binder)。
2 方法
2.1 多糖的分离与纯化 蛹虫草子实体粉末先用95%乙醇回流脱脂2 次,沉淀晾干后用5 倍体积蒸馏水95℃提取3 次,离心并浓缩获取蛹虫草水提液,而后用4 倍体积无水乙醇沉淀多糖24 h,离心,沉淀物依次用无水乙醇、丙酮和乙醚各洗涤2 次,晾干,获取粗多糖。采用Sevage 试剂去除蛋白,采用AB-8 大孔吸附树脂去除色素,采用苯酚-硫酸法测定多糖浓度为62%,采用高效液相凝胶渗透色谱法测定多糖分子量分布并接取分子量(1 200~3 900)kD 的纯化多糖用于后续实验。
2.2 动物处理 8 周龄CETP-tg 小鼠28 只随机分为模型组和CMPS组,每组14只,实验前两组小鼠体重无明显差异。2 组小鼠每日均喂饲高脂饲料(含15.8%脂肪+1.25%胆固醇),自由饮水。CMPS 组每日灌胃予与CMPS 纯品50 mg/kg,模型组给予等容积纯净水灌胃,连续给药4 周后,每组中随机取7 只进行同位素示踪实验,剩余7 只小鼠常规取材进行机制探讨。
2.3 体内RCT 效率的检测 制备3H-胆固醇培养液:ox-LDL 与3H-胆固醇37℃共孵育30 min 后加入无血浆DMEM 培养液中,其中ox-LDL 终浓度为100 mg/L,3H-胆固醇终浓度5 mCi/L。
制备3H-胆固醇标记的泡沫细胞:RAW264.7 细胞贴壁后换上述培养液培养24 h,收获3H-胆固醇泡沫细胞,胰酶消化离心后加入预冷PBS 洗2 遍,将细胞悬浮于PBS 中,调整细胞数为1.2×1010/L。取100 μL检测细胞内放射活性,其余置于冰上备用。
动物RCT 效率检测:小鼠腹腔注射标记的泡沫细胞悬液,每只0.5 mL,单独笼养48 h 后处死小鼠,测定血浆、肝、胆汁、肠壁和粪便中的放射活度。血浆放射活性检测:于注入细胞悬液后6、24 和48 h 分别内眦静脉取血,离心后取55 μL 血浆,加入闪烁液10 mL,液体闪烁计数(liquid scintillation count,LSC)检测。肝脏、胆汁、肠道中的放射活性检测:48 h 后处死小鼠,取肝脏、胆汁、肠道,组织匀浆后,用正己烷/异丙醇(3/2)萃取脂质,重复3次,收集脂质层,真空冷冻干燥,进行LSC。粪便中的放射活性检测:分别捡取0~24 h 及24~48 h 内粪便称重,4℃纯净水中浸泡过夜(1 g 粪便加入10 mL 纯净水),第2 天加入等量无水乙醇,样品匀浆后取200 μL,进行LSC。计算各部位放射活性占注入体内的百分比。
2.4 细胞胆固醇外排的检测 鼠源RAW264.7 巨噬细胞正常生长于含10%胎牛血清的DMEM 高糖培养基中。细胞实验时,取处于对数生长期细胞,调整细胞密度至1×108/L 种于6 孔板,贴壁后改用无血清培养基。用100 mg/L ox-LDL 作用24 h 诱导细胞泡沫化,倒掉培养液,PBS 洗3 次,不同浓度CMPS(0、5、10和20 mg/L)干预6 h后,加入50 mg/L HDL3继续培养6 h,使细胞内胆固醇流出,检测细胞内脂质、TC水平及蛋白表达变化。
2.5 油红O 染色 将细胞培养于放有无菌盖玻片的6 孔培养板内,细胞经处理后,4%多聚甲醛溶液固定,PBS 润洗后以油红O 染色液染色15 min,苏木素复染,水性封片剂封固,显微镜观察,每张爬片随机选取5个区域拍照。
2.6 细胞内总胆固醇的测定 RAW264.7 细胞按上述胆固醇外排处理后,每孔加入300 μL RIPA裂解细胞,离心取上清,部分上清液用于测定细胞内TC水平,部分用于提取蛋白。分别按照组织总胆固醇试剂盒说明书和BCA蛋白浓度测定试剂盒说明书检测总胆固醇和总蛋白浓度,结果以每mg 蛋白中胆固醇的相对水平进行表示。
2.7 Western blot 分析 取小鼠血浆(检测ApoA1)进行蛋白定量及变性,取肝组织(检测SR-B1、LDLR和CYP7A1)和培养的巨噬细胞(检测ABCA1、ABCG1、LXRα和PPARγ)用 RIPA 提取蛋白后进行蛋白定量及变性,按每孔50 μg加入6%~10%分离胶中,电泳转膜,用含5%脱脂奶粉的TBS-T 封闭2 h,I抗4℃孵育过夜,TBS-T 洗膜后以相应辣根过氧化物酶标记的Ⅱ抗孵育1 h,ECL 化学发光系统显影,采用ImageJ 软件分析蛋白条带积分吸光度,最终以目的蛋白积分吸光度/β-actin 积分吸光度反映蛋白表达的相对水平,以每mg 蛋白的ApoA1 蛋白条带积分吸光度反映血浆ApoA1水平。
3 统计学处理
采用SPSS 19.0 软件进行统计学分析。数据以均数±标准差(mean±SD)表示。两组间比较采用独立样本t检验;多组间比较采用单因素方差分析及LSD法。以P<0.05为差异有统计学意义。
结 果
1 动物实验发现蛹虫草多糖纯品降低了高脂饮食CETP-tg 小鼠血浆胆固醇水平,提高了体内胆固醇逆转运效率
1.1 蛹虫草多糖纯品降低了高脂饮食CETP-tg小鼠血浆 TC、LDL-C 及 HDL-C 浓度 高脂喂饲 4 周后,CETP-tg 小鼠血浆 TC、HDL-C和LDL-C 水平分别为137.41、102.86 和49.61 mg/dL;每天灌胃给予CMPS纯品后,小鼠血浆TC、HDL-C 和LDL-C 水平分别降低了24%、23%和22%;但未发现CMPS对CETP-tg小鼠血浆TG水平有显著影响,见图1A。
1.2 蛹虫草多糖纯品促进了高脂饮食CETP-tg小鼠体内胆固醇逆转运过程 在CMPS 干预4 周后,小鼠腹腔注射3H-胆固醇标记的巨噬细胞源性泡沫细胞,采用同位素示踪技术检测了3H-胆固醇排泄的整个过程。闪烁计数仪检测结果显示:与模型组相比,50 mg/kg CMPS 干预后转运至血浆中的3H-胆固醇在6 h及24 h 分别增加46%和45%;48 h 后两组肝脏中同位素水平没有统计学显著性(数据未显示);48 h 后模型组胆汁中的3H-胆固醇占注入体内总量的0.37%,CMPS 干预组则为0.52%,增加了39%;48 h后模型组肠道中的3H-胆固醇占注入总量的2.55%,CMPS 干预组则为3.89%,增加了53%;最终24 h 内对照组粪便中的3H-胆固醇含量为7.17%,CMPS 干预组为9.41%,24 h 内粪便外排增加了31%,见图1B。而24~48 h 内2 组粪便外排量的差异没有统计学显著性(数据未显示)。
1.3 蛹虫草多糖纯品上调了高脂饮食CETP-tg小鼠胆固醇逆转运过程肝脏相关蛋白SR-B1、LDLR 及CYP7A1 的表达 Western blot 实验结果显示,模型组和CMPS 组血浆ApoA1 水平的差异没有统计学显著性;然而,与模型组相比,肝脏中SR-B1、LDLR 和CYP7A1 的蛋白表达明显升高,分别增加了105%、71%和58%,见图1C。
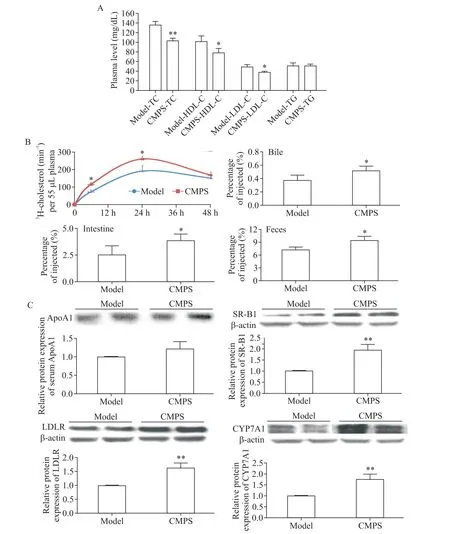
Figure 1.CMPS reduced plasma cholesterol level and promoted RCT in CETP-tg mice fed with high-fat diet.A:the effects of CMPS on plasma levels of TC,LDL-C,HDL-C and TG in CETP-tg mice.B:3H-cholesterol-labeled RAW264.7 cells were intraperitoneally injected into CETP-tg mice.At 12,24,36 and 48 h after injection,blood samples from each group were collected from retro-orbital sinus for dynamic monitoring 3H-cholesterol transport efficiency of plasma.The mice were killed after 48 h.The levels of 3H-labeled cholesterol in bile,intestine and feces from each group were also determined by liquid scintillation counting.C:the protein expression of ApoA1 in plasma and the expressions of SR-B1,LDLR and CYP7A1 in liver were detected by Western blot.Mean±SD. n=3.*P<0.05,**P<0.01 vs model group.图1 蛹虫草多糖纯品降低了高脂饮食CETP-tg小鼠血浆胆固醇水平,提高了体内胆固醇逆转运效率
2 细胞实验验证蛹虫草多糖纯品促进了巨噬细胞源性泡沫细胞胆固醇外排
2.1 蛹虫草多糖纯品降低了巨噬细胞源性泡沫细胞内脂质和TC 的水平 本实验中,我们观察了CMPS 纯品对巨噬细胞源性泡沫细胞胆固醇流出的影响。RAW264.7 细胞吞噬ox-LDL 泡沫化后,给予50 mg/L HDL3介导胆固醇外排,在外排过程中,采用不同浓度CMPS(0、5、10和20 mg/L)进行干预。油红O 染色及细胞内TC 检测显示CMPS 以剂量依赖的方式促进了胆固醇外流,见图2。
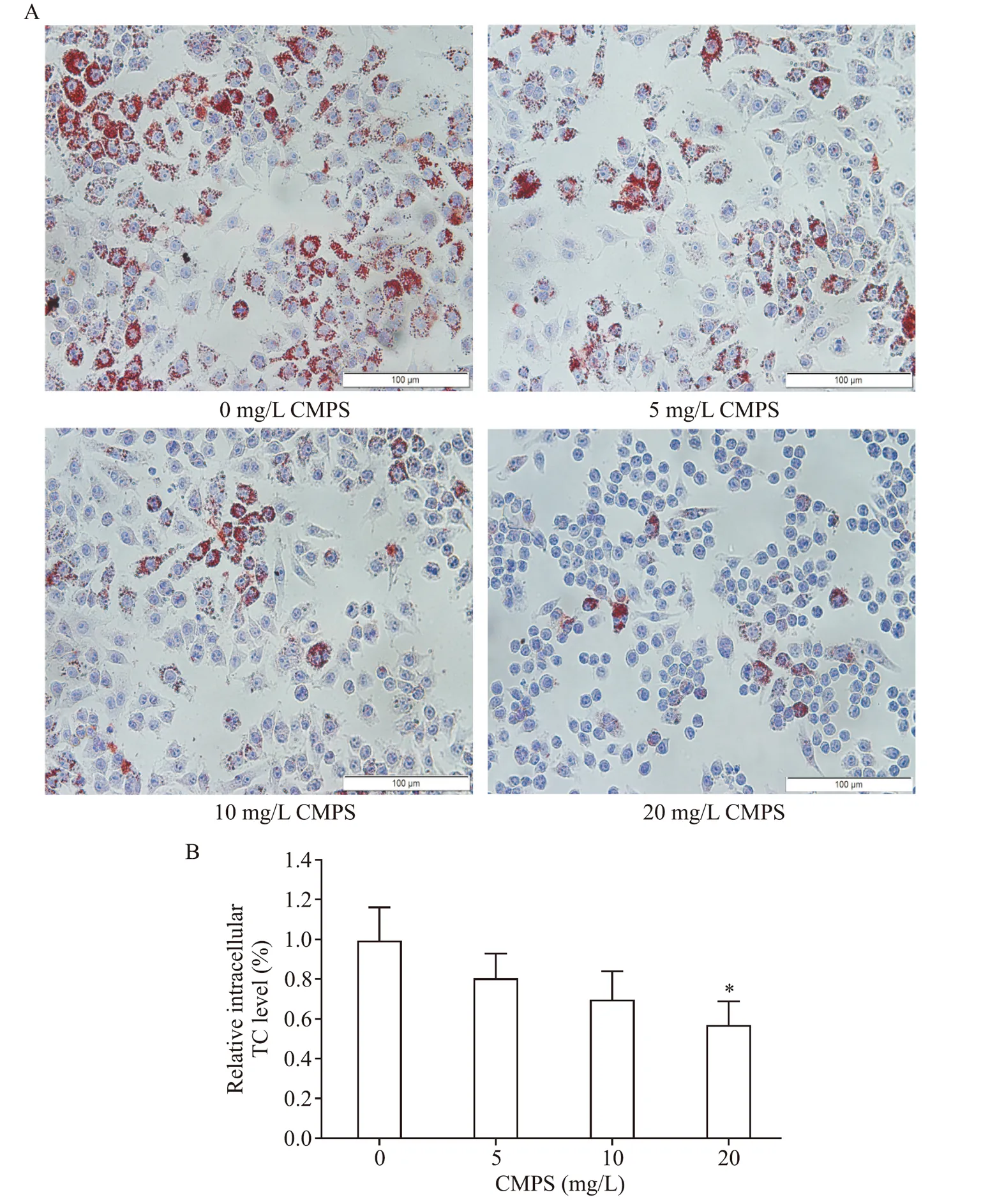
Figure 2.CMPS decreased lipid and total cholesterol(TC)levels in macrophage-derived foam cells.A:lipid droplet content was assessed using oil red O staining;B:intracellular TC content was assessed by the corresponding testing kit.Mean±SD. n=3.*P<0.05 vs 0 mg/L CMPS group.图2 蛹虫草多糖纯品降低了巨噬细胞源性泡沫细胞内脂质和TC水平
2.2 蛹虫草多糖纯品上调了巨噬细胞中PPARγ-LXRα-ABCA1/ABCG1 信号通路相关蛋白的表达CMPS 与 RAW264.7 泡沫细胞共孵育 6 h 后,Western blot 结果表明,CMPS 处理明显升高细胞内ABCA1、ABCG1、LXRα及PPARγ蛋白的表达,见图3。
讨 论
巨噬细胞源性泡沫细胞在动脉壁积聚是脂纹和粥样斑块形成的关键环节,然而,RCT 可以逆转此过程。RCT 包含细胞胆固醇外流,脂蛋白运输以及肝脏转化与排出3 个环节,其过程简介如下:首先,胆固醇从外周细胞(泡沫细胞)经胞膜上的ABCA1ABCG1SR-B1 转运蛋白流出至 HDL 或ApoA1,使HDL 不断成熟。在血浆胆固醇酯转运蛋白(cholesterol ester transporter,CETP)介导下,HDL颗粒上的胆固醇酯可与LDL、极低密度脂蛋白(verylow-density lipoprotein,VLDL)或乳糜微粒上的甘油三酯进行交换。随后,HDL-C 和LDL-C 随血液循环到达肝脏,与肝细胞上相应受体SR-B1 及LDLR 结合,使过多胆固醇运回肝脏。在肝脏中,胆固醇经CYP7A1催化转变成胆汁酸,经由胆汁进入肠道随粪便排出[4]。本研究利用同位素示踪技术,准确评价了体内胆固醇逆转运和外排效率。动物实验结果表明:CMPS 纯品喂饲提高了高脂饮食CETP-tg 小鼠RCT 效率,3H-胆固醇经血浆脂蛋白转运至肝脏,分泌入胆汁增多,最终经肠道和粪便排出体外明显增加。同时,Western blot 结果也显示:CMPS 可增强肝脏中胆固醇受体SR-B1、LDLR 的表达及胆固醇转化酶CYP7A1 的表达,提示CMPS 加速了肝脏对血浆胆固醇的摄取、转化与外排,这可能是胆汁、肠道及粪便中3H-胆固醇明显增加的重要原因。本实验中RCT 效率增加是CMPS 降低血浆胆固醇(TC、HDL-C和LDL-C)水平的重要机制。

Figure 3.CMPS up-regulated the expression of PPARγ-LXRα-ABCA1/ABCG1 signaling pathway-related proteins in macrophage-derived foam cells.RAW264.7 macrophage-derived foam cells were exposed to CMPS at different concentrations(0,5,10,and 20 mg/L)for 12 h,and the protein levels of ABCA1,ABCG1,PPARγ and LXRα were determined by Western blot.Mean±SD. n=3.*P<0.05,**P<0.01 vs 0 mg/L CMPS group.图3 蛹虫草多糖纯品上调了巨噬细胞源性泡沫细胞中PPARγ-LXRα-ABCA1/ABCG1信号通路相关蛋白的表达
外周细胞胆固醇外流是RCT第1步,也是最重要的一步,ABCA1/G1胆固醇泵对这一过程至关重要[5]。LXRα是一种转录激活因子,可通过激活ABC 超家族中ABCA1/G1和ABCG5/ABCG8等的表达调节糖脂代谢和维持胆固醇稳态[6]。PPARγ是 LXRα 的上游基因,属于核受体超家族成员。PPARγ 能够激活LXRα,进而作用于靶基因ABC 超家族介导胆固醇流出,促进RCT[7]。因此,PPARγ-LXRα-ABC 通路在巨噬细胞胆固醇外排机制中具有重要调控作用[8]。本研究中细胞实验结果显示CMPS干预可上调PPARγ-LXRα-ABC通路蛋白,减轻巨噬细胞源性泡沫细胞内胆固醇蓄积,促进胆固醇外排,这可能是小鼠RCT示踪实验中血浆3H-胆固醇明显增加的重要原因。
CETP是血液循环中参与脂代谢与RCT过程的重要调节酶,主要介导中性脂质如胆固醇酯(cholesteryl ester,CE)和TG在HDL和含ApoB-100脂蛋白之间进行等摩尔转移,最终将CE 从HDL 转运至VLDL 和LDL 上,TG 则反转至 HDL[9]。不同物种 CETP 表达差别很大,高等生物(人类和灵长类动物)血浆具有高水平CETP,仓鼠、豚鼠和兔CETP水平较低,而啮齿类动物则没有 CETP[10]。在人类 RCT 过程中,外周细胞外流的胆固醇与HDL 结合后,被卵磷脂-胆固醇酰基转移酶(lecithin-cholesterol acyltransferase,LCAT)酯化转变为CE,并通过CETP转移给VLDL和LDL,随后与肝细胞上LDLR 结合,被肝脏摄取与处理,这是RCT过程的重要组成部分[11]。然而,正常小鼠血浆无CETP 活性,其血脂谱与人类不同,血浆胆固醇以HDL-C 为主,non-HDL-C(包含 LDL-C 及 VLDL-C)极少,所以正常小鼠RCT过程与人类存在差异。本研究中,我们选取人CETP-tg小鼠作为实验动物。与普通C57BL/6 小鼠相比,CETP-tg 小鼠在普通饮食和高脂饮食时其HDL-C 比例降低,non-HDL-C 比例升高,是模拟人类RCT的较好动物模型[12]。
多糖是一类分子结构复杂且庞大的糖类物质。大量研究证实,从植物、动物、真菌、海藻等自然资源中分离纯化的多糖具有抗氧化、抗炎、免疫调节、降血糖、抗肿瘤等多种药理活性[13-15]。近年来,多项动物实验及临床观察表明多糖(香菇多糖[16]、海藻多糖[17]、灵芝多糖[18]等)尚具有降脂功效,然而,深入的分子机制探讨的报道较少。本实验证实CMPS 可促进高脂饮食CETP-tg 小鼠RCT 和泡沫细胞胆固醇外流,并分析了相关调节蛋白的表达,这可能是CMPS降脂的重要机制。
