黄芩素通过上调miR-7-5p影响脂多糖诱导的肾小球上皮细胞氧化应激及凋亡*
2020-11-05周玉娣
周玉娣, 蒋 为, 周 萍
(诸暨市人民医院肾内科,浙江诸暨311800)
肾小球上皮细胞又叫足细胞,其附着于肾小球基底膜外侧,是肾小球滤过功能的最后屏障。近年来研究显示,肾小球上皮细胞氧化应激损伤和凋亡除与蛋白尿的发生有关外,其在肾小球硬化症、肾病综合征以及包括终末期肾病在内的多种慢性肾脏疾病进展中发挥关键作用[1]。因此,如何有效的保护肾小球上皮细胞,减轻其氧化应激损伤和凋亡对肾脏疾病的防治具有重要意义。
黄芩素(scutellarin,SCU)是从中药黄芩中提取的一种黄酮类活性成分,具有抗炎、抗氧化、抗肿瘤及肝脏保护等多种生物活性。研究显示SCU 对糖尿病大鼠具有一定的肾脏保护作用[2-3]。SCU 预处理还可减少肾脏炎症,减缓顺铂引起的肾功能下降[4]。微小RNA-7-5p(microRNA-7-5p,miR-7-5p)是近年发现的微小RNA(microRNA,miRNA),研究显示miR-7-5p 在肠上皮屏障损伤和修复中发挥重要作用[5];姜黄素通过调控 miR-7-5p 表达可防止缺血再灌注过程中的脑损伤和认知功能障碍[6]。然而SCU和miR-7-5 能否在肾小球上皮细胞损伤中发挥保护作用尚未可知。本研究采用脂多糖(lipopolysaccharide,LPS)干预人肾小球上皮细胞(human glomerular epithelial cells,HGEC)建立细胞损伤模型[7],探讨SCU 对 LPS 诱导的 HGEC 氧化应激、凋亡及 miR-7-5p表达的影响,初步揭示SCU的作用机制。
材料和方法
1 材料
HGEC 和RPMI-1640 培养液购于上海康朗生物技术有限公司;LPS 购于Sigma;模拟物阴性对照(miR-NC)、miR-7-5p模拟物(miR-7-5p mimics)、抑制物阴性对照(anti-miR-NC)和miR-7-5p 抑制物(antimiR-7-5p)购于上海吉玛制药有限公司;黄芩素(CAS号为491-67-8;纯度≥98%)购于南京清韵生物科技有限公司;LipofectamineTM2000 购于Invitrogen;Trizol试剂、RIPA裂解液、CCK-8和Annexin V-FITC/PI细胞凋亡检测试剂盒购于上海碧云天公司;鼠源细胞周期素 D1(cyclin D1)抗体、鼠源 cleaved caspase-3 抗体、鼠源β-actin 抗体及山羊抗鼠Ⅱ抗购于Santa Cruz;丙二醛(malondialdehyde,MDA)含量检测试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)活性检测试剂盒和超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒购于Abnova。
2 方法
2.1 细胞培养和分组 采用RPMI-1640 培养液于37℃、含5%CO2的细胞培养箱中培养HGEC,当细胞融合度达到80%时进行细胞传代。细胞分组:正常对照(normal control,NC)组,正常培养的 HGEC;LPS组,采用LPS含量为1.0 mg/L 的细胞培养液培养细胞 24 h;NC+SCU 组,采用 SCU 浓度为 40 μmol/L的细胞培养液培养细胞24 h;LPS+SCU 组,在LPS 组基础上给予40 μmol/L的SCU;LPS+miR-NC组,转染miR-NC 后进行 LPS 处理;LPS+miR-7-5p 组,转染miR-7-5p mimics 后进行 LPS 处理;LPS+SCU+antimiR-NC 组,转染 anti-miR-NC 后进行 LPS和SCU 处理;LPS+SCU+anti-miR-7-5p 组,转染 anti-miR-7-5p后进行LPS 和SCU 处理。参照LipofectamineTM2000说明书步骤进行瞬时转染。
2.2 RT-qPCR 检测miR-7-5p 的表达水平 收集按照2.1 实验分组进行处理的各组细胞,参照Trizol 试剂说明书提取各组细胞RNA,紫外分光光度计测定A260/A280值在1.8~2.0 之间。参照逆转录试剂盒说明书合成cDNA,取cDNA 按照SYBR Green Real-time PCR 试剂盒进行 PCR 扩增,以 U6 为内参照,采用2-ΔΔCt法计算 miR-7-5p 的表达水平。miR-7-5p和U6的引物由北京华大基因公司合成,序列(5'-3')如下:miR-7-5p 上游引物序列为TGTTGTTTTGTGAT,下游引物序列为GTGCAGGGTCCGAGGT;U6 上游引物序列为CACTGGGTGCGGCAGGT,下游引物序列为TCATCACCGATCGATACGATGA。
2.3 CCK-8 法检测细胞活力 取对数期HGEC,胰酶消化后按照每孔1×104cells 密度接种到96 孔板,孵育过夜后,按照方法2.1 细胞分组进行细胞干预处理,每组设置3个复孔,每孔加入10 μL的CCK8溶液,培养箱孵育4 h,全自动酶标仪测定450 nm 处的吸光度(A450),计算细胞相对活力。
2.4 流式细胞术检测细胞凋亡 取对数期HGEC,胰酶消化后按照每孔2×105cells 密度接种到6 孔板,分组和干预方法同方法2.1,每组设置3 个复孔。各组细胞进行相应处理后,弃去细胞培养液,胰酶消化细胞,采用PBS 重悬细胞制备细胞密度为1×108/L 的细胞悬液。取100 μL 细胞悬液至流式管,分别加入5 μL 的 Annexin V-FITC和5 μL 的 PI,混匀后避光孵育15 min,于1 h内进行流式细胞仪分析。
2.5 Western blot 检测 cyclin D1和cleaved caspase-3的表达水平 收集按照2.1 分组进行干预处理的各组细胞,RIPA 裂解液提取各组细胞总蛋白。二喹啉甲酸(bicinchoninic acid,BCA)法测定各组样本蛋白含量,调整蛋白浓度至3 g/L 后水浴锅煮沸5 min,冷却至室温后-80℃保存备用。取30 μg细胞蛋白进行SDS-PAGE 分离细胞蛋白。利用常规湿法转膜装置将细胞蛋白转移至硝酸纤维素膜,放于5%的脱脂牛奶中室温封闭2 h,洗膜缓冲液洗膜3 min,将膜置于已稀释的Ⅰ抗溶液中室温条件孵育2 h,洗膜缓冲液洗膜3 次,将膜置于已稀释的Ⅱ抗溶液中室温条件孵育1 h,洗膜缓冲液洗膜3次,加入化学发光显色试剂显色,每组设置3 个平行实验,以β-actin 为内参照,利用Quantity One 4.40软件分析cyclin D1 和cleaved caspase-3的表达水平。
2.6 细胞内MDA 含量和SOD 活性以及细胞上清液中LDH 活性的测定 收集按照2.1 分组进行干预处理的各组细胞,按试剂盒说明书操作,在相应波长处测定各组细胞吸光度,再换算成MDA 含量、SOD 活性和LDH活性,分析各组细胞氧化应激水平。
3 统计学处理
采用SPSS 21.0 进行统计分析。计量资料均采用均数±标准差(mean±SD)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步组间比较采用SNK-q检验。以P<0.05表示差异具有统计学意义。
结 果
1 黄芩素对LPS诱导的HGEC活力的影响
与 NC 组比较,LPS 组 HGEC 中 cyclin D1 表达水平显著降低,细胞活力显著降低(P<0.05);与LPS 组比较,LPS+SCU 组 HGEC 中 cyclin D1 表达水平显著升高,细胞活力显著升高(P<0.05),见图1及表1。

Figure 1.Western blot was used to detect cyclin D1 protein expression.Mean±SD. n=3.*P<0.05 vs NC group;#P<0.05 vs LPS group.图1 Western blot检测cyclin D1蛋白的表达

表1 黄芩素对LPS诱导的HGEC活力的影响Table 1.Effect of scutellarin(SCU)on the viability of LPS-induced HGEC(%.Mean±SD. n=9)
2 黄芩素对LPS诱导的HGEC凋亡率的影响
与 NC 组比较,LPS 组 HGEC 细胞 cleaved caspase-3蛋白的表达水平显著升高,细胞凋亡率显著升高(P<0.05);与 LPS 组比较,LPS+SCU 组 HGEC 中cleaved caspase-3 蛋白的表达水平显著降低,细胞凋亡率显著降低(P<0.05),见图2及表2。
3 黄芩素对LPS诱导的HGEC氧化应激的影响
与NC组比较,LPS组HGEC中MDA含量和上清液中LDH 活性显著升高,SOD 活性显著降低(P<0.05);与 LPS 组比较,LPS+SCU 组 HGEC 中 MDA 含量和上清液中LDH 活性显著降低,SOD 活性显著升高(P<0.05),见表3。
4 黄芩素对miR-7-5p表达的影响
与 NC 组比较,LPS 组 HGEC 中 miR-7-5p 的表达水平显著降低(P<0.05);与LPS 组比较,LPS+SCU组HGEC 中miR-7-5p 的表达水平显著升高(P<0.05),见表4。

Figure 2.Effect of scutellarin(SCU)on LPS-induced apoptosis of HGEC.A:flow cytometry was used to detect the apoptosis;B:Western blot was used to detect the protein level of cleaved caspase-3.Mean±SD. n=3.*P<0.05 vs NC group;#P<0.05 vs NC+SCU group.图2 黄芩素对LPS诱导的HGEC凋亡的影响
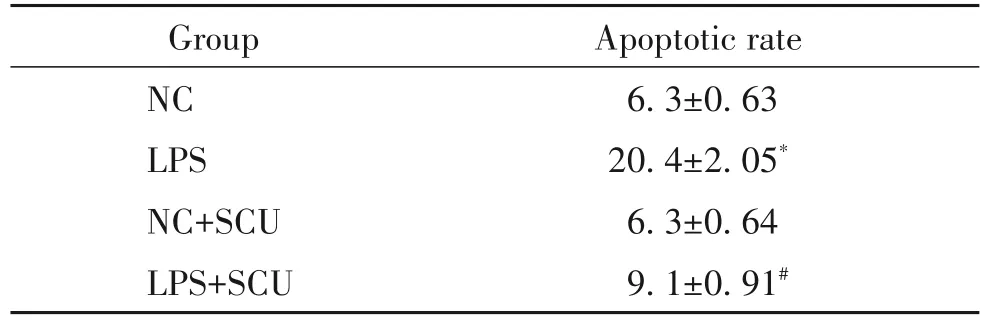
表2 黄岑素对LPS诱导的HGEC凋亡率的影响Table 2.The effect of scutellarin on LPS-induced apoptosis of HGEC(%.Mean±SD. n=9)
5 上调 miR-7-5p 对 LPS 诱导的 HGEC 活力、凋亡及氧化应激的影响
与 LPS+miR-NC 组 比 较 ,LPS+miR-7-5p 组HGEC 中 miR-7-5p和cyclin D1 蛋白的表达水平显著升高,cleaved caspase-3 蛋白的表达水平显著降低,细胞中MDA 含量和上清液中LDH 活性显著降低,细胞中SOD 活性显著升高,细胞活力显著升高,细胞凋亡率显著降低(P<0.05),见图3及表5。
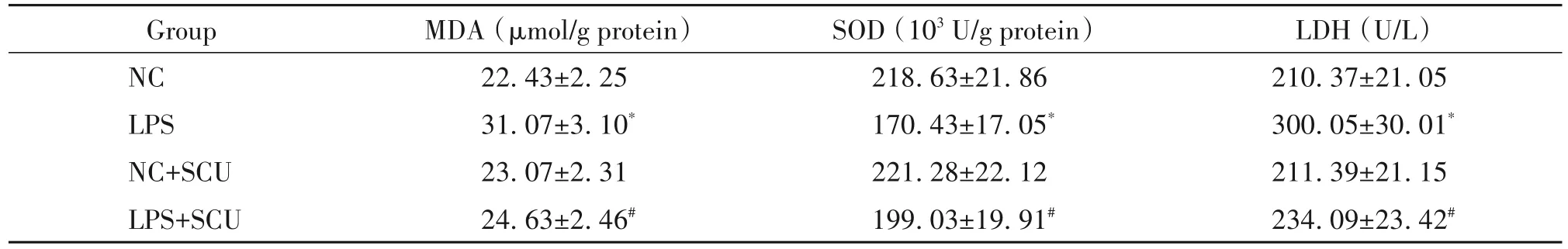
表3 黄芩素对LPS诱导的HGEC中MDA含量和SOD活性及细胞培养上清液LDH活性的影响Table 3.Effect of scutellarin(SCU)on MDA content and SOD activity in LPS-induced HGEC and LDH activity in cell culture supernatant(Mean±SD. n=9)
6 miR-7-5p 低表达可以逆转黄芩素对LPS 诱导的HGEC的影响
与LPS+SCU+anti-miR-NC 组比较,LPS+SCU+anti-miR-7-5p 组 HGEC 细 胞 miR-7-5p和cyclin D1 蛋白的表达水平显著降低,cleaved caspase-3 蛋白的表达水平显著升高,细胞中MDA 含量和上清液中LDH活性显著升高,细胞中SOD 活性显著降低,细胞活力显著降低,细胞凋亡率显著升高(P<0.05),见图4及表6。
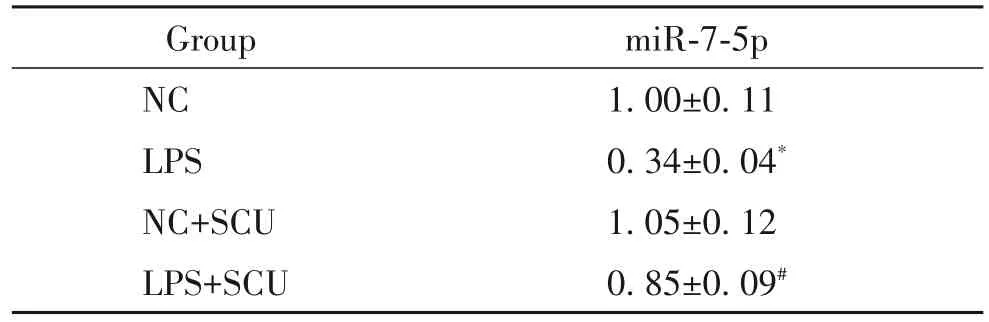
表4 黄芩素对miR-7-5p表达的影响Table 4.Effect of scutellarin(SCU)on miR-7-5p expression(Mean±SD. n=9)
讨 论
SCU 作为一种天然抗氧化剂,近年来其在肾脏疾病中的作用受到了研究者的广泛关注。研究显示SCU 可能通过抑制核因子κB(nuclear factor kappa B,NF-κB)通路介导的炎症反应以及线粒体途径介导的肾小管上皮细胞凋亡进而对大鼠缺血再灌注损伤的发挥保护作用[8]。SCU 通过降低肾小管上皮细胞的氧化应激反应,抑制细胞凋亡,减轻过氧化氢诱导的肾小管上皮细胞损伤[9]。此外,SCU 还可促进缝隙连接蛋白43 磷酸化表达,改善大鼠肾脏缝隙连接通讯功能,逆转高糖诱导对肾小管上皮细胞的增殖抑制作用[10]。但目前 SCU 对 LPS 诱导的 HGEC 氧化应激损伤和凋亡的影响还未可知。cyclin D1 是细胞周期调控关键蛋白,其表达增加可促进细胞周期向 S 期转换,促进细胞增殖[11]。caspase-3 的活化是细胞凋亡发生的重要标志,抑制其表达和活化可抑制细胞凋亡[12]。本研究显示,SCU 作用于 LPS 诱导的HGEC 后,细胞活力和cyclin D1 蛋白表达显著增加,凋亡率和cleaved caspase-3 蛋白表达显著降低,说明SCU 可降低LPS 诱导的HGEC 凋亡,促进HGEC存活。正常情况下机体氧化和抗氧化处于动态平衡状态,在病理情况,氧自由基产生过多或机体抗氧化酶SOD 活性下降,引发机体脂质过氧化反应,最终导致细胞损伤和功能改变[13-15]。本研究显示,SCU 可提高 LPS 诱导的 HGEC 中 SOD 活性,降低 MDA 含量及LDH 水平。这提示SCU 可降低LPS 诱导的HGEC氧化应激损伤和凋亡。与本研究类似,SCU 通过抗氧化和抗凋亡机制对心肌细胞缺氧复氧损伤和星形胶质细胞糖氧剥夺损伤亦具有保护作用[16-17]。
miRNA 是一类内源性小分子RNA,参与细胞增殖、分化、凋亡等多种生命过程,其异常表达在多种肾脏疾病中具有重要作用[18-19]。miR-7-5p 在大鼠心肌缺血再灌注损伤细胞模型中表达下调,上调miR-7-5p 表达可保护心肌细胞免受缺血再灌注诱导的凋亡[20];miR-7-5p表达失调与动脉粥样硬化进展有关,多氯联苯通过上调miR-7-5p表达促进血管内皮细胞凋亡进而促进动脉粥样硬化的形成[21]。为进一步探讨SCU 抑制LPS 诱导的HGEC 氧化应激和凋亡的机制,本研究检测LPS 诱导后HGEC 中miR-7-5p 表达水平,结果显示LPS 可抑制HGEC 中miR-7-5p 表达,而 SCU 可促进 LPS 诱导的 HGEC 中 miR-7-5p 的表达,提示SCU 可能通过调控miR-7-5p 表达减轻LPS诱导的HGEC 损伤。然而,目前miR-7-5p 对LPS 诱导的HGEC 氧化应激和细胞凋亡的影响还尚不清楚。本研究通过转染miR-7-5p mimics 上调HGEC 中miR-7-5p表达,发现LPS诱导的HGEC氧化应激和凋亡受到抑制,而下调miR-7-5p 可降低SCU 对LPS 诱导的HGEC 氧化应激损伤和凋亡的保护作用。这进一步说明SCU 通过上调miR-7-5p 来减轻LPS 诱导的HGEC氧化应激损伤和凋亡。

Figure 3.Western blot was used to detect cyclin D1 and cleaved caspase-3 expression.Mean±SD. n=3.*P<0.05 vs LPS+miR-NC group.图3 Western blot检测cyclin D1和cleaved caspase-3表达

表5 上调miR-7-5p对LPS诱导的HGEC的存活率,凋亡率及氧化应激的影响Table 5.The effect of up-regulation of miR-7-5p on the viability,apoptotic rate and oxidative stress of LPS-induced HGEC(Mean±SD. n=9)

Figure 4.Western blot was used to detect the expression of cyclin D1 and cleaved caspase-3.MeanSD. n=3.*P<0.05 vs LPS+SCU+anti-miR-NC group.图4 Western blot检测cyclin D1和cleaved caspase-3表达
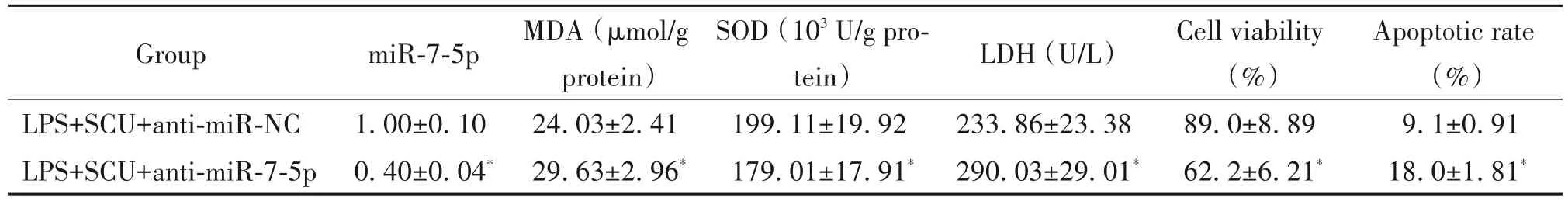
表6 miR-7-5p低表达可以逆转黄芩素对LPS诱导的HGEC的影响Table 6.Low expression of miR-7-5p reversed the effects of scutellarin(SCU)on LPS-induced HGEC(Mean±SD. n=9)
综上所述,本研究显示SCU 可减轻LPS 诱导的HGEC氧化应激损伤和凋亡,其机制与调控miR-7-5p表达有关。这为SCU 在防治HGEC 损伤中的应用提供了参考资料。
