细胞因子白细胞介素-17 A在鼻咽癌组织中的表达情况及临床意义△
2020-09-14吴烜童刚领程勃然余少康靳枫王树滨
吴烜,童刚领,程勃然,余少康,靳枫,王树滨#
1北京大学深圳医院肿瘤内科,广东深圳518036
2深圳市胃肠肿瘤转化研究重点实验室,广东深圳518036
3深圳北京大学香港科技大学肿瘤研究所,广东深圳518036
鼻咽癌是中国华南地区高发的头颈部恶性肿瘤,世界上多数国家的鼻咽癌发病率为(0.5~1)/10万,而广东、广西、湖南、福建、江西等南方地区鼻咽癌的发病率高达20/10万人,发病人数约占全国总发病人数的80%[1-2]。以放化疗为主的鼻咽癌治疗方法已进入平台期,针对鼻咽癌发病机制的新型系统性靶向治疗受到越来越多的关注,但目前未有能够带来确切生存获益的靶向药物。病因学研究显示,鼻咽癌的发病与EB病毒(Epstein-Barr virus,EBV)感染密切相关[3]。循环中的EBV DNA来源于肿瘤细胞,且能够反映肿瘤负荷,与肿瘤的临床分期、预后及疗效紧密相关[4]。本课题组前期研究证明鼻咽癌中EBV感染可致γ干扰素(interferon-γ,IFN-γ)等细胞因子的表达水平升高,而IFN-γ又可上调肿瘤细胞中程序性死亡受体配体1(programmed cell death 1 ligand 1,PDCD1LG1,也称PD-L1)的表达,从而引起免疫逃逸,影响患者预后[5]。白细胞介素(interleukin,IL)-17A是一种由辅助性T细胞17(T helper cell 17,Th17)产生的促炎细胞因子。研究显示,在乳腺癌、卵巢癌、大肠癌、甲状腺癌等恶性肿瘤中,IL-17A具有促进肿瘤发生及发展的作用[6-7]。另有研究显示,IL-17A在EBV阳性胃癌中呈高表达,EBV可增强IL-17A的表达[8]。基于此,本研究通过免疫组织化学染色方法对鼻咽癌组织及癌旁组织中IL-17A的表达情况进行检测,并分析鼻咽癌组织中IL-17A表达情况与患者临床特征、预后及PD-L1表达的关系,旨在探讨其在鼻咽癌发生发展中的作用,现报道如下。
1 对象与方法
1.1 研究对象
选取2013年10月至2018年10月于北京大学深圳医院、中山大学肿瘤医院、中山大学第五医院确诊的90例鼻咽癌患者。纳入标准:①经病理检查确诊为鼻咽癌;②术前未行激素治疗、化疗、放疗等;③临床资料完整。排除标准:①合并其他部位恶性肿瘤;②存在精神疾病或凝血功能障碍;③年龄<18岁;④正在参与其他研究。90例患者中,男67例,女23例;年龄34~73岁,平均年龄(55.09±8.46)岁;分化程度:高分化28例,中分化45例,低分化17例;临床分期:I期8例,Ⅱ期24例,Ⅲ期39例,Ⅳ期19例。收集患者的鼻咽癌组织标本90例和癌旁组织标本90例。本研究经医院伦理委员会审批通过,所有患者均对本研究知情并签署知情同意书。
1.2 免疫组织化学染色方法
采用甲醛溶液固定组织标本,石蜡包埋,连续切片(厚度为4 μm),常规二甲苯脱蜡,梯度乙醇脱水,3%过氧化氢封闭内源性过氧化物酶,常规脱蜡,微波抗原修复,滴加10%山羊血清(封闭组织内非特异性抗原),并加入适量的兔抗人IL-17A和PD-L1抗体,4℃冰箱内孵育24 h,以磷酸盐缓冲液(phosphate buffered saline,PBS)替代一抗作为阴性对照。于次日滴加适量的生物素标记的羊抗兔二抗,二氨基联苯胺(diaminobenzidine,DAB)显色,苏木素复染,中性树脂封片,显微镜下观察,以试剂盒提供的阳性标本作为阳性对照。
1.3 免疫组织化学染色方法结果判读
IL-17A、PD-L1蛋白阳性表达主要位于细胞膜及细胞质中,呈棕黄色或棕褐色颗粒。于400倍显微镜下随机选取5个视野,观察视野内阳性细胞计数和总细胞计数,通过半定量积分法进行判定。依据染色强度评分:无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。依据阳性细胞比例评分:阳性细胞比例≤5%为0分,5%<阳性细胞比例≤25%为1分,25%<阳性细胞比例≤50%为2分,50%<阳性细胞比例≤75%为3分,阳性细胞比例>75%为4分。将上述两项评分相乘,0分代表阴性(-),1~4分代表弱阳性(+),5~8分代表中等阳性(++),9~12分代表强阳性(+++)。
1.4 观察指标
收集患者的一般资料,主要包括年龄、性别、临床分期、组织分化程度、T分期、N分期、EBV状态。比较鼻咽癌组织及癌旁组织中IL-17A的阳性表达率,分析不同临床特征鼻咽癌患者鼻咽癌组织中IL-17A的表达情况,以及鼻咽癌组织中IL-17A与PD-L1表达的相关性。分析IL-17A阳性和阴性患者的总生存情况和无进展生存情况。
1.5 随访方法
采用电话及门诊方式对患者进行随访,随访截止时间为2020年4月,记录患者的预后情况。
1.6 统计学方法
采用SPSS 20.0软件对数据进行统计分析,计数资料以例数和率(%)表示,-组间比较采用χ2检验;计量资料以均数±标准差(x±s)表示;采用Kaplan-Meier法绘制生存曲线,组间比较采用Logrank检验;采用Spearman相关分析法进行相关性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 鼻咽癌组织和癌旁组织中IL-17 A阳性表达率的比较
IL-17A蛋白表达于细胞膜和细胞质,阳性颗粒为棕褐色或者棕黄色(图1)。鼻咽癌组织中IL-17A的阳性表达率为62.22%(56/90),高于癌旁组织的12.22%(11/90),差异有统计学意义(χ2=48.144,P<0.05)。
2.2 不同临床特征鼻咽癌患者鼻咽癌组织中IL-17 A表达情况的比较
不同年龄、性别鼻咽癌患者鼻咽癌组织中IL-17A的阳性表达率比较,差异均无统计学意义(P>0.05);不同临床分期、组织分化程度、T分期、N分期、EBV阳性情况鼻咽癌患者鼻咽癌组织中IL-17A的阳性表达率比较,差异均有统计学意义(P<0.05)。(表1)

表1 不同临床特征鼻咽癌患者鼻咽癌组织中IL-17 A表达情况的比较(n=90)
2.3 鼻咽癌组织中IL-17 A与PD-L 1表达的相关性
90例鼻咽癌组织中,PD-L1阳性52例,阴性48例。PD-L1阳性患者的IL-17A阳性表达率为90.38%(47/52),明显高于 PD-L1阴性患者的18.75%(9/48),差异有统计学意义(χ2=51.982,P<0.01)。Spearman相关分析结果显示,鼻咽癌组织中PD-L1与IL-17A的表达呈正相关(r=0.576,P<0.05)。(表2)

表2 鼻咽癌患者鼻咽癌组织中IL-17 A和PD-L 1的表达情况
2.4 生存情况的比较
随访时间为3~78个月,90例患者均未失访。IL-17A阳性患者的中位生存期为28.5个月,短于IL-17A阴性患者的44.7个月,差异有统计学意义(χ2=4.311,P<0.05)。IL-17A阳性患者的中位无进展生存期为22.9个月,短于IL-17A阴性患者的39.8个月,差异有统计学意义(χ2=4.239,P<0.05)。(图2、图3)
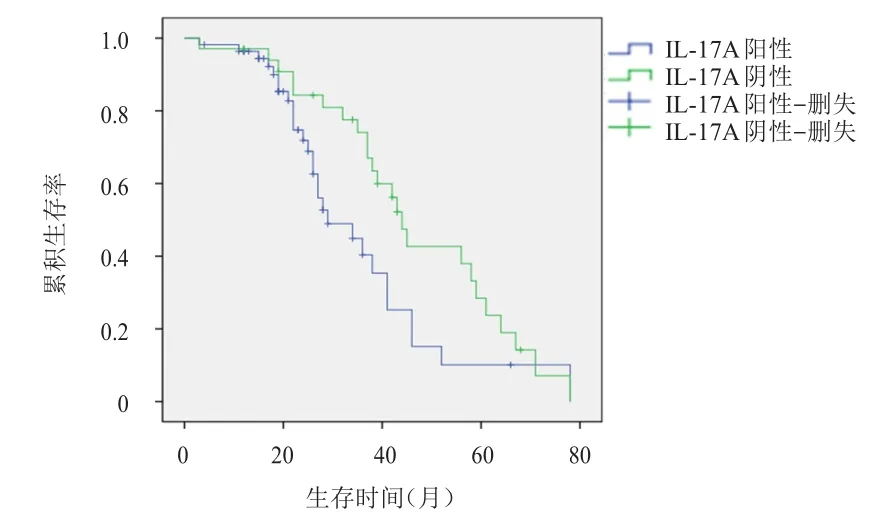
图2 IL-17 A阳性(n=56)与IL-17 A阴性(n=44)患者的总生存曲线
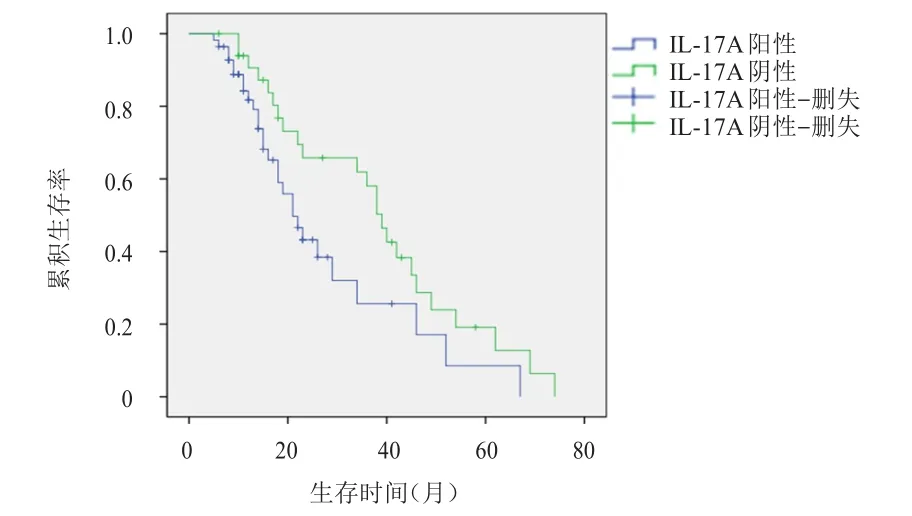
图3 IL-17 A阳性(n=56)与IL-17 A阴性(n=44)患者的无进展生存曲线
3 讨论
在肿瘤微环境中,肿瘤细胞受到天然免疫和获得性免疫的免疫监视。该区域存在丰富的炎性细胞因子,协调抗肿瘤免疫平衡。然而,肿瘤细胞也“劫持”了炎症通路(适应性信号通路),通过增强PD-L1的表达抑制抗肿瘤免疫,并为肿瘤的发展创造有利条件[9]。例如,为了避免T细胞攻击,肿瘤细胞采用干扰素(interferon,IFN)-g/JAK激酶(Janus kinase,JAK)/信号转导及转录激活因子1(signal transduction and activator of transcription 1,STAT1)途径增加PD-L1mRNA 的表达[10]。IFN-γ是由T细胞和自然杀伤细胞产生的一种促炎细胞因子,能够增强主要组织相容性复合体(major histocompatibility complex,MHC)的表达,促进肿瘤细胞呈递新抗原。肿瘤细胞中表达的PD-L1通过IFN-g/JAK/STAT1途径灭活细胞毒性T细胞,减弱肿瘤微环境中的免疫监视。有研究报道,其他炎性细胞因子也可诱导肿瘤细胞或肿瘤相关间质细胞中PD-L1mRNA的表达,如Toll样受体3(Tolllike receptor 3,TLR3)、肿瘤坏死因子(tumor necrosis factor,TNF)-α、IFN-α/β、转化生长因子-β(transforming growth factor-β,TGF-β)和 IL-4/6/17/27 以及趋化因子CXCL9/10/11、CCL20等[11]。
IL-17是一种由Th17细胞产生的促炎细胞因子,其他类型的细胞也产生这种细胞因子,包括第3组固有淋巴样细胞(innate lymphoid cell 3,ILC3)、γδT细胞、不变的自然杀伤T细胞、淋巴组织诱导因子样细胞和自然杀伤细胞等[12]。研究表明,IL-17A在多种肿瘤中表达升高,参与肿瘤的发生发展[7]。而EBV阳性肿瘤的主要特征是明显的炎性浸润,主要由CD8+或CD4+T细胞组成。肿瘤组织中的EBV状态与炎性因子的水平密切相关。van Beek等[13]检测了28例EBV阳性肿瘤患者和34例EBV阴性肿瘤患者血浆中92种免疫相关蛋白的水平,结果发现8种炎性因子的表达水平与EBV阳性有关,其中包括IL-17A。本研究结果显示,IL-17A主要表达于鼻咽癌组织的细胞膜及细胞质中,且在鼻咽癌组织中的阳性表达率高于癌旁组织;IL-17A表达水平也与EBV感染有关,提示其在EBV阳性的肿瘤微环境中发挥重要作用。
IL-17可通过促进肿瘤发生、血管生成和肿瘤转移,导致患者预后较差。IL-17可以上调血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、血管内皮生长因子C(vascular endothelial growth factor C,VEGFC)和血管内皮生长因子D(vascular endothelial growth factor D,VEGFD)的表达,诱导淋巴管生成和血管生成,从而导致肿瘤转移[14]。另有研究表明,IL-17可激活Src促进癌变[15]。其中一个主要的Src激活途径是磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,也称AKT)信号通路,它诱导核因子κB抑制剂(inhibitor of nuclear factor-κB,I-κB)磷酸化,激活致癌蛋白鼠双微体 2(mouse double minute 2,MDM2),阻断p53信号通路。而激活的PI3K/AKT信号通路也阻断了抑制细胞凋亡通路的Fas相关死亡结构域蛋白[16]。此外,IL-17还可诱导促分裂原活化的蛋白激酶(mitogen-activated protein kinase,MAPK)活化,MAPK家族主要由p38MAPK、胞外信号调节激酶(extracellular signal-regulated kinase,ERK)和Jun激酶(Jun kinase,JNK)三个级联信号通路组成,JNK在多种恶性肿瘤的发生发展中具有重要作用[17-18]。本研究结果显示,不同临床分期、组织分化程度、T分期、N分期、EBV阳性情况鼻咽癌患者鼻咽癌组织中IL-17A的阳性表达率比较,差异均有统计学意义(P<0.05)。生存分析结果显示,IL-17A阳性患者的中位生存期和中位无进展生存期均短于IL-17A阴性患者(P<0.05)。提示IL-17A在鼻咽癌的发生发展中具有一定的促进作用。
既往研究显示,IL-1与肿瘤免疫抑制相关,可通过诱导骨髓来源的抑制性细胞,刺激促炎细胞因子如 IL-6、TNF-β和IFN-γ的表达,与之共同发挥作用,从而抑制机体的免疫防御系统,导致肿瘤生长[19]。有研究发现,IL-17可诱导卵巢癌细胞中PDL1及其相关因子IL-6、信号转导及转录激活因子3(signal transduction and activator of transcription 3,STAT3)的表达,是卵巢癌预后不良的潜在生物标志物[20]。本研究结果显示,PD-L1阳性患者的IL-17A阳性表达率明显高于PD-L1阴性患者(P<0.01),且鼻咽癌组织中PD-L1与IL-17A的表达呈正相关(P<0.05)。上述结果表明IL-17A可能参与鼻咽癌的免疫逃逸,导致肿瘤进展。然而其具体的作用机制仍需要通过建立鼻咽癌动物模型进行深入研究。
综上所述,IL-17A在鼻咽癌组织中的阳性表达率较高,其表达情况与EBV感染、PD-L1表达情况、临床分期、组织分化程度及预后有关,IL-17A可能通过影响宿主免疫或肿瘤微环境参与鼻咽癌的免疫逃逸,导致肿瘤进展。IL-17可作为预测鼻咽癌患者预后和PD-L1表达情况的潜在生物标志物,并可能成为治疗的新靶点。
