普鲁卡因通过调节SRY相关高迁移率族盒蛋白 9抑制乳腺癌细胞增殖并诱导凋亡的机制研究
2020-09-14方洁朱建坡张虎吕志峰张淑香
方洁,朱建坡,张虎,吕志峰#,张淑香
河南中医药大学第一附属医院1麻醉科,2血液肿瘤科,郑州450000
乳腺癌是常见的妇科恶性肿瘤,仅2015年世界乳腺癌新发病例高达240万,死亡52万,是女性癌症死亡的主要原因[1]。目前,乳腺癌的临床治疗主要包括外科手术治疗及放疗、化疗、靶向治疗、内分泌治疗等,其中以乳腺癌根治切除术、改良根治术、扩大根治术、保乳术等手术治疗为主[2-3]。但患者经治疗后易出现不同程度的并发症,如焦虑、抑郁、身体机能下降及化疗诱发的上肢淋巴水肿、恶心呕吐、周围神经病变、失眠等,且晚期乳腺癌易转移至肝脏、骨、淋巴等周围正常组织,极难治愈,严重影响患者预后及生活质量[4-5]。麻醉药在肿瘤治疗中被广泛应用,近年来研究表明,阿片类麻醉药物、瑞芬太尼、舒芬太尼等麻醉药物有助于减少不良反应,改善患者术后恢复及预后[6-7]。其中,普鲁卡因(procaine,PCA)已被证实能够通过阻滞细胞周期抑制人乳腺癌MDA-MB-231细胞活力,同时降低细胞迁移能力[8]。研究表明用PCA溶液对乳腺癌改良根治术术中皮瓣创面进行热湿敷可以降低皮瓣坏死发生率[9]。异丙酚联合PCA在治疗乳腺癌时有麻醉诱导快速和维持平稳等良好效果,有利于患者术后恢复[10]。PCA还可抑制人胰腺癌PANC-1细胞[11]、肝癌HepG2细胞[12]的增殖。盐酸PCA能降低脾相关酪氨酸激酶(spleen associated tyrosine kinase,SYK)基因启动子区域CpG岛甲基化从而降低结肠癌发生率[13]。基于以上研究,本研究以人乳腺癌MCF-7细胞为研究对象,通过使用不同浓度PCA干预细胞并检测细胞增殖、凋亡及细胞中SRY相关高迁移率族盒蛋白9(SRY-related high-mobility group box 9,SOX9)基因表达情况,探讨PCA对人乳腺癌MCF-7细胞增殖和凋亡的影响及其潜在作用机制,现报道如下。
1 材料与方法
1.1 材料
人乳腺癌MCF-7细胞购自美国模式菌种收集中心(American Type Culture Collection,ATCC);胎牛血清、DMEM培养基、胰蛋白酶均购自美国Thermo Fisher公司;Lipofectamine 2000转染试剂购自美国Invitrogen公司;Trizol试剂、聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜、电化学发光(electrochemiluminescence,ECL)液、RIPA裂解液、二喹啉甲酸(bicinchoninic acid,BCA)试剂盒、二甲基亚砜(dimethyl sulfoxide,DMSO)均购自北京Solarbio公司;TaKaRa反转录试剂盒、TaKaRa实时荧光定量试剂盒均购自宝生物工程(大连)有限公司;膜联蛋白V(Annexin V)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒均购自美国Coulter公司;兔抗SOX9和β-actin多克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)均购自Abcam公司;Control siRNA、SOX9 siRNA由山东维真生物科技有限公司设计合成;pcDNA-SOX9过表达载体由金瑞斯生物科技公司构建。MCO-18AC型CO2培养箱购自日本SANYO公司;CFX96 Touch TM荧光定量聚合酶链反应(polymerase chain reaction,PCR)检测系统、ChemiDoc TM MP凝胶成像系统均购自美国Bio-Rad公司;Nanodrop ND-2000超微量核酸蛋白测定仪购自上海创萌生物科技有限公司;HBS-1096B型酶标仪购自南京德铁实验设备公司。
1.2 细胞培养、转染与分组
人乳腺癌MCF-7细胞使用含15%胎牛血清的DMEM培养基于37℃、5% CO2饱和湿度条件下培养,每天更换新鲜培养基。将对数生长期的细胞使用0.25%胰蛋白酶消化后重悬,以1×105/孔接种至24孔板,待细胞生长至融合度约45%,按照Lipofectamine 2000转染试剂说明书分别将Control siRNA(记为si-con组)、SOX9 siRNA(记为si-SOX9组)、pcDNA空载体、pcDNA-SOX9过表达载体转染至MCF-7细胞,转染pcDNA空载体、pcDNASOX9过表达载体的细胞培养液中加入PCA并调整终浓度为10.0 mmol/L,继续培养48 h,分别记为PCA+pcDNA组、PCA+pcDNA-SOX9组。
取对数生长期的乳腺癌MCF-7细胞消化后接种于24孔板(1×105/孔)培养,DMEM培养液培养24 h后,吸去原培养液,分为Control组、不同浓度PCA处理组、PCA组,Control组不添加PCA,不同浓度PCA处理组PCA浓度分别为0、2.5、5.0、10.0 mmol/L,PCA组PCA终浓度为10.0 mmol/L。每组3个复孔,实验重复3次。
1.3 MTT法检测细胞增殖
分别在不同浓度PCA处理组、Control组、PCA组、si-con组、si-SOX9组、PCA+pcDNA组、PCA+pcDNA-SOX9组细胞培养24、48、72 h时加入20 μl浓度为5 mg/ml的MTT,继续孵育4 h;吸除多余培养基,加入150 μl DMSO振荡反应10 min,然后用酶标仪检测490 nm处光密度(optical density,OD)值。
1.4 流式细胞仪检测细胞凋亡
取不同浓度PCA处理组、Control组、PCA组、si-con组、si-SOX9组、PCA+pcDNA组、PCA+pcDNA-SOX9组生长状态良好的细胞,用不含乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的胰酶消化细胞,离心收集各组细胞,磷酸盐缓冲液(phosphate buffered saline,PBS)漂洗2次,加结合缓冲液重悬细胞。按照Annexin V-FITC/PI细胞凋亡检测试剂盒说明书,在含MCF-7细胞的24孔板中分别加入 5 μl Annexin V-FITC 和 10 μl PI,轻轻混匀后室温避光孵育15 min,流式细胞仪检测激发波长488 nm和发射波长530 nm处的荧光强度。实验重复3次。
1.5 实时荧光定量聚合酶链反应(real-time fluorescence quantitative-polymerase chain reaction,qRT-PCR)检测SOX 9 mRNA表达情况
收集不同浓度PCA处理组细胞,研磨充分后加入Trizol试剂提取总RNA,微量核酸测定仪检测RNA纯度和浓度。分别使用TaKaRa反转录试剂盒和TaKaRa荧光定量试剂盒,将RNA反转录为cDNA。按照AceQ qPCR SYBR®Green Mix说明书进行qRT-PCR方法扩增。循环条件为95℃30 s,60 ℃ 30 s;72 ℃ 30 s,共40个循环;60 ℃延长5 min。以β-actin为内参进行PCR扩增,每个样品重复3次,实验结果以2-△△Ct表示相对表达量。β-actin引物:正向,5'-TGGATCAGCAAGCAGGAGTA-3',反向 ,5'-TCGGCCACATTGTGAACTTT-3';SOX9引物:正向,5'-CAGAAGTACTGGGAAAGTCGT-3',反向,5'-CCGGTACTTGTAGTTGGGGTAGT-3'。
1.6 蛋白质印迹法(Western blot)检测SOX 9蛋白表达情况
收集不同浓度PCA处理组、Control组、PCA组、si-con组、si-SOX9组、PCA+pcDNA组、PCA+pcDNA-SOX9组细胞,加入RIPA裂解液裂解,4℃,10 340 r/min离心15 min,收集蛋白上清液,BCA试剂盒测定蛋白浓度。将蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamidegelelectrophoresis,SDSPAGE)后转至PVDF膜上,5%脱脂奶粉封闭液室温封闭1 h。分别加入兔抗SOX9(1∶1000)和β-actin(1∶1000)多克隆抗体4 ℃孵育过夜,TBST洗膜;加入HRP标记的山羊抗兔IgG(1∶5000)室温孵育2 h,TBST洗涤3次,每次10 min;ECL发光显影,每个蛋白样品重复3次。
1.7 统计学分析
采用SPSS 22.0软件进行统计学分析,计量资料以均数±标准差(±s)表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析(ANOVA),以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度PCA对MCF- 7细胞增殖的影响
培养48、72 h时,随着PCA浓度增加,MCF-7细胞OD490值逐渐下降(P<0.05)。(表1)
2.2 不同浓度PCA对MCF- 7细胞凋亡的影响
以不同浓度PCA干预MCF-7细胞48 h显示,2.5 mmol/L组、5.0 mmol/L组和10.0 mmol/L组MCF-7细胞凋亡率分别为(12.83±1.31)%、(21.08±2.27)%、(36.34±3.45)%,均高于 0 mmol/L 组的(7.21±0.85)%,差异均有统计学意义(t=10.797、17.166、24.595,P<0.05),并且细胞凋亡率随PCA浓度的增加而提高(F=296.425,P<0.05)。(图1)
表1 不同时间点不同浓度PCA组MCF- 7细胞OD490值的比较(± s)
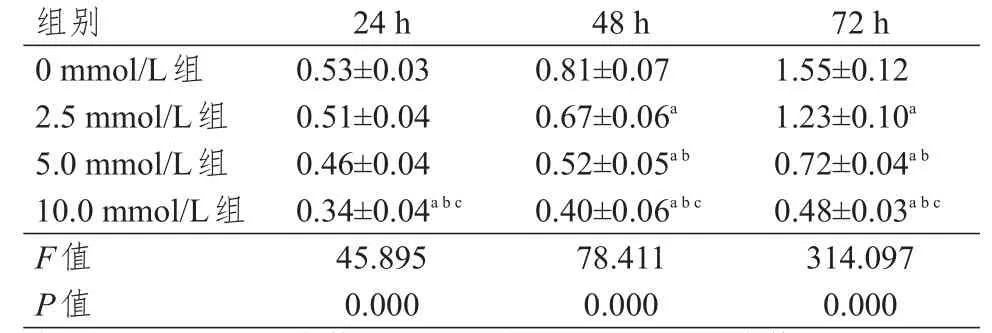
表1 不同时间点不同浓度PCA组MCF- 7细胞OD490值的比较(± s)
注:a与0 mmol/L组比较,P<0.05;b与2.5 mmol/L组比较,P<0.05;c与5.0 mmol/L组比较,P<0.05
48 h 0.81±0.07 0.67±0.06a 0.52±0.05a b 0.40±0.06a b c 78.411 0.000 0.53±0.03 0.51±0.04 0.46±0.04 0.34±0.04a b c 45.895 0.000 1.55±0.12 1.23±0.10a 0.72±0.04a b 0.48±0.03a b c 314.097 0.000 0 mmol/L组2.5 mmol/L组5.0 mmol/L组10.0 mmol/L组F值P值24 h 72 h组别
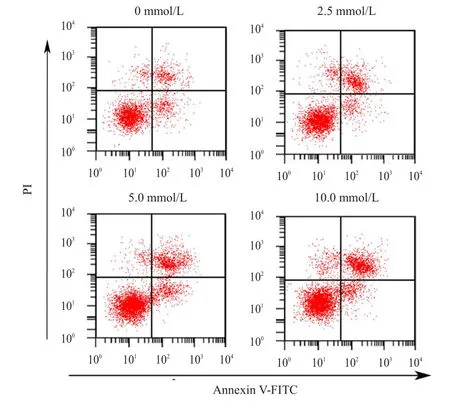
图1 流式细胞仪检测MCF- 7细胞凋亡情况
2.3 不同浓度PCA对MCF- 7细胞中SOX 9表达情况的影响
以 2.5 mmol/L、5.0 mmol/L、10.0 mmol/L浓度的PCA干预MCF-7细胞48 h后,随着PCA浓度增加,SOX9mRNA及SOX9蛋白水平均逐渐下降(P<0.05)。(图2、表2)
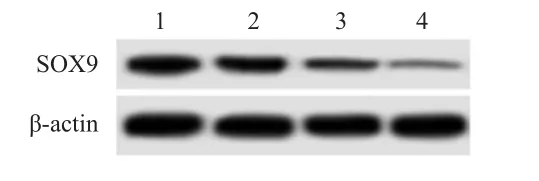
图2 Western blot法检测不同浓度PCA组MCF- 7细胞中SOX 9蛋白表达情况
表2 不同浓度PCA组MCF- 7细胞中SOX 9 mRNA及SOX 9蛋白表达情况的比较(±s)
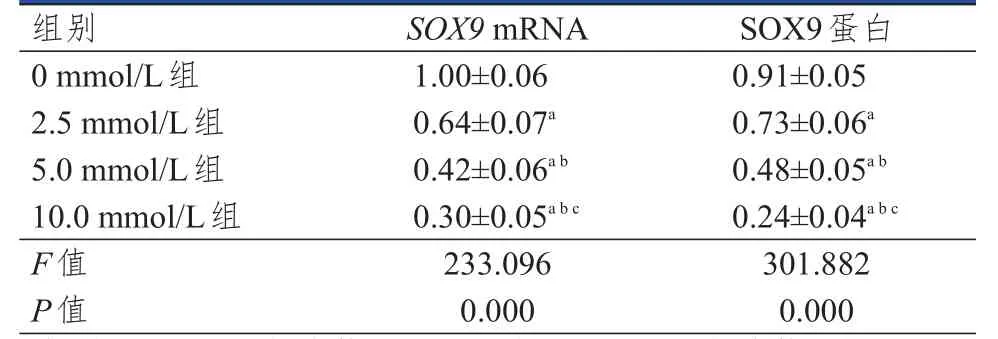
表2 不同浓度PCA组MCF- 7细胞中SOX 9 mRNA及SOX 9蛋白表达情况的比较(±s)
注:a与0 mmol/L组比较,P<0.05;b与2.5 mmol/L组比较,P<0.05;c与5.0 mmol/L组比较,P<0.05
组别0 mmol/L组2.5 mmol/L组5.0 mmol/L组10.0 mmol/L组F值P值1.00±0.06 0.64±0.07a 0.42±0.06a b 0.30±0.05a b c 233.096 0.000 0.91±0.05 0.73±0.06a 0.48±0.05a b 0.24±0.04a b c 301.882 0.000 SOX9 mRNA SOX9蛋白
2.4 沉默SOX 9表达对MCF- 7细胞增殖和凋亡的影响
si-SOX9组MCF-7细胞中SOX9蛋白表达量及OD490值均低于si-con组,凋亡率高于si-con组,差异均有统计学意义(P<0.05)。(图3、表3)

图3 Western blot法检测Control组、si-con组、si-SOX 9组MCF- 7细胞中SOX 9蛋白表达情况
表3 Control组、si-con组、si-SOX 9组MCF- 7细胞SOX 9蛋白表达、OD490值及凋亡率的比较(±s)

表3 Control组、si-con组、si-SOX 9组MCF- 7细胞SOX 9蛋白表达、OD490值及凋亡率的比较(±s)
注:*与si-con组比较,P<0.05
组别Control组si-con组si-SOX9组F值P值SOX9蛋白0.89±0.06 0.85±0.07 0.36±0.06*194.355 0.000 OD490值24 h 0.51±0.04 0.52±0.05 0.39±0.04*24.790 0.000 48 h 0.84±0.07 0.80±0.07 0.47±0.05*90.512 0.000 72 h 1.58±0.12 1.47±0.11 0.64±0.07*227.092 0.000凋亡率(%)6.96±0.92 7.80±1.13 24.11±2.68*271.210 0.000
2.5 过表达SOX 9对MCF- 7细胞增殖和凋亡的影响
以10 mmol/L PCA干预的PCA组MCF-7细胞中SOX9蛋白表达量及OD490值均低于Control组,凋亡率高于Control组,差异均有统计学意义(P<0.05)。PCA+pcDNA-SOX9组MCF-7细胞中SOX9蛋白表达量及OD490值均高于PCA+pcDNA组,凋亡率低于PCA+pcDNA组,差异均有统计学意义(P<0.05)。(图4、表4)

图4 Western blot法检测Control组、PCA组、PCA+pcDNA组、PCA+pcDNA-SOX 9组MCF- 7细胞中SOX 9蛋白表达情况
3 讨论
目前手术切除仍然是乳腺癌的主要治疗手段,在不断的临床研究中发现,麻醉药物对肿瘤细胞生长、转移和复发有一定影响[14]。PCA是常用的局部麻醉药物之一,能够通过抑制细胞周期蛋白D1(cyclin D1)、细胞周期蛋白E(cyclin E)及胞外信号调 节 激 酶(extracellular-signal-regulated kinase,ERK)、丝裂原激活蛋白激酶(mitogen activation protein kinase,MAPK)的磷酸化,从而抑制ERK/MAPK信号通路,减少结肠癌细胞增殖和迁移并促进细胞凋亡,反之,激活ERK/MAPK信号通路可逆转PCA对细胞增殖、迁移和凋亡的诱导作用[15]。据报道,PCA可抑制DNA甲基化转移酶活性,降低基因启动子区的DNA甲基化水平(DNA异常甲基化是肿瘤早期发生发展的标志之一),同时抑制胃癌细胞增殖并诱导凋亡,具有肿瘤抑制作用[16]。但不同剂量不同细胞中PCA的效果不同,如在结肠癌细胞中,剂量过高的PCA上调DNA甲基化水平并促进细胞增殖[17]。PCA对不同类型肿瘤细胞的生长的影响需进行更多研究。本研究通过使用不同浓度PCA处理MCF-7细胞后发现,细胞增殖能力受到抑制,同时凋亡率增高,均呈浓度依赖性;此外,PCA对细胞中SOX9mRNA和蛋白的表达也具有抑制作用,这一抑制作用随PCA浓度的增加而增强。
SOX基因家族是一类含有高度保守的DNA结合区域高迁移率组蛋白(high mobility group,HMG)结构域的转录因子家族,根据HMG序列同源性可分为8个亚族(A~H),各成员之间存在相互协同的功能[18]。其中,SOX9被发现于骨骼发育缺陷患者体内,定位于人染色体17q24.1~q25.1,可编码509个蛋白,在胚胎发育、软骨细胞分化、器官发育、男性性发育中起重要作用[19-20]。多项研究表明,SOX9在肝癌、非小细胞肺癌等多种人类肿瘤组织中高表达,其表达水平与患者预后、总体生存率存在显著相关性,SOX9的高表达水平能够促进肿瘤细胞增殖、迁移、侵袭及上皮-间充质转化,从而促进肿瘤转移[21-22]。此外,Huang和Guo[23]研究发现,SOX9在甲状腺癌组织及其细胞系中表达上调,通过沉默SOX9表达可有效降低细胞中cyclin D1、c-myc和β-连环蛋白表达量,从而抑制细胞增殖、迁移、侵袭及上皮-间充质转化过程。而在乳腺癌中,已有研究证实,采用RNAi技术沉默SOX9表达可显著抑制乳腺癌细胞增殖、迁移和侵袭,减少细胞克隆形成,过表达SOX9可逆转miRNA-133b对细胞生长和转移的抑制作用[24]。本研究将SOX9 siRNA转染至MCF-7细胞后发现,细胞增殖受到抑制,这一结果与文献结论一致,并且能够促进细胞凋亡;而将pcDNA-SOX9过表达载体转染至MCF-7细胞进行预处理,可减弱PCA对细胞增殖的抑制和凋亡的诱导作用。

表4 Control组、PCA组、PCA+pcDNA组、PCA+pcDNA-SOX 9组MCF- 7细胞SOX 9蛋白表达、OD490值及凋亡率的比较(x-±s)
综上所述,PCA能够抑制MCF-7细胞增殖并促进细胞凋亡,可能是通过调节SOX9表达完成,提示SOX9可能是乳腺癌治疗的新靶点;PCA和SOX9在乳腺癌中的具体作用机制仍需进一步研究,这一研究结果有望为乳腺癌的治疗提供新思路。
