丝氨酸/精氨酸蛋白特异性激酶- 2在胃癌组织中的表达情况及临床意义△
2020-09-14王健赵海剑徐东燕李菁妍张晓雨
王健,赵海剑,徐东燕,李菁妍,张晓雨#
徐州医科大学附属淮安医院/淮安市第二人民医院1胃肠外科,2消化内科,3病理科,江苏淮安223002
胃癌是中国第二大常见恶性肿瘤,约占全球恶性肿瘤发病率的40%,2018年全球胃癌新增病例超过100万例,死亡人数约为78.3万,仍是全球第五大常见恶性肿瘤及第三大恶性肿瘤死亡病种,严重威胁人类健康[1-4]。已在多种肿瘤中发现高表达的丝氨酸/精氨酸蛋白特异性激酶-2(serine/arginine protein-specific kinase 2,SRPK2)与肿瘤的进展、转移密切相关。但是,关于SRPK2与胃癌关系的研究仍较少。本研究分析了SRPK2在胃癌中的表达情况,并对其与胃癌患者临床特征及预后的关系进行探讨,现报道如下。
1 资料与方法
1.1 一般资料
选取2013年1月至2018年1月徐州医科大学附属淮安医院收治的胃癌患者。纳入标准:①经病理学检查确诊为胃癌;②术前均未接受放疗、化疗、内分泌治疗和靶向治疗等相关治疗;③均接受了根治性切除手术;④临床资料完整。排除标准:①合并其他恶性肿瘤;②术后随访失联。根据纳入和排除标准,本研究共纳入85例胃癌患者。其中,男45例,女40例;年龄为42~86岁,中位年龄为71岁。参照美国癌症联合委员会(American Joint Committee on Cancer,AJCC)颁布的关于胃癌的TNM分期标准[5]:I期8例,Ⅱ期20例,Ⅲ期54例,Ⅳ期3例;分化程度:中高分化59例,低分化26例;无淋巴结转移23例,有淋巴结转移62例;肿瘤直径:>5 cm者37例,≤5 cm者48例;肿瘤部位:贲门及胃底15例,胃体32例,胃窦38例。收集胃癌患者经手术切除的胃癌组织及相应的癌旁组织标本各85例,癌旁组织取自距胃癌边缘>5 cm的组织,且均经病理检查诊断为正常胃黏膜组织。
1.2 免疫组织化学染色方法
采用免疫组化染色法检测胃癌组织及癌旁组织中SRPK2的表达情况。收集患者的胃癌及癌旁组织标本,10%甲醛溶液固定,常规石蜡包埋。将石蜡标本切成厚约4 μm的切片后脱蜡、水化,3%过氧化氢去离子水封闭过氧化酶15 min,蒸馏水浸泡3 min,枸橼酸缓冲液中热修复抗原,磷酸盐缓冲液(phosphate buffered saline,PBS)浸泡3 min。加入鼠抗人SRPK2抗体(稀释浓度1∶200),冰箱4℃过夜,37℃复温,PBS浸泡3 min,30 min后冲洗并滴加兔抗鼠二抗,37℃孵育30 min,二氨基联苯胺(diaminobenzidine,DAB)显色,梯度乙醇脱水,二甲苯透明,中性树脂封片,显微镜下观察。以PBS代替一抗作为阴性对照,以已知阳性切片为阳性对照。
1.3 免疫组织化学染色结果判定
所有免疫组织化学染色结果均由两位经验丰富的病理医师采用双盲法阅片。SRPK2阳性表达呈棕黄色颗粒,定位于细胞核。每张切片于200倍光学显微镜镜下随机选取5个视野,每个视野计数100个细胞,对阳性染色细胞数量和肿瘤细胞总数进行计算。根据每个视野中阳性细胞所占百分比和染色强度进行评分,采用半定量积分法判断其表达情况。依据阳性细胞所占百分比评分:≤5%为0分,6%~25%为1分,26%~50%为2分,≥51%为3分。依据染色强度评分:无色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分。阳性细胞所占百分比和染色强度评分相加,0~1分为阴性表达(-),2分为弱阳性表达(+),3~4分为中等阳性表达(++),5~6分为强阳性表达(+++)。
1.4 随访
采用电话或门诊的方式对所有患者于术后3个月开始进行随访,随访截止日期为2018年9月31日。术后2年内,每2~3个月随访1次;术后2~5年内,每半年随访1次;术后5年以上者,每年随访1次。统计所有患者的生存情况。生存时间按月记录,生存时间定义为从患者手术当日至随访截止或患者死亡的时间。失访定义为非肿瘤原因死亡病例及截止点仍生存病例按统计分析要求列为截尾数据处理。
1.5 统计学方法
采用SPSS 25.0软件对数据进行统计分析。计数资料以例数和率(%)表示,组间比较采用χ2检验。采用Kaplan-Meier法进行生存分析并作生存曲线,组间比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 不同组织中SRPK 2的表达情况
免疫组化染色结果显示,胃癌组织中SRPK2的阳性表达率为64.7%(55/85),明显高于癌旁组织中的21.2%(18/85),差异有统计学意义(χ2=32.867,P<0.01)。(图1)
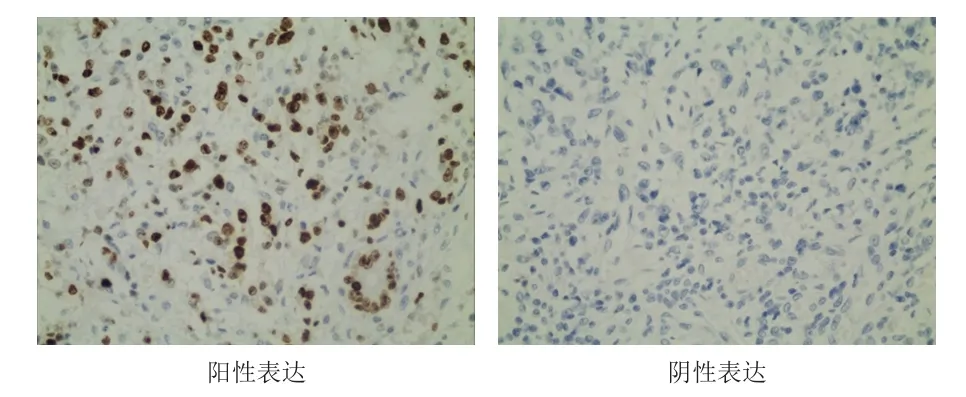
图1 胃癌患者胃癌组织中SRPK 2的表达情况(免疫组织化学染色,×400)
2.2 不同临床特征胃癌患者胃癌组织中SRPK 2的表达情况
浸润深度(根据T分期)为T3~4期、有淋巴结转移、肿瘤直径>5 cm、TNM分期为Ⅲ~Ⅳ期胃癌患者胃癌组织中SRPK2的阳性表达率均高于浸润深度(根据T分期)为T1~2期、无淋巴结转移、肿瘤直径≤5 cm、TNM分期为I~Ⅱ期的胃癌患者,差异均有统计学意义(P<0.05);不同性别、年龄、肿瘤分化程度、肿瘤部位胃癌患者胃癌组织中SRPK2的阳性表达率比较,差异均无统计学意义(P>0.05)。(表1)
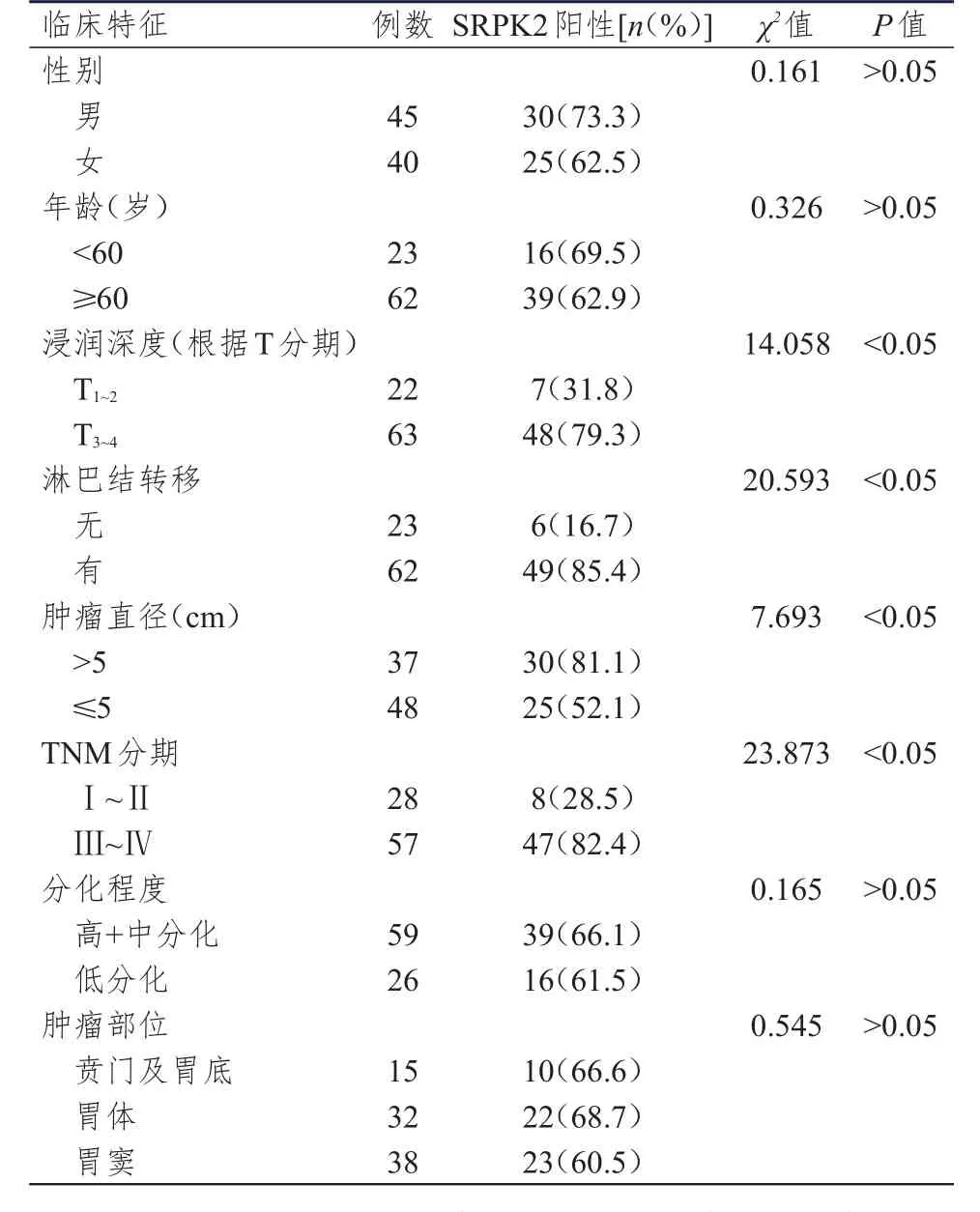
表1 不同临床特征胃癌患者胃癌组织中SRPK 2的阳性表达情况(n=85)
2.3 SRPK 2表达与胃癌患者术后 5年总生存率的关系
两组患者均获得有效随访,随访时间为7~67个月,死亡患者44例。截至随访结束,SRPK2阳性表达的胃癌患者55例,死亡36例;SRPK2阴性表达的胃癌患者30例,死亡8例。Kaplan-Meier生存曲线显示,SRPK2阴性表达的胃癌术后患者的5年生存情况优于SRPK2阳性表达的胃癌患者,差异有统计学意义(χ2=5.668,P=0.017)。(图2)

图2 SRPK 2阳性表达(n=55)和SRPK 2阴性表达(n=30)胃癌术后患者的总生存曲线
3 讨论
SRPK2属于丝氨酸/精氨酸蛋白特异性激酶(serine/arginine protein-specific kinase,SRPK)家族成员,在人类的大脑、睾丸中呈高表达,在心脏、骨骼肌中呈中等强度表达。SRPK主要通过调节丝氨酸/精氨酸蛋白的磷酸化反应与mRNA前体特异序列结合,有助于拼接因子识别正确拼接点,同时可通过调节RNA剪接因子调控细胞周期,从而发挥一系列生理功能。近年来,在肿瘤中发现了mRNA前体剪接的异常现象,而SRPK2作为mRNA前体剪接的主要调控因子,在其中发挥了重要作用[6]。
有研究发现,在白血病中高表达的SRPK2通过调节细胞周期蛋白A1(cyclin-A1,CCNA1)从而促进肿瘤细胞的增殖[7]。在实体瘤中亦发现SRPK2基因表达的失衡与恶性肿瘤的发生密切相关。既往研究发现SRPK2在非小细胞肺癌、肝细胞癌、头颈部鳞状细胞癌中均呈高表达[8-10]。此外,Wang等[11]发现SRPK2可促进胰腺癌的发生和进展。亦有研究证实,SRPK2在结直肠癌中呈高表达,并通过与鼠类肉瘤滤过性毒菌致癌性同源体B1(v-raf murine sarcoma viral oncogene homolog B1,BRAF)形成复合体,激活胞外信号调节激酶(extracellular signal-regulated kinase,ERK)通路,从而促进结直肠癌细胞的增殖和迁移[12]。Zhou等[13]通过进行前列腺癌体外实验发现,促进SRPK2的表达可促进前列腺癌细胞的迁移和侵袭;前列腺癌组织中的SRPK2呈高表达,且与肿瘤的进展和转移有关。本研究采用免疫组织化学染色法检测了85例胃癌患者的胃癌组织及癌旁组织中SRPK2的阳性表达情况,结果显示,胃癌组织中SRPK2的阳性表达率明显高于癌旁组织(P<0.01),与上述研究结果一致,提示SRPK2与胃癌的发生有一定的关心。本研究进一步对85例胃癌患者的临床特征进行分析,结果显示,SRPK2的阳性表达与胃癌患者的年龄、性别、分化程度、肿瘤部位可能无关,而肿瘤直径越大、肿瘤浸润深度越深、出现淋巴结转移、TNM分期越晚,SRPK2在胃癌患者胃癌组织中的阳性表达率越高。提示SRPK2不仅与胃癌的发生有关,还可能对胃癌的进展、转移具有促进作用。术后随访结果显示,阳性表达的胃癌患者的5年生存率低于SRPK2阴性表达的胃癌患者,预后较差。分析其原因可能与SRPK2对胃癌的进展、转移具有促进作用有关,导致SRPK2阳性胃癌患者的病情进展更快,生存期更短,预后更差。
综上所述,胃癌患者的胃癌组织中SRPK2的阳性表达率较高,可能与胃癌的发生、发展有一定关系,SRPK2阳性表达的胃癌患者的预后较差。SRPK2可能成为胃癌临床诊疗及预后评估的生物学标志物。
