FOXO4和nNOS在星型胶质细胞瘤中的表达及意义
2019-08-05刘溪林孙乐安郑兰荣
齐 敏,刘溪林,赵 健,吴 锋,孙乐安,郑兰荣
(皖南医学院 1.人体解剖学实验实训中心;2.研究生学院;3.人体解剖学教研室;4.病理解剖学教研室,安徽 芜湖 241002)
星型胶质细胞瘤在胶质瘤(Glioma)中占绝大多数,具有高侵袭性、高致死率特点[1]。传统治疗方法(手术、化疗和放疗)并没有完全解决胶质瘤侵袭性生长所致的高复发率的难题[2]。越来越多的研究者从基因水平研究肿瘤侵袭性、血管生成及肿瘤发生率。转录因子叉头框蛋白O4(Forkhead boxO4,FOXO4)具有广泛的生物学功能,包括调节细胞的能量代谢、增殖、凋亡和分化[3]。神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)具有神经毒性作用[4]。本研究应用免疫组化和免疫荧光检测FOXO4和nNOS在星型胶质细胞瘤中的表达情况,并分析其与临床病理特征之间的关系,旨在阐明FOXO4和nNOS在星型胶质细胞瘤发生发展中的可能作用机制。
1 材料与方法
1.1 一般资料 从弋矶山医院病理科调取2013年1月~2018年1月行外科手术切除的星型胶质细胞瘤石蜡标本27例,其中男性14例,女性13例;年龄30~75岁。所有星型胶质细胞瘤患者术前均未接受任何抗肿瘤治疗。术后病理按WHO分级标准,其中Ⅰ级5例、Ⅱ级8例、Ⅲ级10例、Ⅳ级4例。另取材时采用瘤周组织作为对照组。
1.2 主要试剂 兔抗FOXO4和nNOS、抗荧光淬灭剂和SABC试剂盒均购于北京博奥森生物技术有限公司。荧光二抗购于英国Abcam公司,DAPI购于南京凯基生物有限公司。
1.3 免疫组化检测 取各例星型胶质细胞瘤的石蜡标本进行切片,片厚5 μm。按照免疫组化试剂盒说明书依次进行各步骤,封片,镜下观察。高倍镜下每个肿瘤切片随机选取2个视野,图像分析软件测量400倍视野下FOXO4与nNOS在不同级别星形胶质细胞瘤中阳性产物的平均灰度值(灰度值越大说明表达越弱,反之则越强)。对照组用PBS替代一抗做为阴性对照。
1.4 免疫荧光检测 取各例星型胶质细胞瘤的石蜡标本进行切片,片厚5 μm。按照免疫荧光的方法依次孵育一抗、荧光二抗、DAPI染核等。最后用抗荧光淬灭剂封片,透明指甲油封边,在荧光显微镜下观察。高倍镜下每个肿瘤切片随机选取1个视野,观察荧光强弱,比较FOXO4与nNOS在高级别(Ⅲ、Ⅳ级)与低级别(Ⅰ级、Ⅱ级)星型胶质细胞瘤中的表达情况。对照组用PBS替代一抗做阴性对照。
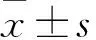
2 结果
2.1 FOXO4的免疫组化和免疫荧光表达 免疫组织化学染色检测结果显示,低级别和高级别星型胶质细胞瘤均可见FOXO4阳性细胞,呈棕黄色或棕褐色,着色主要位于胞核。肿瘤组织FOXO4的阳性表达比瘤周正常脑组织低(图1)。
结果显示,Ⅳ级、Ⅲ级和Ⅱ级星型胶质细胞瘤组织FOXO4阳性细胞的平均灰度值高于Ⅰ级星型胶质细胞瘤组织FOXO4阳性细胞(P<0.05),Ⅳ级和Ⅲ级星型胶质细胞瘤组织FOXO4阳性细胞的平均灰度值高于Ⅱ级星型胶质细胞瘤组织FOXO4阳性细胞(P<0.05),Ⅳ级星型胶质细胞瘤组织FOXO4阳性细胞的平均灰度值高于Ⅲ级星型胶质细胞瘤组织FOXO4阳性细胞(P<0.05),见图2、表1。

左上角为瘤周组织,着色较深,右下角为肿瘤组织,着色较浅。黑色箭头所示为瘤周组织中FOXO4阳性细胞,红色箭头所示为Ⅲ级星形胶质细胞瘤中FOXO4阳性细胞。该视野下随机选取四个肿瘤细胞和四个瘤周细胞,测得灰度值平均值分别为88.72,129.75(SABC法,×200)。
图1 星型胶质细胞瘤及瘤周组织中FOXO4表达

箭头所示为Ⅰ、Ⅱ、Ⅲ、Ⅳ级星形胶质细胞瘤瘤组织中FOXO4 阳性细胞。标尺=30 μm(SABC法,×400)。
图2 各级别星型胶质细胞瘤瘤组织FOXO4的表达
表1 星型胶质细胞瘤组织FOXO4阳性细胞的平均灰度值

组别n灰度值FPⅠ级565.78±5.25aⅡ级8105.50±5.61b778.4400.000Ⅲ级10153.20±1.90cⅣ级4172.40±1.45d
注:多组间两两比较。符号不同表示P<0.05。
免疫荧光方法检测,完成DAPI细胞核染色(呈蓝色荧光),FOXO4染色(呈绿色荧光),两者叠加(Merge)后可以证实FOXO4染色基本位于细胞核。同时荧光染色条件下,可观察到低级别的星型胶质细胞瘤阳性表达率高于高级别(图3)。
2.2 nNOS的表达 免疫组织化学染色检测结果显示,低级别和高级别星型胶质细胞瘤瘤组织均可见nNOS阳性细胞,呈棕黄色或棕褐色,胞质和胞膜着色。肿瘤组织FOXO4的阳性表达比瘤周正常脑组织高(图4)。

图中用DAPI标记的为星型胶质瘤细胞的核定位,可发现FOXO4的表达随着肿瘤恶性程度的增加而降低(免疫荧光,×400)。
图3 各级星型胶质细胞瘤瘤组织FOXO4阳性表达

左上角为肿瘤组织,着色较深,右下角为瘤周组织,着色较浅。黑色箭头所示为瘤周组织中nNOS阳性细胞,红色箭头所示为Ⅲ级星形胶质细胞瘤组织中nNOS阳性细胞。该视野下随机选取四个肿瘤细胞和四个瘤周细胞,测得灰度值平均值分别为94.07、158.76(SABC法,×200)。
图4 星型胶质细胞瘤及瘤周组织中nNOS表达
结果显示,Ⅳ级、Ⅲ级和Ⅱ级星型胶质细胞瘤组织nNOS阳性细胞的平均灰度值低于Ⅰ级星型胶质细胞瘤组织nNOS阳性细胞(P<0.05),Ⅳ级和Ⅲ级星型胶质细胞瘤组织nNOS阳性细胞的平均灰度值低于Ⅱ级星型胶质细胞瘤组织nNOS阳性细胞(P<0.05),Ⅳ级星型胶质细胞瘤组织nNOS阳性细胞的平均灰度值低于Ⅲ级星型胶质细胞瘤组织nNOS阳性细胞(P<0.05),见图5、表2。
免疫荧光结果显示,nNOS在高级别星型胶质细胞瘤瘤组织中的阳性表达高于低级别的星型胶质细胞瘤(图6)。
表2 星型胶质细胞瘤组织FOXO4阳性细胞的平均灰度值

组别n灰度值FPⅠ级5163.30±2.79eⅡ级8156.10±1.94f464.6890.000Ⅲ级10114.10±2.45gⅣ级486.39±8.87h
注:多组间两两比较。符号不同表示P<0.05。
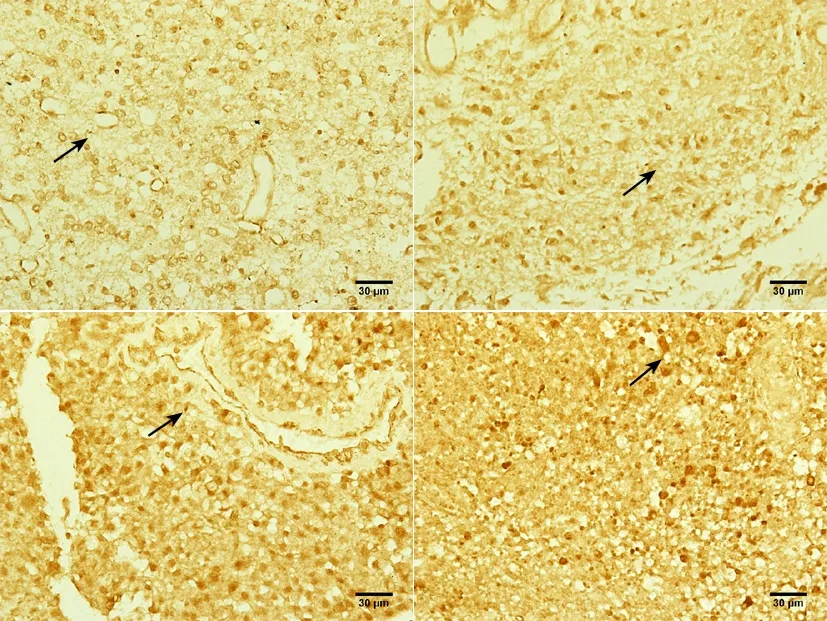
箭头所示为Ⅰ、Ⅱ、Ⅲ、Ⅳ级星型胶质细胞瘤瘤组织中nNOS阳性细胞。标尺=30 μm(SABC法,×400)。
图5 各级别星型胶质细胞瘤瘤组织中nNOS的阳性表达

图中用DAPI标记的为星型胶质瘤细胞的核定位,可发现nNOS的表达随着肿瘤恶性程度的增加而增强(免疫荧光,×400)。
图6 各级星型胶质细胞瘤nNOS阳性表达
3 讨论
人脑星型胶质细胞瘤是中枢神经系统中常见的恶性肿瘤,与神经系统以外的其他肿瘤不同,该肿瘤不发生转移但具有很强的侵袭性[5]。胶质瘤细胞的高度侵袭性和高度血管生成能力是影响预后的重要原因。FOXO4转录因子为FOXO家族成员,FOXO家族参与各种信号通路,调节细胞周期进程,DNA损伤修复和分化,并促进细胞死亡[6]。FOXO家族受多种信号通路调控,其中最明显的受PI3K-Akt/PKB介导磷酸化级联通路的负调控[7-8]。在鼻咽癌组织中,FOXO4受mir-421的直接靶向作用,引起FOXO4表达的下调,表现为肿瘤细胞的增殖增强[9]。大量研究显示,FOXO4在肺癌、结肠癌、膀胱癌等多种人类肿瘤中的表达都有所下调或缺失,FOXO4在肿瘤中的表达较正常组织的表达减少[6-12]。本研究结果显示,随着星形胶质细胞瘤级别的增加,FOXO4的表达逐渐减少,呈负相关,这与FOXO4在其他肿瘤中的表达基本一致。据此,结合既往研究与本研究结果进一步提示,FOXO4可能具有抑制肿瘤细胞增殖、血管生成的作用,其下调或缺失可致肿瘤的生长加速。由此可见,FOXO4可能是一个潜在的非特异性(广谱)的癌症治疗靶点。
NO是脑组织中重要的信使分子,参与了肿瘤的病理生理过程[13]。大脑额叶一氧化氮合酶(nitricoxide synthase,NOS)阳性神经元的生长发育对其他多种神经元和神经胶质细胞的分化、增殖、迁移以及大脑血管的生长发育具有重要作用。NOS及其催化L-精氨酸形成的NO,在机体内具有广泛的生物学作用,可参与神经元发育、轴突生长、突触形成和修复过程,在肿瘤形成等过程中发挥重要作用[14-15]。有研究发现NOS及其催化而形成的NO,在口腔鳞癌、胃癌、大肠癌等多种肿瘤中有重要作用[16-18]。NO使得胶质瘤细胞运动增加,NOS抑制剂可能在神经肿瘤学中有治疗作用[18-19]。nNOS为NOS同功酶的三种亚型之一,nNOS被认为有神经毒性作用[4-5]。正常的脑组织nNOS表达较少,脑组织的高脂浓度和高能量要求,使其特别容易受到自由基和氧化剂介导的损伤:脑深部神经元NADPH-d/nNOS标记的神经元减少[19]。本次实验结果显示,nNOS在高级别(Ⅲ、Ⅳ级)星形胶质细胞瘤中表达高于低级别(Ⅰ、Ⅱ级)星形胶质细胞瘤,提示肿瘤相关因子nNOS的异常高表达可能与人脑星型胶质细胞瘤的恶性程度以及侵袭性生长有关。具体机制有待进一步研究,以期为治疗星形胶质细胞瘤靶向药物的研究提供参考资料。
鉴于转录因子FOXO4和肿瘤相关因子nNOS参与了肿瘤的生长、转移过程[3-4],本研究结果表明FOXO4、nNOS的异常表达可能与星形胶质细胞瘤的浸润性生长有关,下一步将深入研究验证FOXO4、nNOS与星形胶质细胞瘤病理级别的关系,并寻找FOXO4、nNOS两种因子对于肿瘤的具体作用机制和通路,从基因水平进一步探讨星形胶质细胞瘤的发生发展机制。
