富含莫纳可林K 燕麦红曲的快速发酵
2020-09-10李坚华吴佩芝冯艳丽
李坚华, 徐 方, 吴佩芝, 胡 婷, 冯艳丽
(1. 湖北师范大学 食用野生植物保育与利用湖北省重点实验室, 湖北 黄石435002;2. 湖北师范大学 生物学国家级实验教学示范中心,湖北 黄石435002;3. 湖北师范大学 生命科学学院,湖北 黄石435002)
燕麦是少数同时具有营养、保健和药用价值的粮食作物之一。 燕麦富含淀粉、蛋白质、膳食纤维、亚油酸、维生素E 和多酚等物质[1]。 1997年,美国食品药品管理局认定燕麦为功能性食物,它具有降低胆固醇、平稳血糖等功效[2]。 燕麦主要分为2 种,一种是带稃型的皮燕麦, 另一种是无稃型的裸燕麦。其中裸燕麦的蛋白质、脂肪、氨基酸、黄酮等营养和功能活性物质含量显著高于皮燕麦[3]。 燕麦中蛋白质、油脂和可溶性纤维素含量均居谷物之首,其淀粉含量在50.0%~65.0%之间,比玉米和小麦等所含淀粉更易于糊化,且其含有大量膳食纤维使其具有较高的持水性和膨胀力, 是良好的微生物发酵基质,可用于红曲菌等的固态发酵[4-5]。
红曲菌(Monascus spp.)是我国具有传统特色的药食两用微生物资源。 红曲是指将红曲菌接种于淀粉质原料发酵而成的产品,其成品的颜色多呈赤红色或紫红色。 因红曲菌可发酵产生多种功能性代谢产物如莫纳可林K (Monacolin K,MK)、 红曲色素(Monascus pigments,MPs)、γ-氨基丁酸、 麦角甾醇等而被广泛应用于食品着色和防腐、 营养保健、酿造及医药等领域[6]。MK 可作为HMG-CoA 还原酶的竞争性抑制剂,进而抑制胆固醇的合成[7],在调节血压、血脂等方面得到广泛应用[8]。 MPs 是红曲菌产生的一系列色素的混合物, 它不仅可用作天然着色剂,还具有多种生理功能如抗癌、调节血糖、减肥等[6,9]。 目前有关红曲发酵产MK 的研究较多,但普遍存在产量低、周期长、质量不稳定、成本高等问题。
目前, 我国燕麦的加工形式主要包括燕麦片、燕麦粉等,对燕麦的精深加工和综合利用较少。 虽有部分地区如台湾等地销售红曲燕麦片等,但大都以红曲米为原料添加至燕麦片中制成,而完全利用燕麦为基质生产的功能性燕麦红曲产品极少[10]。 卢颖[11]在燕麦培养基中添加酵母粉、甘油等,研究了燕麦红曲固态发酵中MK、蛋白质、多糖、黄酮等物质的生物转化,在优化后的培养基参数下发酵14 d 后MK 产量可达15.00 mg/g。减少发酵基质中非常规食用物质的添加,是开发新型功能红曲的努力方向。
本研究中以裸燕麦 (文中涉及燕麦均指裸燕麦)为原料,以可高产MK 且不产桔霉素的丛毛红曲菌(Monascus pilosus)MS-1 为实验菌株,从裸燕麦的预处理、酸度及微量元素等方面优化燕麦红曲固态培养基。 在此基础上,通过添加营养因子刺激MK 的产生。 该研究拟在获得富含MK 燕麦红曲的基础上,与已有报道相比,缩短发酵周期。 该研究结果可为燕麦精深加工提供新思路,对提高功能性红曲的生产效率也具有借鉴意义。
1 材料与方法
1.1 材料
1.1.1 实验菌株丛毛红曲菌 (Monascus pilosus)MS-1 (中国典型培养物保藏中心, 编号CCTCC M 2013295) 是由红曲产品中分离获得的可高产MK不产桔霉素的红曲菌株。
1.1.2 仪器设备Agilent 1260 高效液相色谱仪:安捷伦科技有限公司产品;UV754N 紫外分光光度计: 上海仪电分析仪器有限公司产品;Anke TJL-18G-C 离心机:上海安亭有限公司产品;HZQ-F160振荡培养箱:哈尔滨市东联电子技术开发有限公司产品;BCM-1300A 生物洁净工作台:苏净集团安泰公司产品;LRH-80 生化培养箱:武汉—恒苏净科学仪器有限公司产品;DHG-9070A 电热恒温鼓风干燥机:武汉—恒苏净科学仪器有限公司产品。
1.1.3 试剂及溶液MK 标准品:购于Sigma 公司;常规试剂乙腈、磷酸、葡萄糖、琼脂、蛋白胨、无水乙醇、七水硫酸镁、氯化钙、七水硫酸锌、硫酸锰、七水硫酸亚铁、氢氧化钠、磷酸二氢铵、冰乙酸和乳酸中除乙腈为色谱纯外均为分析纯:主要购于国药集团化学试剂有限公司。
1.1.4 培养基PDA 培养基:土豆200 g/L(煮制成土豆汁,弃去残渣),葡萄糖20 g/L,琼脂粉20 g/L;pH 自然, 以每瓶约100 mL 的量分装至茄形瓶中。于121 ℃灭菌20 min 后摆斜面备用。此培养基用于红曲菌的传代培养。
种子液培养基[12]:葡萄糖80 g/L,蛋白胨10 g/L,NH4H2PO42 g/L,MgSO4·7H2O 0.5 g/L, 无 水CaCl20.1 g/L, 土豆汁替代水溶解试剂;pH 自然, 以每瓶150 mL 的量分装至500 mL 三角瓶中,121 ℃灭菌20 min 冷却备用。 此培养基用于制备红曲菌种子液。
固态发酵培养基:250 mL 三角瓶的装样量为75 g(不包括酸及无机盐),燕麦干质量50 g,蒸馏水25 g,根据实验需要添加酸、无机盐等,在121 ℃下灭菌20 min,趁热打散后备用。 此培养基用于燕麦红曲固态发酵。
1.2 实验方法
1.2.1 种子液的制备以无菌水将在30 ℃培养10 d的红曲菌孢子洗下,调整孢子悬液浓度为106CFU/mL,以10 mL/hg 的接种量将上述孢子悬液接入1.1.4 的种子液培养基中,在30 ℃、120 r/min 培养48 h。
1.2.2 MK 的检测将发酵后的燕麦红曲于55 ℃烘干12 h,粉碎后充分混匀。 准确称取0.3 g 试样于50 mL 离心管中, 加入10 mL 体积分数75%乙醇。在室温下超声提取1 h,静置10 min,取4 mL 上清液在8000 r/min 离心10 min。 取上清液过0.22 μm滤膜,收集滤液待测。采用HPLC 法检测分析样品中MK 含量, 其色谱条件为:HPLC 系统为安捷伦1260, 色谱柱:Inertsil ODS-3 (5 μm,4.6 mm×250 mm)。 检测波长为238 nm,流动相为乙腈∶水∶体积分数0.5%磷酸=60∶37∶3(体积比),流速为1 mL/min,柱温为25 ℃,进样量为20 μL[13-14]。 红曲样品中MK质量分数的计算公式为:
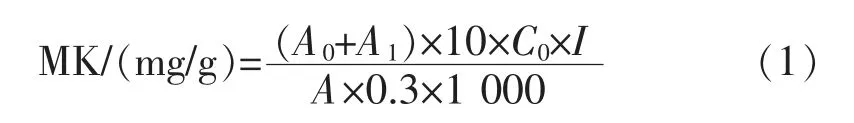
式(1)中,A0为酸式MK 峰面积;A1为内酯式MK 峰面积;C0为标准品质量浓度(μg/mL);I 为稀释倍数;A 为标准品峰面积;10 为提取液总体积(mL);0.3 为称样质量(g)。
1.2.3 MPs 的检测检测样品的预处理同1.2.2。取上清液1 mL 并用75%乙醇稀释至合适的浓度后于505 nm 处测光吸收(OD)值[15],计算色价。 色价计算公式为:
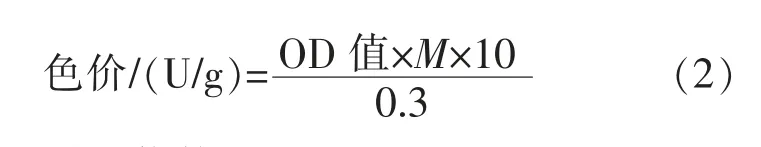
式(2)中,M 为稀释倍数。
1.2.4 燕麦浸泡时间对红曲菌产MK 的影响根据预实验得知,以蒸馏水浸泡燕麦8、10、12 h 后,含水质量分数基本恒定。 每个250 mL 三角瓶中分装50 g 燕麦, 分别用蒸馏水浸泡燕麦8 h 和12 h,沥干后在121 ℃灭菌20 min 并趁热打散。将培养好的种子液按10 mL/hg 的接种量接入固态培养基中,先在30 ℃培养3 d,再调至25 ℃培养至14 d[12],分析发酵产物中MK 的含量,其检测方法同1.2.2。
1.2.5 燕麦粉碎处理对红曲菌产MK 的影响以未处理的燕麦为对照, 将燕麦分别粉碎至20 目和10 目。 燕麦红曲的接种及培养条件同1.2.4,分析发酵产物中MK 的含量,其检测方法同1.2.2。
1.2.6 加水方式对红曲菌产MK 的影响在1.2.5实验结果的基础上,设置固体培养基加水方式分别为灭菌前、后各加质量分数16.67%的水分和灭菌前一次加质量分数33.34%的水分,燕麦红曲的接种及培养条件同1.2.4, 分析发酵产物中MK 的含量,其检测方法同1.2.2。
1.2.7 灭菌前加水质量分数对红曲菌产MK 的影响在1.2.6 的基础上, 将固体培养基灭菌前加水质量分数分别调整为16.67%、20.00%、23.33%、26.67%、30.00%, 经灭菌后将各培养基的加水质量分数补足至33.34%。燕麦红曲的接种及培养条件同1.2.4,分析发酵产物中MK 的含量,其检测方法同1.2.2。
1.2.8 乳酸、 冰乙酸添加量对红曲菌MK 的影响在1.2.7 的基础上, 在固态培养基中分别加入0、0.2、0.4、0.6、0.8、1.0 mL/hg 的乳酸、冰乙酸,灭菌和发酵培养方法同1.2.4。检测红曲发酵产物中MK 的含量,具体检测方法1.2.2。 为比较冰乙酸和乳酸的稳定性,用pH 计测定培养基提取液的pH,并采用酸碱滴定的方法测定培养基中乳酸、 冰乙酸含量。以0.1 g/dL 酚酞溶液为指示剂, 用0.1 mol/L 的NaOH 溶液滴定灭菌前后样品提取液。
乳酸、冰乙酸酸质量分数的计算公式:
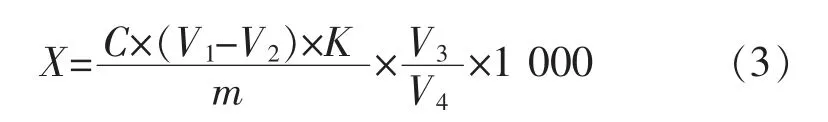
式中:X 为每千克样品中总酸的克数,g/kg;C 为氢氧化钠标准滴定溶液的浓度,mol/L;V1为滴定试液时消耗氢氧化钠标准滴定溶液的体积,mL;V2为空白试验消耗氢氧化钠标准滴定溶液的体积,mL;V3为样品稀释液总体积,mL;V4为滴定时吸取的样液体积,mL;m 为样品质量,g;K 为酸的换算系数 (乳酸:0.090;冰乙酸:0.060)
1.2.9 金属离子对红曲菌产MK 的影响在1.2.8的基础上, 在固态培养基中分别添加0.007 mol/kg的ZnSO4·7H2O、MgSO4·7H2O、MnSO4、FeSO4·7H2O和CaCl2,燕麦红曲的接种及培养条件同1.2.4,分析发酵产物中MK 的含量,其检测方法同1.2.2。
1.2.10 镁离子添加量对红曲菌产MK 的影响在1.2.9 的基础上,将固体培养基中MgSO4·7H2O 的添加量分别调整为0、0.002、0.007、0.012、0.017、0.022 mol/kg,燕麦红曲的接种及培养条件同1.2.4,分析发酵产物中MK 的含量,其检测方法同1.2.2。
1.2.11 大豆分离蛋白添加量对红曲菌产MK 的影响在1.2.10 的基础上,将固体培养基中的大豆分离蛋白分别调整为0%、1%、2%、3%、4%、5%(质量分数),燕麦红曲的接种及培养条件同1.2.4,分析发酵产物中MK 的含量,其检测方法同1.2.2。
1.2.12 发酵时间对红曲菌产MK 和MPs 的影响在1.2.11 优化得到的固体培养基基础上,监测发酵32 d 内红曲菌产MK 和MPs 的变化趋势,以发酵5 d 为取样起始天数,间隔3 d 取样。 燕麦红曲的接种及培养条件同1.2.4,发酵产物中MK 和MPs 的检测方法同1.2.2 和1.2.3。
2 结果与分析
2.1 燕麦浸泡时间对红曲菌产MK 的影响
预实验结果表明,燕麦浸泡8、10 h 及12 h 时,其含水质量分数为(32.85±0.07)%,说明浸泡8 h 时燕麦的吸水量已达到饱和。 因水分在燕麦组织中的分布及存在状态可随浸泡时间的长短而改变,探究燕麦含水量达到饱和后, 浸泡时间对燕麦红曲MK产量的影响,结果如图1 所示。
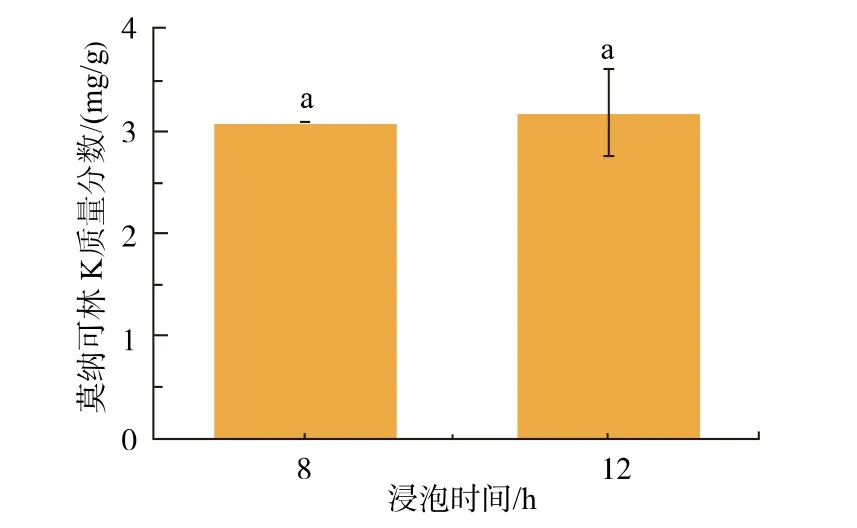
图1 浸泡时间对红曲菌产MK 的影响Fig. 1 Effects of soaking time on MK production by Monascus spp.
由图1 可知,浸泡8 h 与12 h 的燕麦,经发酵14 d 后MK 产量无显著差异(p>0.05),表明燕麦吸水量达到饱和后,浸泡时间对红曲菌产MK 没有影响。 此外,尝试在浸泡液中添加冰乙酸、金属离子等,发现MK 产量偏低,即MK 的最高产量不超过5 mg/g(数据未列出),且发酵所得的燕麦红曲米心呈乳白色。 表明红曲菌只沿物料表面生长,不能充分利用粒状燕麦。 故在后续实验中,将对燕麦基质进行适当的粉碎处理。
2.2 燕麦粉碎处理对红曲菌产MK 的影响
为探究粉碎度对燕麦红曲固态发酵产MK 的影响,对燕麦进行不同细度的粉碎处理后进行固态发酵,结果如图2 所示。 对燕麦进行粉碎处理可显著促进红曲菌发酵产MK(p<0.05),其中粉碎度为20 目时效果最好,MK 产量最高可达7.95 mg/g,比对照提升了1.59 倍。这是由于粉碎处理增大了红曲菌与物料的接触面积, 同时有利于燕麦淀粉的糊化,但粉碎细度过小会使基质不易被打散(预实验中粉碎粒度小于20 目时灭菌后培养基质难以打散,数据未列出)。 故选择粉碎度为20 目的燕麦进行后续实验。
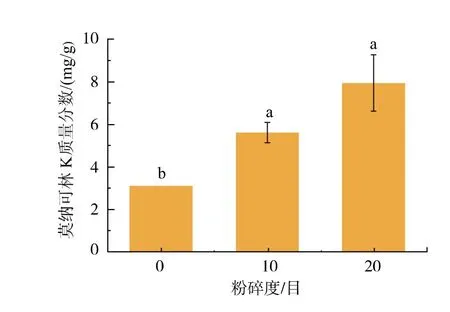
图2 粉碎度对红曲菌产MK 的影响Fig. 2 Effects of crushing degree on MK production by Monascus spp.
2.3 加水方式对红曲菌产MK 的影响
在2.2 实验结果的基础上, 考察固体培养基的加水方式即分2次加水或1次加水对红曲菌产MK的影响,结果如图3 所示。
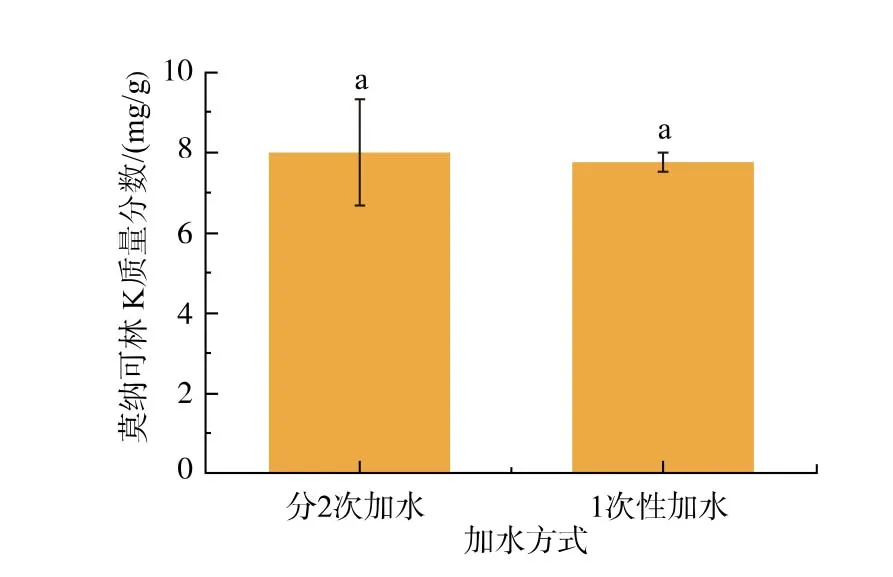
图3 加水方式对红曲菌产MK 的影响Fig. 3 Effects of water adding mode on MK production by Monascus spp.
由图3 可知,加水方式对MK 产量无显著影响(p>0.05),其平均产量均为8 mg/g 左右。 但在固态发酵培养过程中发现,1次加水的燕麦固体培养基因结块而不能被充分打散,这在一定程度上减少了基质内气体交换并导致热量积累,菌体仅在物料表面生长,原料利用率低[16]。 2 种加水方式所得MK 产量相当,主要与燕麦的糊化程度有关,即1次加水的培养基因含水质量分数较高使其糊化程度较好。故继续考察灭菌前加水质量分数对红曲菌产MK的影响。
2.4 灭菌前加水质量分数对红曲菌产MK 的影响
根据灭菌后物料疏松或结块对红曲发酵的影响,在保证燕麦基质不结块的前提下,探究灭菌前加水质量分数对红曲菌产MK 的影响, 结果如图4所示。
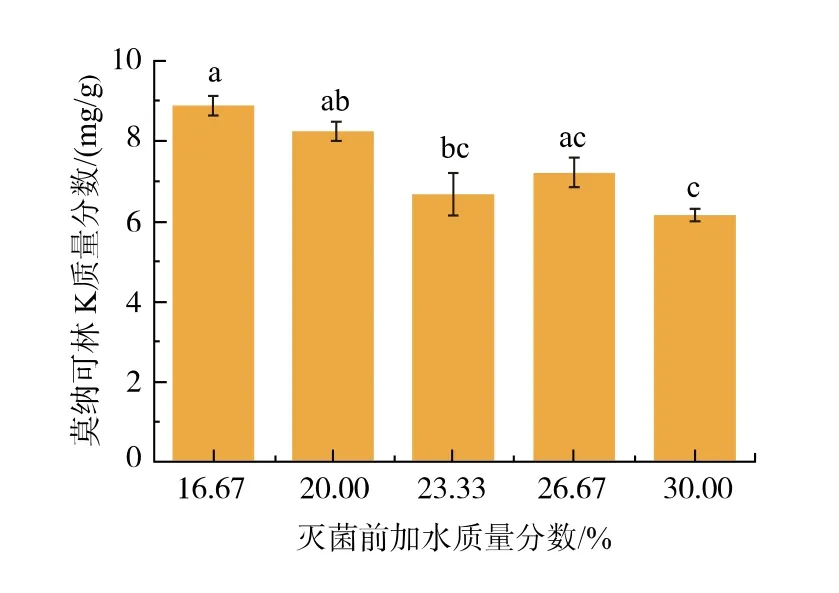
图4 灭菌前加水质量分数对红曲菌产MK 的影响Fig. 4 Effects of water addition on MK production by Monascus spp. before sterilization
由图4 可知,在保证培养基均能被打散的前提下, 当灭菌前加水质量分数从16.67%增加至30%时, 燕麦红曲中MK 质量分数呈现下降的趋势,加水质量分数分别为23.33%、26.67%和30%时MK产量下降最显著(p<0.05)。 灭菌前燕麦固体培养基加水量过高,易造成培养基质结块,进而影响通氧量,不利于红曲菌的生长及MK 的产生。结合2.3 和2.4 实验结果,分别在固体培养基灭菌前、后各加质量分数16.67%的水分进行后续实验。
2.5 乳酸、冰乙酸添加量对红曲菌产MK 的影响
培养基的初始pH 可影响红曲菌生长及代谢[12]。 在2.4 实验结果的基础上,探究乳酸及冰乙酸的添加量对燕麦红曲固态发酵产MK 的影响,结果如图5 所示。
由图5 可知,不同添加量的冰乙酸及乳酸对红曲菌产MK 无显著影响(p>0.05)。 当乳酸添加量为0.6 mL/hg 时MK 的产量最高, 可达10.27 mg/g,比对照提高25.31%。 与对照相比无显著差异,主要与实验的平行性相对较差有关。
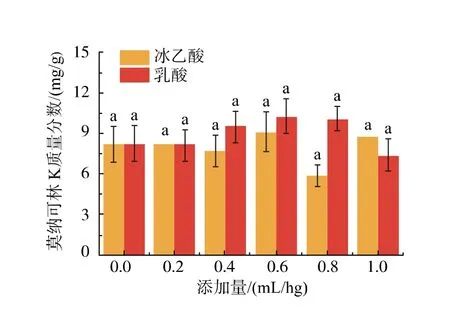
图5 冰乙酸和乳酸质量浓度对红曲菌产MK 的影响Fig. 5 Effects of acetic acid and lactic acid concentrations on MK production by Monascus spp.
此外, 分析灭菌前后固体培养基的pH 值及冰乙酸和乳酸含量的结果表明,添加冰乙酸的培养基灭菌后pH 值及冰乙酸含量均降低, 而灭菌对培养基中乳酸影响不大, 表明乳酸稳定性比冰乙酸好。大量研究表明,红曲菌偏爱乳酸[17],且红曲菌生长速度相对较慢,发酵初期添加酸,利于抑制杂菌生长。故选择添加0.6 mL/hg 乳酸进行后续实验。
2.6 金属离子对红曲菌产MK 的影响
金属离子是微生物细胞中各种酶的活性成分,在微生物生长代谢过程中具有调节并维持细胞的渗透压、保持氧化还原电位等作用。 考察了金属离子对燕麦红曲固态发酵产MK 的影响, 结果如图6所示。
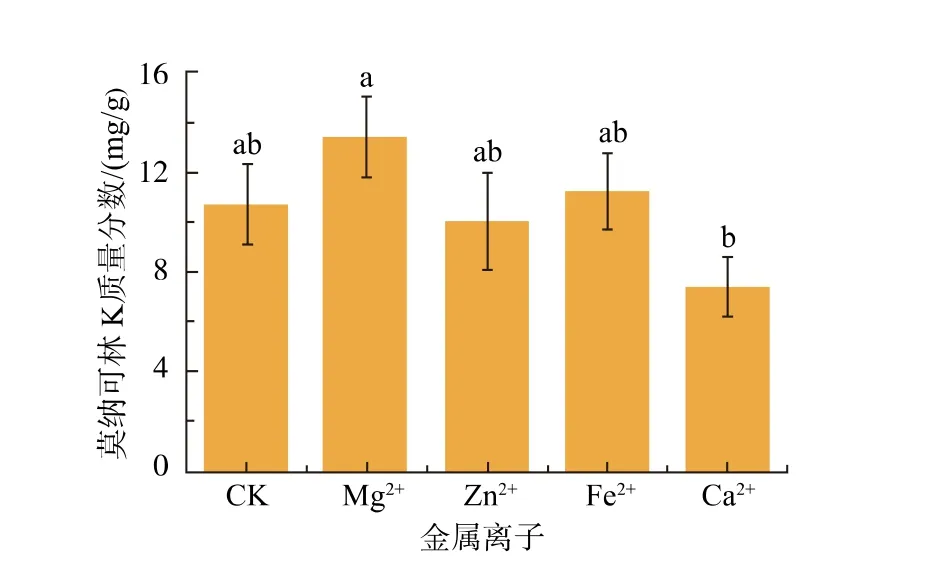
图6 金属离子对红曲菌产MK 的影响Fig. 6 Effects of metal ions on MK production by Monascus spp.
由图6 可知,添加Mg2+的燕麦红曲MK 产量最高,可达13.53 mg/g,比对照提高了26.06%。 Mg2+作为微生物生长所需的微量元素,不仅是微生物细胞的成分,也是细胞内多种酶的活性激活剂[10]。故继续探究Mg2+的添加量对红曲菌发酵燕麦产MK 的影响。
2.7 镁离子添加量对红曲菌产MK 的影响
在2.6 实验结果基础上, 探究Mg2+添加量对燕麦红曲固态发酵产MK 的影响, 结果如图7 所示。当Mg2+添加量为0.007 mol/kg 和0.017 mol/kg 时均可显著促进红曲菌产MK(p<0.05),而Mg2+添加量为0.007 mol/kg 时MK 产量最大。 故选择0.007 mol/kg为Mg2+的最适添加量。
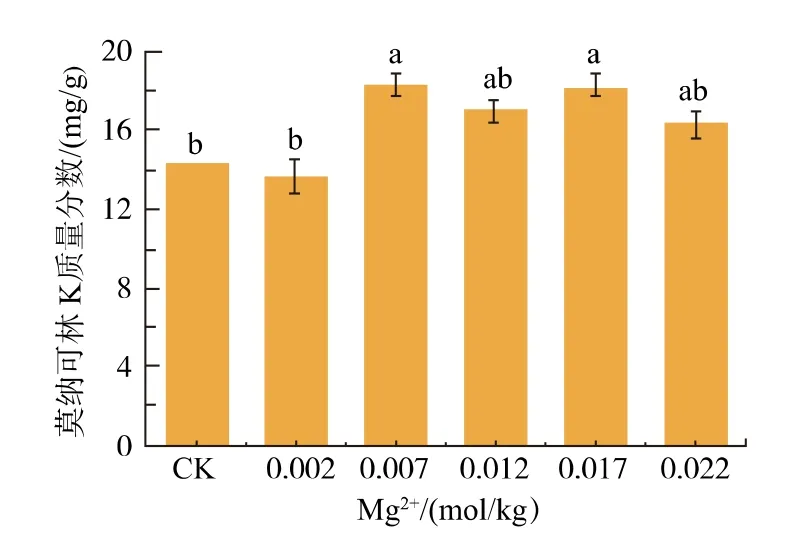
图7 镁离子添加量对红曲菌产MK 的影响Fig. 7 Effects of Mg2 + addition on MK production by Monascus spp.
2.8 大豆分离蛋白对红曲菌产MK 的影响
本课题组前期研究结果表明,在以大米为基质的固体培养基中添加大豆分离蛋白可显著促进红曲菌产MK(数据未列出)。 为在相同发酵周期内获取更高的MK 产量,在优化后的裸燕麦培养基中添加大豆分离蛋白,考察大豆分离蛋白添加量(质量分数)对红曲菌产MK 的影响,结果如8 所示。
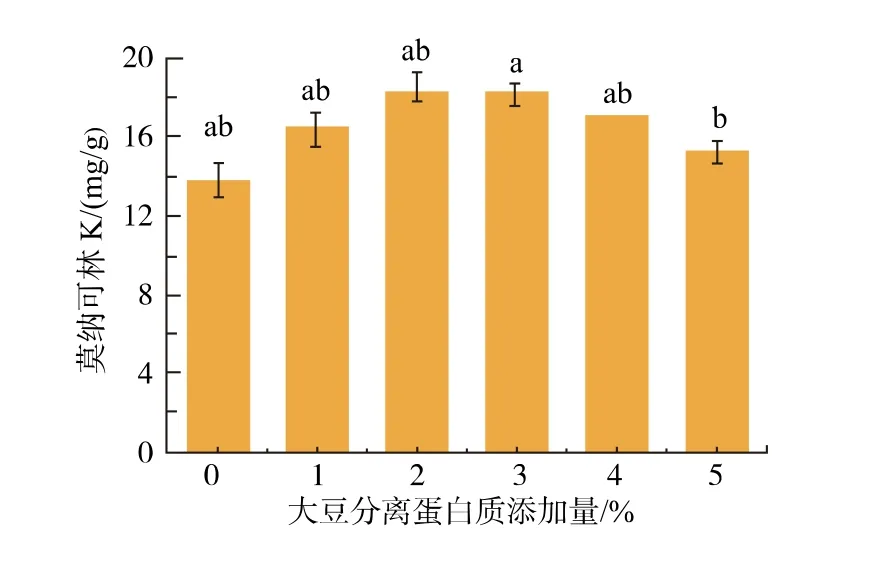
图8 大豆分离蛋白添加量对红曲菌产MK 的影响Fig. 8 Effects of soybean protein isolate on MK production by Monascus spp.
由图8 可知, 随着大豆分离蛋白添加量的增加,MK 的产量呈现先上升后下降的趋势。 其中,当大豆分离蛋白添加量为2%时MK 产量比对照提高32.63%。结果表明,添加质量分数2%大豆分离蛋白可促进红曲菌产MK, 即有望通过添加大豆分离蛋白,在较短的发酵周期获取较高的MK 产量。
2.9 发酵时间对红曲菌产MK 和MPs 的影响
在优化后的燕麦固体培养基基础上,考察发酵32 d 内燕麦红曲中MPs 及MK 含量的变化趋势,结果如图9 所示。
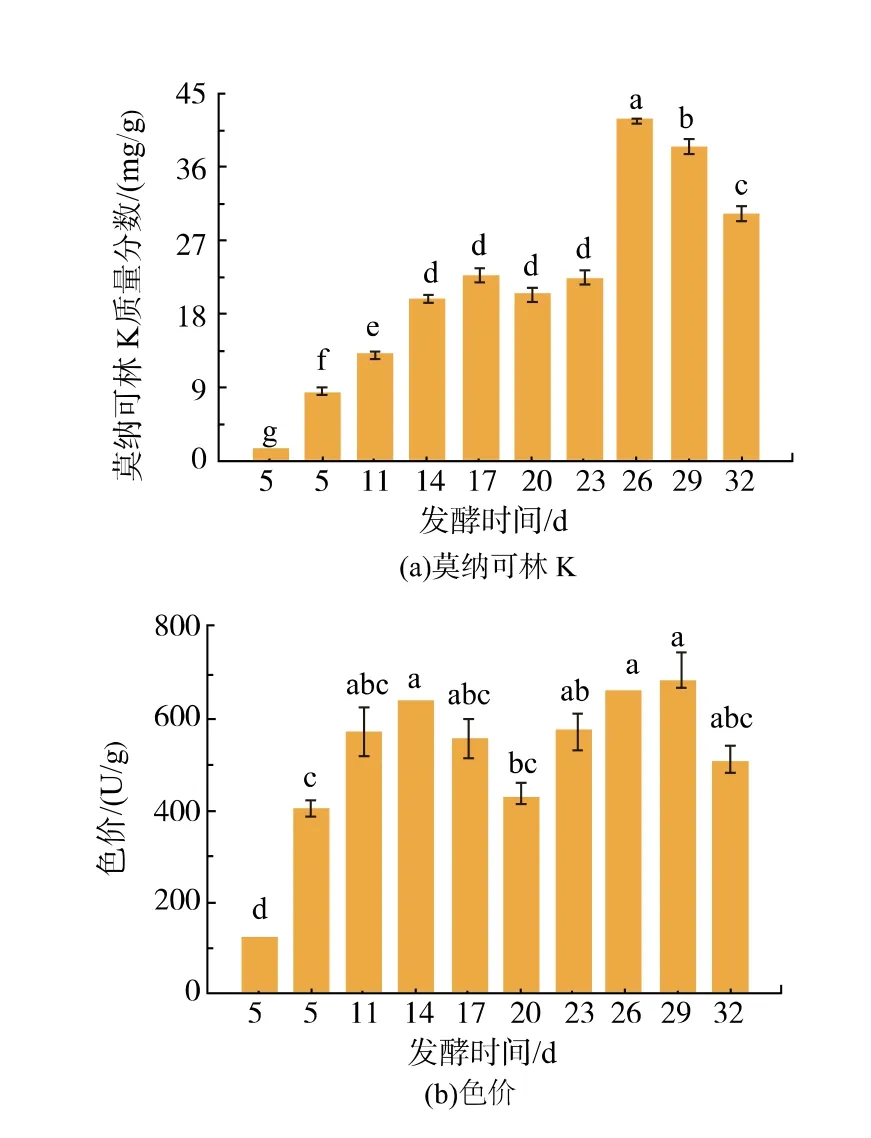
图9 发酵时间对红曲菌产MPs 和MK 的影响Fig. 9 Effects of fermentation time on MK and MP production by Monascus spp.
由图9(a)可知,在发酵前17 d,MK 的产量逐渐上升,其中发酵至11 d 与2.8 中未添加大豆分离蛋白 (对照) 发酵14 d 时MK 的产量相同, 均为13.45 mg/g, 而添加大豆分离蛋白后发酵14 d 可达19.77 mg/g。 由此可知,添加大豆分离蛋白,燕麦红曲中MK 产量达13.45 mg/g 可比未添加时的样品缩短3 d 发酵周期。 发酵至17~23 d,MK 产量先下降后上升,但变化不显著(p>0.05)。发酵至26 d 时MK的产量最高,达41.85 mg/g,而后呈下降趋势,发酵至32 d 时MK 产量为30.53 mg/g。 由图9(b)可知,与MK 的变化趋势类似,在发酵过程中MPs 产量呈现2次先升后降趋势,推测红曲菌在发酵32 d 过程中进行了二次发酵,当发酵至26 d 即MK 产量最高时,色价达到664.53 U/g。
3 结 语
作者以燕麦为固体培养基,主要探究了燕麦的预处理和含水质量分数、营养因子、微量元素对燕麦红曲固态发酵产MK 的影响。 在优化后燕麦红曲固体培养基中加入质量分数2%大豆分离蛋白,发酵14 d 后MK 产量可达19.77 mg/g, 发酵26 d 后MK 产量高达41.85 mg/g。该研究通过向优化后燕麦培养基中添加大豆分离蛋白,在同等发酵时间内获得更高的MK 产量, 即达到某MK 产量所需发酵时间缩短。 结合已有文献,Zhang 等人[18]以小米为发酵基质,以红色红曲菌(Monascus ruber)为实验菌株,在优化后的发酵条件下发酵20 d,MK 的产量可达19.81 mg/g。 该产量与本研究中发酵红曲燕麦14 d后MK 产量基本一致。卢颖[11]以燕麦为发酵基质,在优化后的工艺条件下, 发酵14 d 后MK 产量为15.00 mg/g, 该产量低于本研究中发酵14 d 后燕麦红曲中MK 的产量。 综上,通过优化燕麦红曲培养基组分并添加食品级营养因子,达到在较短的发酵周期获取MK 含量较高的燕麦红曲。 该研究结果可为提高功能性红曲的生产效率及燕麦精深加工提供思路和参考。
