两种海藻内生菌的分离及其抗氧化活性研究
2020-09-10冯书珍谢广燕刘南英卢宇凤冯学珍
冯书珍, 谢广燕, 刘南英, 徐 畅, 卢宇凤, 冯学珍
(广西科技大学 医学部,广西 柳州545006)
香山科学会议第396次学术讨论会与《全国海洋经济发展“十三五”规划》中明确指出,海洋微生物将是今后获得创新药物的重要资源[1-2]。 海藻作为海洋中最大的植物类群,其内生细菌与真菌是海洋微生物的重要组成部分[3]。 近年研究表明,内生菌的生理活性物质因具有抗氧化[4-6]、抗菌[7]、抗凝血[8]、抗炎[9]、抑制癌细胞[10]等作用,渐成为筛选与研究的热点;其中,抗氧化对于预防许多由自由基引起的生物衰老及相关疾病如心血管疾病及癌症等非常重要[11]。董玉洁等[4]从黄渤海衔接处的长岛海洋生物中分离内生真菌,通过清除二苯代苦味酰基自由基(DPPH:2,2-二苯基-1-苦 肼基自由基,2,2-diphenyl-1-picrylhydrazyl) 能力的抗氧化活性进而筛选获得阿尔茨海默病(Alzhei-mer’s disease,AD)活性菌株;Zheng 等[5]从Artemisia annua L.中分离筛选内生细菌(Bacillus cereus SZ-1), 其清除DPPH自由基的能力超过50%;Huang 等[6]在29 种植物如夹竹桃等中分离内生菌大多内生菌都能产生抗氧化物质, 但不同种植物内生菌具有种群多样性,且同一种植物不同微生物种群间亦呈现多样性。 目前,关于海藻内生菌的研究大多集中于单一物种类型,不同海藻内生菌间及内生细菌与内生真菌间抗氧化活性的差异研究还较少;这对于在海洋中正确遴选高生物活性的海藻内生菌具有重要意义。
作者以广西北部湾绿藻门石莼(Ulva lactuca L.)与褐藻门裙带菜(Undaria pinnatifida Suringar)为研究对象,分离其内生细菌与内生真菌,并通过清除DPPH、羟基自由基、超氧阴离子的能力指征其体外抗氧化活性,探讨不同海藻内生菌间及内生细菌与内生真菌间抗氧化活性的差异,最终筛选抗氧化活性较高的菌株并加以鉴定,以期为海藻内生菌的筛选及其抗氧化的天然生物活性成分研究提供指导。
1 材料与方法
1.1 材料
1.1.1 海藻样品的采集与鉴定于2018年1月采自广西北部湾海域 (20°54′10″ -21°40′30″ N,109°05′20″-109°11′35″ E),经大连海洋大学邢坤副教授依次鉴定为绿藻门石莼属黑石礁石莼(Ulva lactuca L.)、 褐藻门裙带菜属裙带菜 (Undaria pinnatifida Suringar)。
1.1.2 培养基马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基,LB(Luria-Bertani)琼脂培养基分别用于海藻内生真菌及细菌的分离;同时,选取去琼脂的液体培养基用于发酵与培养。
1.2 方法
1.2.1 海藻内生菌的分离将采集的海藻样品用蒸馏水冲洗去掉表面的泥沙,用无菌滤纸吸干样品表面的水分。 海藻样品用质量分数为0.1%的Tween-20 浸泡5 min, 无菌水冲洗干净。 体积分数75%的酒精浸泡5 min,无菌水冲洗3次将表面的酒精冲洗干净。 用体积分数2%的次氯酸钠消毒5 min,无菌水冲洗3次(保留最后1次冲洗海藻样品的无菌水,作为对照)。 将海藻样品进行研磨,在研钵中加入一定量的无菌蒸馏水,静置后吸取200 μL涂布于PDA 与LB 平板上, 倒置恒温培养箱中培养[11-12]。
1.2.2 海藻内生菌的保存与发酵从平板培养基中挑取单菌落置1.5 mL 装有液体培养基的离心管,摇床培养8~10 h,将菌液与体积分数50%已灭菌的甘油1∶1 等体积混合,于-20 ℃冰箱内保存(有效期1年,如需长期保藏进而划线培养)。为获得发酵液,可将保藏液再次转接入新的液体培养基中,200 r/min摇床振荡培养7~14 d。
1.2.3 海藻内生菌样品溶液的制备获得的发酵液,双层滤纸过滤后得到上清液,用等体积的乙酸乙酯萃取3次,浓缩置于真空干燥箱中干燥,4 ℃保存。 分别精密称取干燥恒重的乙酸乙酯提取物5 mg,甲醇溶解并定容100 mL,即5.0 mg/mL 的母液,备用。
1.2.4 海藻内生菌抗氧化活性的研究
1) 对DPPH 自由基清除能力的测定 参照冯学珍等[13]方法,略做修改。 精确称取DPPH·粉末用体积分数80%乙醇配制成8 mg/mL 的溶液,避光保存。 取海藻内生菌样品溶液125 μL 加入125 μL DPPH·溶液,涡旋混合均匀,反应一定时间后在517 nm处的吸光度,作为样品组 (A517nm);125 μL DPPH·溶液加上125 μL 体积分数80%乙醇作为对照组(A01);以125 μL相同质量浓度的样品和125 μL 体积分数80%乙醇混合作为空白组(Amax1);维生素C 作为阳性对照。 计算如下式(1):
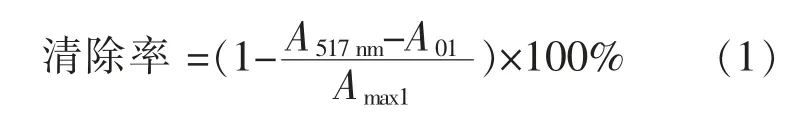
2)对羟基自由基(·OH-)清除能力的测定 参照张婧涵等[14]方法,稍做修改。 在1.5 mL 离心管中依次加入6 mmol/L 硫酸亚铁溶液300 μL,6 mmol/L水杨酸—乙醇溶液300 μL 后, 把海藻内生菌样品溶液300 μL 分别加入试管中, 然后加入体积分数0.1%的过氧化氢溶液300 μL,摇匀后37 ℃水浴30 min,7000 r/min 离心3 min,在510 nm 处测定吸光度值A510nm;以相应溶剂代替样本作为空白对照,吸光度为Amax2;相应样品溶液的吸光度A02;维生素C作为阳性对照。 计算如下式(2):

3)对超氧阴离子自由基(·O2-)清除能力的测定参照陈玫等[15]及韩少华等[16]方法,稍做修改。 1.5 mL离心管中依次加入,900 μL pH = 8 的0.05 mol/L 磷酸盐缓冲液放入25 ℃水浴中加热20 min, 分别加入200 μL 海藻内生菌样品溶液和80 μL 25 mmol/L邻苯三酚溶液, 混匀后于25 ℃水浴中反应5 min,加入80 mmol/L HCl 200 μL 终止反应, 并摇匀,反应3 min,7000 r/min 离心3 min,在波长420 nm 处测吸光度A420nm; 以相应溶剂代替样品作为空白对照,测吸光度为Amax3;相应样品溶液的吸光度A03;维生素C 作为阳性对照。 计算如下式(3):

1.2.5 分子生物学鉴定由于获得的菌株较多,在经抗氧化活性差异分析后,对清除DPPH、羟基自由基与超氧阴离子的综合能力相对最强的菌株进行分子生物学鉴定(最终筛选为石莼内生真菌)。 提取内生菌DNA 后进行18S rDNA PCR 扩增, 引物为Fung(5′-GTAGTCAT ATGCTTGTCTC-3′)和NSI(5′-ATTCCCCGTTACC CGTTG-3′)。 PCR 反应体系均为25 μL, 其组成为: 引物各1 μL、2×Taq PCR MasterMix(TIANGEN,China)10 μL、内生菌DNA 模板1 μL、加ddH2O 至总体积25 μL。 PCR 循环参数如下:95 ℃15 min、95 ℃1 min、57 ℃1 min、72 ℃2 min、35个循环;68 ℃延伸保育10 min 后冷却至4 ℃。 PCR 产物于1.0 g/dL 的琼脂糖电泳检测后用于测序(诺禾致源),将测序结果基于NCBI 数据库(NCBI:https://www. ncbi.nlm.nih.gov/) 与已知序列进行Blast 比对分析并绘制进化树。
1.3 数据分析
采 用Excel 2010、Origin 8.0、SPSS (SPSS 20.0 Windows,SPSS Inc,Chicago,USA)、R 语 言 (The R Project for Statistical Computing)对数据进行统计分析与作图,根据统计结果计算海藻多糖体外抗氧化活性的半数清除或抑制浓度(IC50),并计算标准误差,结果以“平均值±标准差(X±SD )”表示;分别对海藻内生细菌与真菌的体外抗氧化活性进行单因素方差分析 (One-way ANOVA, 置信水平95%、99%),处理间的多重比较用S-N-K 法;基于内生菌的抗氧化活性进行非度量多维尺度分析 (Nonmetric Multidimensional scaling,NMDS), 并 利 用ANOSIM 统计组间差异显著性。
2 结果与分析
2.1 海藻内生菌的初步分离
经海藻内生菌的平板培养,共筛选获得石莼内生细菌单菌落153个,内生真菌单菌落75个;裙带菜内生细菌单菌落219个,内生真菌单菌落15个。
2.2 海藻内生菌抗氧化活性的初步测定
将获得的内生菌进行抗氧化活性的测定,综合DPPH、羟基自由基、超氧阴离子的清除能力都较强的前12 株菌株进行下一步筛选。 由图1 可知,石莼及裙带菜内生细菌与真菌均有一定的抗氧化活性,但不同藻类的细菌与真菌间存在一定差异。 其中,对3 种自由基的清除作用均表现较好的菌株,分别为石莼的内生细菌SX-2、SX-5、SX-12, 内生真菌SZ-5、SZ-7、SZ-8;裙带菜的内生细菌QX-1、QX-6、QX-8,内生真菌QZ-4、QZ-6、QZ-9。
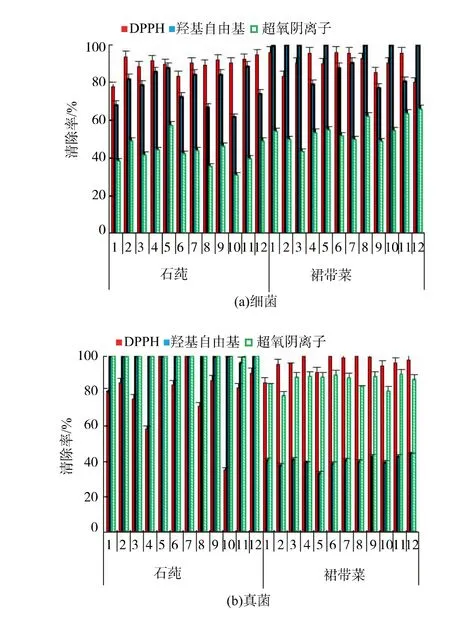
图1 海藻内生细菌与真菌抗氧化活性的初步测定Fig. 1 Preliminary determination of antioxidant activities of endophytic bacteria and fungi
2.3 已筛选的海藻内生菌抗氧化活性测定
2.3.1 对DPPH 自由基的清除作用不同藻类不同内生菌的不同质量浓度对清除DPPH 自由基的活性分析,结果见图2,可知:石莼与裙带菜的内生细菌、真菌对DPPH 的清除活性均随质量浓度增加而升高;除裙带菜内生细菌QX-8 外,当质量浓度为5.0 mg/mL 时,其清除率均可达到80%以上。 其中,石莼与裙带菜的内生细菌对DPPH 的清除IC50均显著高于内生真菌(P<0.05),说明内生细菌的抗氧化活性显著低于内生真菌;且裙带菜内生真菌QZ-4、QZ-6 的IC50分 别 为 (0.37±0.03) mg/mL、(0.39±0.07) mg/mL,显著高于其他10 株菌株(P<0.05)(表1)。 除裙带菜内生细菌QX-8 外, 当质量浓度为5.0 mg/mL 时,其清除率均可达到80%以上。

图2 海藻内生菌对DPPH 的清除能力Fig. 2 Scavenging capacity of algal endophytes on DPPH
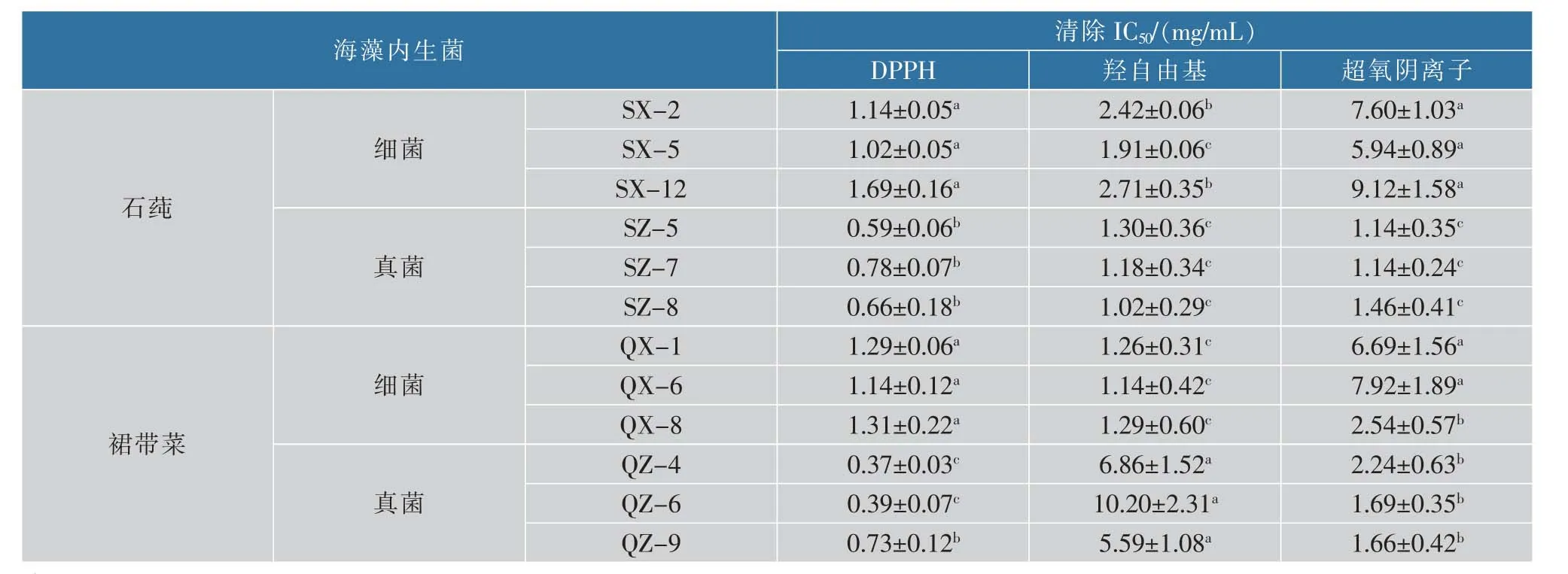
表1 海藻内生菌对自由基清除的半抑制浓度(IC50)Table 1 IC50 for free radical-scavenging capacity
2.3.2 对羟基自由基的清除作用由图3 可知,12株内生菌对·OH-自由基的清除作用均随质量浓度的升高而增强。 石莼内生真菌与裙带菜内生细菌在5.0 mg/mL 时对·OH-自由基的清除作用可达到92%以上,经计算IC50为((1.02±0.29)~(1.30±0.36))mg/mL(表1); 其次是石莼内生细菌SX-2、SX-5、SX-12,5.0 mg/mL 时对·OH-自由基的清除率分别可达82%、88%、75%; 裙带菜的内生真菌QZ-4、QZ-6、QZ-9 对·OH-自由基的清除能力相对较弱, 在最大质量浓度5.0 mg/mL 时清除率仅为38%~45%,经计算IC50分别为 (6.86±1.52)、(0.20±2.31)、(5.59±1.08) mg/mL。

图3 海藻内生菌对羟基自由基的清除能力Fig. 3 Scavenging capacity of algal endophytes on hydroxyl radical
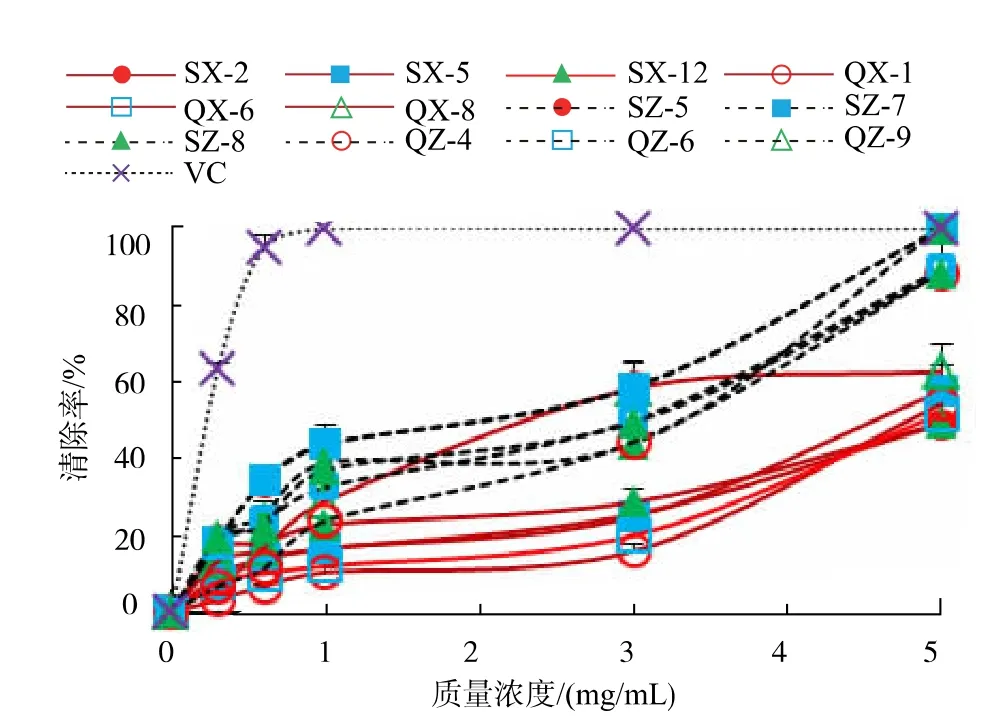
图4 海藻内生菌对超氧阴离子的清除能力Fig. 4 Scavenging capacity of algal endophytes on superoxide anion
2.4 海藻内生菌间抗氧化活性的差异分析
以表1 计算所得的IC50值进行下一步的组间分析,非度量多维尺度分析NMDS 与ANOSIM 统计结果可知(图5):不同藻类,石莼与裙带菜内生菌的抗氧化活性之间能较好地分开, 且差异显著(globe test:P<0.05); 同种藻类不同内生菌之间可表现为:石莼内生真菌与内生细菌的抗氧化活性之间差异显著(globe test:P<0.05);裙带菜内生真菌与内生细菌间亦能较好地分开,差异显著(globe test:P<0.01)。
2.3.3 对超氧阴离子的清除作用石莼与裙带菜内生细菌与真菌对自由基的清除作用表现为质量浓度越高,作用越强(图4)。 其中,石莼真菌SZ-5、SZ-7、SZ-8 在最高质量浓度5.0 mg/mL 时对自由基的清除率都几近100%,IC50分别为(1.14±0.35)、(1.14±0.24)、(1.46±0.41) mg/mL,其清除率显著其他菌株(表1;P<0.05);其次,裙带菜真菌QZ-4、QZ-6、QZ-9 在质量浓度为5.0 mg/mL 时清除率可分别达88%、89%、88%,IC50分别为 (2.24±0.63)、(1.69±0.35)、(1.66±0.42) mg/mL;在质量浓度为5.0 mg/mL 时, 石莼与裙带菜内生细菌的清除率均低于60%。 整体来说,石莼与裙带菜的内生细菌其IC50值均显著高于内生真菌(P<0.05),说明石莼与裙带菜内生细菌对超氧阴离子的清除作用显著低于内生真菌。
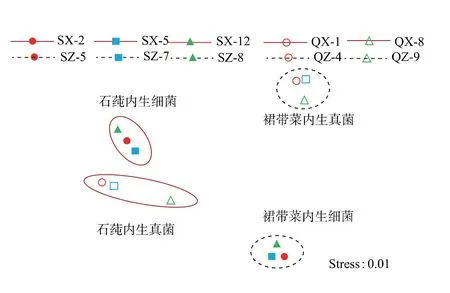
图5 海藻内生菌间抗氧化活性的NMDS 分析Fig. 5 Non-metric multidimensional scaling of the algal entophytes
2.5 抗氧化活性菌株的分子鉴定
石莼内生真菌SZ-5 菌株在最高质量浓度时的清除DPPH、 羟基自由基与超氧阴离子的综合能力相对最强,因此对其进行下一步的分子鉴定。以SZ-5 菌株DNA 为模板进行PCR 扩增, 其产物纯化后进行Sanger 测序, 并基于NCBI 数据库与已知序列进行Blast 比对分析。结果显示(图6),菌株SZ-5 的18S rDNA 序 列 与 NCBI 中 出 芽 短 梗 霉(Aureobasidium pullulans )JX303663.1 的18S 序列,相似度较高;初步确定该分离的菌株为短梗霉菌属真菌。
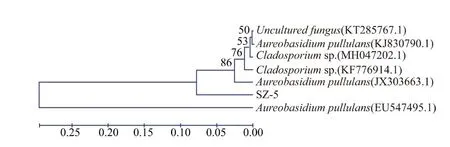
图6 SZ-5 菌株同源性比较的进化树Fig. 6 Homology comparison of 18S rDNA gene from SZ-5 strains
3 结语
抗氧化活性主要是对生物在外界条件胁迫下产生的活性氧的消除作用[17]。 现有关海藻内生菌的研究多集中在其抗菌方面:孙好芬等[18]对青岛海域松节藻、多管藻、裙带菜中分离纯化出18 株内生真菌,均具有较好的抑菌活性;孙杰等[19]对烟台浅海处鼠尾藻、裙带菜、海带中分离内生真菌并检测其抑菌活性,结果表明均有>50%的抑菌活性;但是相对于抗氧化活性的研究还较少。 广西北部湾海域绿藻门石莼、 褐藻门裙带菜的内生细菌与真菌, 均对DPPH 自由基、羟基自由基、超氧阴离子具有一定的清除能力,大部分具有良好的抗氧化活性,清除活性均随浓度增加而升高,说明海藻内生菌是抗氧化活性产物寻找的良好资源。
石莼与裙带菜的内生菌抗氧化活性之间存在显著差异,说明不同藻类内生菌存在抗氧化活性的种群多样性。 孙剑秋等[20]对北京植物园4 科6 种药用植物的研究结果,也同样发现不同植物中内生真菌种类存在显著差异。 这可能是由于,植物内生菌具有丰富的生物多样性,宿主植物不同,则分离得到的内生菌种类、数目均有差异[18];其抗氧化活性也可能存在差异。 目前,宿主与内生菌的选择性和多样性机制尚未阐明,但已有研究表明,内生菌大多能产生与宿主相似或相同的生物活性[21-22]。 课题组前期研究表明[13],广西北部湾石莼等多糖均具有较好的抗氧化活性(DPPH),作者试图将内生菌与宿主间建立耦合关系,结果并不理想,仍需深入研究。
同种藻类内生菌间, 除裙带菜内生真菌外,整体表现为,石莼与裙带菜的内生细菌对DPPH、羟基自由基与超氧阴离子的半抑制浓度IC50值均显著高于内生真菌,说明石莼与裙带菜内生细菌对超氧阴离子的清除作用显著低于内生真菌。 石莼与裙带菜的内生真菌整体来说其抗氧化活性显著高于内生细菌,指示在海藻内生菌的抗氧化活性物质筛选中可以将内生真菌作为优先研究的对象。 其中,石莼内生真菌SZ-5 菌株在最高质量浓度时的清除DPPH、 羟基自由基与超氧阴离子的综合能力相对最强,按真菌形态分类鉴定方法进行鉴定为短梗霉菌属真菌Aureobasidium spp.,可以作为进一步实验研究的对象,从而为抗氧化药物的研究与开发奠定基础。
