野生蒙古口蘑多糖通过STAT3 和HIF-1α 通路对LPS 诱导的巨噬细胞发挥抗炎调节作用
2020-09-10于传宗张凤兰慕宗杰李子钦孙峰成郝丽珍
于传宗, 张凤兰, 慕宗杰, 李子钦, 孙峰成, 郝丽珍*
(1 内蒙古农业大学 园艺与植物保护学院,内蒙古 呼和浩特010018;2. 内蒙古自治区农牧业科学院,内蒙古 呼和浩特010031)
炎症是人体为保护自身免受外来环境侵害的防御系统[1]。 在炎症过程中,巨噬细胞通过释放前列腺素和促炎性细胞因子 (TNF-α、IL-6、IL-1α 和IL-1β)等,对有害物刺激物(如食物、病原体、药物)的侵扰做出反应,这一过程称为吞噬作用[2]。 在这个过程中,吞噬细胞会产生具有毒性的副产物,包括活性氧如一氧化氮(NO)、过氧化氢(H2O2)、超氧阴离子(O2-),虽然这些炎症介质在机体防御机制中是必不可少的,但是过量的活性氧会对细胞的氧化应激产生压力, 引起的慢性炎症会持续地破坏组织。炎症已经被证明与各种疾病的发病机制有关,如糖尿病[3]、老年痴呆症[4]、心血管疾病[5]和癌症[6]。 已经有很多抗炎症的药物被开发并在临床获得应用,控制和回复异常的炎症。 目前主要的有2 类抗炎药,最主要且用量最大的非甾体类抗炎药, 如阿司匹林、对乙酰氨基酚、吲哚美辛、萘普生、双氯芬酸、布洛芬、尼美舒利、罗非昔布、塞来昔布等;甾体类抗炎药,如泼尼松、地塞米松等。 这些抗炎药的使用已被证明会诱发死亡[7],也有研究表明非甾体类抗炎药的使用会引起肝损伤[8]。 寻找更有效安全的抗炎药,是研究的一个热点。 蒙古口蘑多糖提取物已经被证明具有抗炎症、抗氧化的作用[9],然而其作用机制和作用途径仍然不清楚。 细菌内毒素(LPS)通过Toll样受体4 (toll-like receptor 4, TLR 4) 激活巨噬细胞,是慢性炎症巨噬细胞(RAW 264.5)的强效刺激物之一[10],作者通过LPS 诱导RAW264.7 细胞,选取炎症与氧化应答相关的基因Hypoxia-induciblefactor1α (HIF-1α)、Nuclear factor-κB(NF-κB)、Signal transducer and activator of transcription3protein(STAT3)、Cyclooxygenase -2 (COX -2) 和Inducible nitric oxide synthase(iNOS)检测蒙古口蘑多糖影响细胞炎症反应,发挥抗炎作用的途径。
1 材料与方法
1.1 材料、试剂及仪器
Cell Counting Kit: 购自日本同仁化学-东仁化学科技 (上海) 有限公司;LPS,S-Methylisothiourea Sulfate(SMT):购自Sigma-aldrich 公司;细胞RNA提取试剂盒: 购自北京天根生化科技有限公司;Revert Aid First Strand cDNA Synthesis Kit,Maxima SYBR Green qPCR Master Mix: 购自Thermo Fisher公司;RPMI 1640 培养基: 购自BI 公司; 胎牛血清FBS:购自北京四季青生物科技有限责任公司;Anti-COX2 antibody: 购 自Abcam 公 司;HIF1α Rabbit Polyclonal antibody,NF-κB Rabbit Polyclonal antibody,STAT3 Rabbit Polyclonal antibody: 购自Proteintech公 司 ;Anti -GAPDH Monoclonal Antibody,HRP affinipure Goat Anti-Rabbit igG(H+L),HRP affinipure Goat Anti-Mouse igG(H+L):购自Earthox 公司;超敏ECL 化学发光试剂盒:购自上海碧云天生物技术有限公司;Mouse IL-1β ELISA kit (小鼠白细胞介素-1β),Mouse TNF-α ELISA kit (小鼠肿瘤坏死因子-α):购自欣博盛生物科技有限公司;引物:由上海生工生物工程股份有限公司合成。
ND-1000 型微量紫外分光光度计、 冻干机、普通PCR 仪:购自Thermo Fisher 公司;5430R 低温台式冷冻离心机:购自Eppendorf 公司;BG-power5000型稳压稳流电泳仪:购自北京百晶生物技术有限公司;实时定量PCR 仪:购自Bio-rad 公司;凝胶成像系统:购自GE Healthcare 公司等。
1.2 实验对象
蒙古口蘑采摘于内蒙古锡林郭勒草原, 切片,在(-50±3) ℃,冻干48 h,自动匀浆机匀浆后,取粉末100 g 加入体积分数80% 1 L 的乙醇, 室温3 d,上清液即为质量浓度100 g/L 的多糖提取物(Tricholoma mongolicum polysaccharide extract,TMPE)[11]。 小鼠巨噬细胞(RAW264.7),培养条件:1640 培养基、10% FBS、37 ℃、体积分数5% CO2。
1.3 试验方法
1.3.1 细胞活力实验取对数期RAW264.7 细胞悬液接种于96 孔板,接种密度为5×105个/mL,每孔100 μL,12 h 后加入不同质量浓度的TMPE,TMPE的质量浓度设定为0、0.01、0.1、1、10、100 μg/mL,每组6个复孔,加入10 μL CCK-8 进行细胞活力测定。
1.3.2 TMPE 抗炎效果检测实验取对数期RAW264.7 细胞悬液接种于96 孔板, 接种密度为5×105个/mL, 每孔100 μL,12 h 后加入LPS 刺激,设置空白对照组、LPS(1 μg/mL)组、LPS(1 μg/mL)+SMT(6 μmol/mL)组、LPS(1 μg/mL)+TMPE(0.01 μg/m)组、LPS(1 μg/mL)+TMPE(0.1 μg/mL)组、LPS(1 μg/mL)+TMPE(1 μg/mL)组、LPS(1 μg/mL)+ TMPE(1 μg/mL)组,每组6个复孔,作用24 h 后,收集上清液通过Griess 法测定上清液中的一氧化氮(Nitric oxide,NO)含量[12],Elisa 测定TNF-α、IL-1β 的含量。
1.3.3 RNA 的提取、 反转录及定量取对数期RAW264.7 细胞悬液接种于6 孔板, 接种密度为1×106个/mL, 每孔2000 μL,12 h 后加入LPS 刺激,设置空白对照组,作用12 h 后,收集细胞并提取RNA 和蛋白质,RNA 的提取按照北京天根生化试剂说明书进行, 所提RNA 通过微量分光光度计测定浓度。并用1.2 g/dL 琼脂糖凝胶电泳检测RNA 的质量, 按照RevertAid First Strand cDNA Synthesis Kits 说明书进行反转录。 按照Maxima SYBR Green qPCR Master Mix 说明书进行实时定量实验测定mRNA 表达量,引物退火温度均为60 ℃,至少5个复孔,其他参照说明书,采用2-ΔΔCt法进行数据表达量分析。 以GAPDH 作为管家基因,NCBI 中提供的mRNA成熟序列设计实时定量扩增引物。 引物序列如表1。

表1 引物序列Table 1 Sequences of primers
1.3.4 免疫印迹取对数期RAW264.7 细胞悬液接种于6 孔板,接种密度为1×106个/mL,每孔2000 μL,12 h 后加入LPS 刺激, 设置空白对照组,作用12 h 后,提取蛋白质,采用BCA 蛋白质定量试剂盒检测总蛋白质的浓度,SDS-PAGE,转膜,封闭,抗体孵育,ECL 显色。
1.4 数据统计分析
用SPSS19.0 对试验数据进行统计分析,所有试验结果数值均用平均值±标准误差表示。 选用单因素方差分析(ANOVA LSD),DUNCAN 多重比较和双变量相关分析。
2 结果与分析
2.1 检测结果
2.1.1 细胞活力检测在测定TMPE 的抗炎活性前,先对TMPE 对细胞的影响进行评估,表2 显示与未经处理的细胞对照组(0 质量浓度)相比,不同质量浓度的TMPE 对RAW264.7 作用不同。 在质量浓度0.01~10 μg/mL 的TMPE 测试范围内观察到的细胞存活率随着剂量增加而增加,在TMPE 最大质量浓度为100 μg/mL 的时候,细胞存活率与对照组相比会显著降低(P<0.05),该浓度的细胞存活率仅为62%。在TMPE 质量浓度为0.1、1、10 μg/mL 时与对照组相比细胞存活率显著增加(P<0.05),在10 μg/mL 时TMPE 显示出最高的存活率(172%)。
2.1.2 TMPE 对NO 生成的影响通过测试TMPE对NO 生成的抑制效果,验证TMPE 的抗炎活性,结果显示如图1。 从图中可以确定LPS 诱导的RAW264.7细胞,NO 的生成量相比对照组显著增加(P<0.05),在LPS 诱导的RAW264.7 细胞模型中加入不同质量浓度的TMPE (0.01、0.1、1 μg/mL 和10 μg/mL),NO 的产生量相比LPS 模型组均显著降低(P<0.05)(抑制率分别是38.21%、64.17%、58.16%和79.42%)。SMT(强的iNOS 抑制剂)显著地降低了LPS 诱导的RAW264.7 细胞NO 产量(P<0.05)(抑制率为45.24%)。

表2 不同质量浓度下细胞存活率Table 2 Survival rate of cells at different concentration
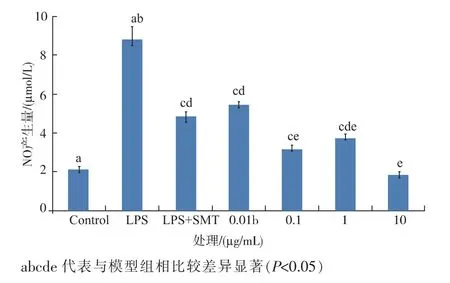
图1 不同处理下NO 的产量Fig. 1 Production of NO under different treatments
2.1.3 TMPE 对TNF-α 和IL-1β 的影响在LPS诱导的RAW264.7 炎症模型中,检测TMPE 对炎性因子TNF-α 和IL-1β 生成的抑制效果, 结果见图2。由图表明,LPS 诱导的模型组中,TNF-α 和IL-1β的质量浓度均显著高于对照组(P<0.05),加入0.01、0.1、1、10 μg/mL 的TMPE 后均能显著降低TNF-α(抑制率分别是27.91%、36.31%、36.14%、45.09%)和IL-1β 的产生 (抑制率分别是47.75%、58.47%、60.21%、64.55%)(P<0.05)。 综合细胞活力,NO 生成量实验和本实验结果。 TMPE 的质量浓度在后续的实验中,确定为在10 μg/mL。
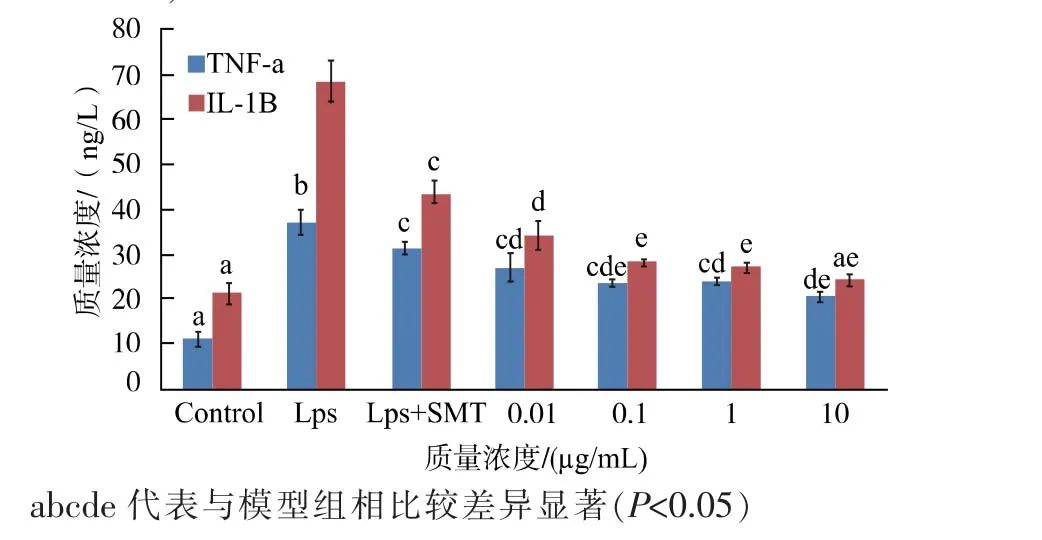
图2 不同处理下TNF-α 和IL-1β 的质量浓度Fig. 2 Contents of TNF- alpha and IL-1 beta under different treatments

图3 mRNA 相对表达量Fig. 3 Expression levels of genes
2.1.4 基因表达量检测用10 μg/mL 的TMPE 处理细胞基因mRNA 表达量见图3,与空白组相比较LPS 模型组,相关炎症基因(iNOS、COX-2、NF-κB、STAT3、HIF-1α)的表达量均显著提高(P<0.05),在LPS+TMPE(10 μg/mL)组中,相关炎症基因的表达量除NF-κB基因外, 其他炎症相关基因(iNOS、COX-2、STAT3、HIF-1α)的表达量与LPS 模型组均显著降低(P<0.05),iNOS、COX-2 和HIF-1α 基因的表达量仍然显著高于对照组(P<0.05),其中STAT3的表达量降低程度比对照组的更低, 且差异显著(P<0.05)。
2.1.5 免疫印迹检测结果用10 μg/mL 的TMPE处理细胞免疫印迹结果见图4, 通过免疫印迹检测TMPE 对炎症相关蛋白质(COX-2,NF-κB,STAT3,HIF-1α) 表达的影响,LPS 模型组与对照组相比炎症相关蛋白质(COX-2、NF-κB、STAT3、HIF-1α)的表达量均有所增加, 其中COX-2 和STAT3 的蛋白质增加量最多,NF-κB 和HIF-1α 蛋白质表达量增加次之。LPS+TMPE 组与LPS 模型组相比,除NF-κB蛋白质变化不明显, 其他蛋白质 (COX-2,STAT3,HIF-1α)的表达量均有降低,特别是STAT3 蛋白质的表达量。在LPS+TMPE 组中STAT3 蛋白质的表达量比对照组都低。
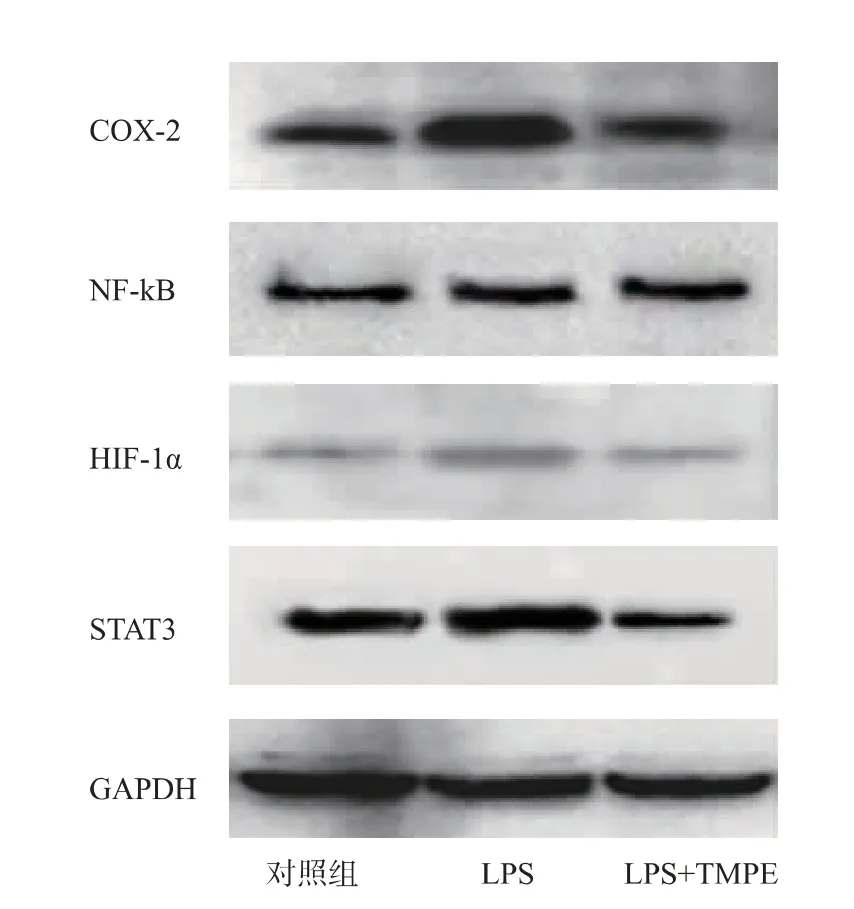
图4 免疫印迹结果Fig. 4 Results of western blot
2.2 讨论
食用菌种类繁多,营养丰富,富含各种氨基酸、脂肪酸、多糖等多种营养成分,口味丰美,同时具有增强免疫力、抗肿瘤、降血糖血脂等药用功能[13-14]。野生蒙古口蘑稀有、绿色、纯天然,倍受大家的追捧。 研究发现,蘑菇多糖提取物具有抗炎等多种药理活性[15],本实验通过LPS 诱导RAW264.7 细胞的炎症模型, 质量浓度在0.01~10 μg/mL 的TMPE 测试范围内观察到的细胞存活率、NO 生产抑制率及炎性因子TNF-α 和IL-1β 生成的抑制效果随着剂量增加而增加, 质量浓度10 μg/mL 时TMPE 显示出最高的细胞存活率(172%),NO 的最大抑制效果(45.24%),TNF-α 和IL-1β 生成最大的抑制效果(分别为58.47%、65.86%)。 蒙古口蘑多糖提取物有望成为新的抗炎药物。
炎症因子TNF-α 和IL-1β 的产生受转录因子NF-κB 和STAT3 的调控[16],NO 是由iNOS 和COX-2催化合成的,研究表明甲醇、乙醇提取不同蘑菇的多糖均可以抑制NO 的生成[17-18],炎症的发生与iNOS和COX-2 的过表达有关[19],iNOS 和COX-2的表达受转录因子NF-κB、STAT3 及HIF-1α 调控[20], 抑制JAK2-STATs 活性会导致LPS 诱导的NO 产生及iNOS 的表达[21],激活HIF-1α 通路会增加NO 的表达[22]。 本实验中选择HIF-1α、NF-κB、STAT3、COX-2、iNOS 作为研究对象, 定量结果显示,TMPE 会导致iNOS、COX-2、STAT3、HIF-1α 的表达量降低,免疫印迹结果显示,TMPE 会导致COX-2、STAT3、HIF-1α 蛋白质的表达量降低, 而NF-κB 的mRNA表达量及蛋白质质量均变化不明显, 因此可以推断TMPE 的抗炎作用主要通过调节转录因子STAT3和HIF-1α 的表达进而调节iNOS 和COX-2 的表达,而不主要通过转录因子NF-κB 的变化发挥抗炎作用,也就是说TMPE 通过JAK-STAT3 及HIF-1α信号通路实现抗炎的效果。
3 结语
通过LPS 诱导RAW264.7 细胞的炎症模型,发现蒙古口蘑多糖提取物在不同浓度下具有不同质量的抗炎活性, 通过对HIF-1α、NF-κB、STAT3、COX-2、iNOS基因及蛋白质的表达确定蒙古口蘑多糖提取物主要通过JAK-STAT3 及HIF-1α 信号通路,而不主要通过NF-κB 信号通路,抑制炎症因子TNF-α、IL-1β 和NO 的释放,进而发挥抗炎作用。
