微小RNA-216a在急性胰腺炎并发肺损伤患者中的表达水平及其对内皮细胞通透性的影响
2020-08-25朱惠云宋英晓孔祥毓杜奕奇
朱惠云 宋英晓 孔祥毓 杜奕奇
海军军医大学第一附属医院消化内科,上海 200433
AP并发急性肺损伤(acute lung injury, ALI)发病急骤,病情凶险,病死率居高不下,占AP总体病死率的70%[1-2]。外泌体是细胞分泌的一种微小囊泡,可包裹蛋白质或RNA等生物信息分子,参与体内重要的物质运输。既往动物实验研究发现,miR-216a在AP大鼠血浆中显著高表达,或可作为AP的标志物[3],但目前尚无miR-216a与AP并发ALI相关的研究。内皮细胞通透性的改变是ALI发生发展的中心环节[4],本研究旨在检测miR-216a在AP并发ALI患者血浆及其外泌体中的表达水平,以具有干细胞潜能的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)作为体外内皮细胞模型,检测miR-216a对内皮细胞通透性的影响,从而了解miR-216a参与AP并发ALI发生的具体机制。
材料与方法
一、研究对象
收集2015年12月至2016年3月间海军军医大学第一附属医院消化内科收治的40例AP患者,按是否并发ALI将患者分为AP并发ALI组(AP-ALI组,13例)和AP不并发ALI组(AP组,27例)。以8 名健康志愿者作为对照组。AP诊断符合2012年亚特兰大AP诊断标准[2]。ALI的诊断标准:(1)存在如AP等高危因素;(2)起病急骤,出现呼吸频率加快伴或不伴呼吸窘迫;(3)低氧血症,动脉血氧分压(PaO2)/吸氧浓度(FiO2)≤300 mmHg (1 mm Hg=0.133 kPa);(4)X线检查可见双肺浸润影;(5)肺毛细血管楔压≤18 mmHg,除外心源性肺水肿[5]。本研究获医院伦理委员会审批(CHEC2015-067),所有患者及志愿者均签署相关知情同意书。
二、血浆及其外泌体的采集和RNA的抽提
收集AP患者入院24 h内的新鲜外周血3~5 ml于EDTA抗凝管中,轻轻混均后置1 000 g离心10 min。收集上层血浆,-80℃冻存。健康志愿者血浆采集方法同上。使用TRI Reagent BD(Ambion,美国)抽提血浆RNA。采用外泌体抽提试剂盒(QIAGEN,德国)提取血浆中的外泌体,按照试剂盒说明书操作。取2 μl提取的外泌体样本滴于经过亲水化处理的载网上,干燥后用甲酸铀染色1min,吸干并置于烤灯下烘烤10min后置电镜观察和鉴定。同上法抽提外泌体RNA。
三、miR-216a检测
采用RT-PCR法检测血浆及外泌体miR-216a的表达。使用TaqManTMmicroRNA逆转录试剂盒(Thermo Fisher,美国)先逆转录成cDNA,再使用TaqManTM通用PCR主混合料在LightCycler 480热循环机 (Roche,德国)上进行qRT-PCR扩增,以miR-39(QIAGEN,德国)作为外源性参照。miR-216a引物序列为3′UAAUCUCAGCUGGCAACUGUGA-5′,PCR反应条件:95℃ 10 min,95℃ 15 s;60℃、60 s,40个循环。通过PCR仪自带软件获取Ct值,将45-Ct=45-(CtmiR-216a-CtmiR-39)作为描述miR-216a相对表达量的参数。CtmiR-216a-CtmiR-39值>45的样本统一按45进行计算。实验重复3次,取均值。
四、内皮细胞通透性的测量
HUVEC细胞购自美国ATCC细胞库,复苏后置于10%胎牛血清、双抗、碳源的DMEM高糖培养液中培养、传代。使用Lipofectamine®2000(Thermo Fisher,美国)将anti-miR-216a转染入HUVEC细胞,构建miR-216a低表达细胞株。
将AP-ALI患者的血浆外泌体分别与HUVEC(AP-ALI-HUVEC组)、miR-216a低表达HUVEC(AP-ALI-anti-miR-216a HUVEC组)共培养24 h,以未处理的HUVEC细胞作为对照组。取对数生长期内皮细胞,以每孔0.2×104个细胞接种至Transwell细胞小室(Corning costar,美国)上室,下室加培养液,培养至细胞融合度接近100%时,将Millicell ERS-2上皮伏特欧姆计的电极片短端浸入上室内部培养液内,长端浸入下室培养基内,且与培养板成90°垂直,读取并记录跨内皮细胞电阻值(trans-endothelium electrical resistant, TEER),电阻值低表示内皮细胞的通透性高。每组设置2个小室,每个小室重复测3次,取均值。
五、统计学处理
结 果
一、临床基本信息
AP-ALI组与AP组患者的性别比、年龄、病因、血淀粉酶水平的差异均无统计学意义,但AP-ALI组患者血肌酐和尿素氮水平显著高于AP组,差异均有统计学意义(表1)。
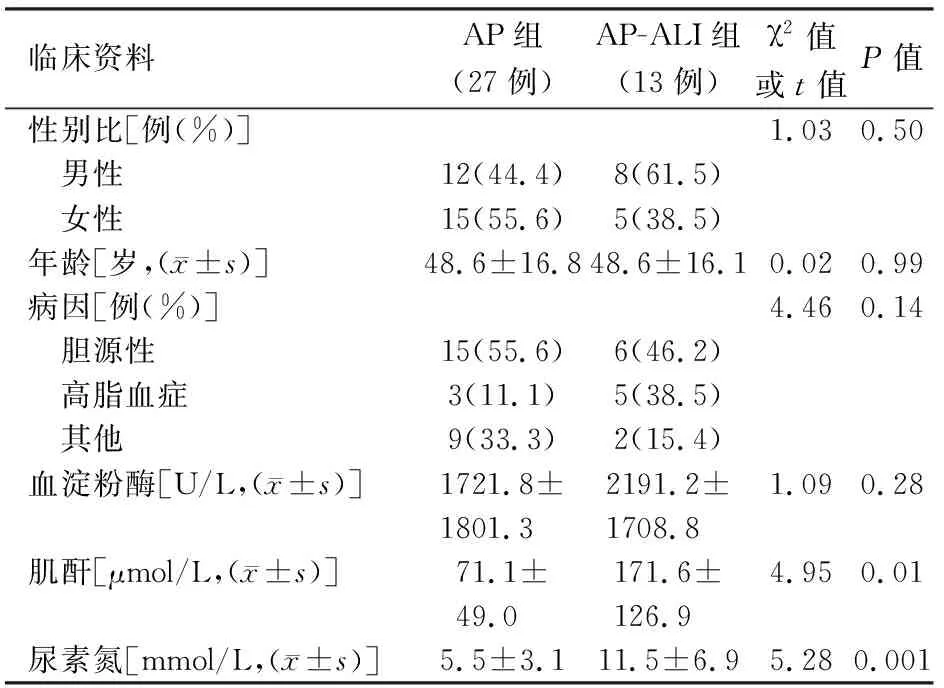
表1 40例急性胰腺炎患者一般资料
二、对照组、AP组、AP-ALI组患者血浆miR-216a水平
对照组、AP组、AP-ALI组患者血浆miR-216a水平分别为5.37±1.54、11.08±1.60、14.45±1.64,AP-ALI组显著高于AP组,AP组又显著高于对照组,差异均有统计学意义(t值分别为6.15、9.11,P值均<0.01)。
三、对照组、AP组、AP-ALI组患者血浆外泌体 miR-216a水平
电镜下观察血浆外泌体为大小50~90 nm的杯状膜泡(图1)。对照组、AP组、AP-ALI组患者血浆外泌体中miR-216a水平分别为5.01±0.79、10.86±1.31、14.03±1.58,AP-ALI组显著高于AP组,AP组又显著高于对照组,差异均有统计学意义(t值分别为6.25、7.98,P值均<0.01)。
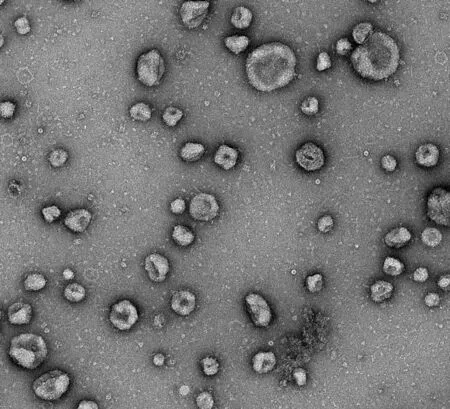
图1 AP-ALI患者血浆外泌体的形态(透视电镜,×10 000倍)
四、miR-216a增加内皮细胞通透性
以对照组的电阻值为1,AP-ALI-HUVEC组、AP-ALI-anti-miR-216a HUVEC组的电阻比值分别为0.74±0.04、1.02±0.08,AP-ALI-HUVEC组显著低于其他两组,差异均有统计学意义(t值分别为5.73、5.21,P值均<0.05),提示AP-ALI患者血浆外泌体通过运输miR-216a增加HUVEC通透性。
讨 论
AP合并ALI的诊断通常基于临床表现、实验室检查和影像学检查技术,目前尚缺乏能够早期高效预判AP合并ALI的标志物[6-8]。miR-216a与各种疾病特别是胰腺相关疾病密切相关[9-13]。与正常胰腺组织相比,miR-216a在胰腺导管腺癌中下调200倍以上,在慢性胰腺炎中miR-216a表达无明显变化,在胰腺星状细胞转化为肌成纤维细胞时miR-216a表达下调[14]。此外,miR-216a还与胰腺导管腺癌细胞迁移、侵袭、上皮间充质转化相关。本课题组既往研究结果显示,miR-216a可作为AP大鼠的标志物,其灵敏度和特异度均高于血清淀粉酶[3]。本研究结果表明,AP-ALI组患者血浆miR-216a水平显著高于AP组,AP组血浆miR-216a水平又显著高于健康志愿者。为进一步探讨miR-216a以何种形式存在于血浆中,本研究抽提血浆中的外泌体并检测miR-216a的表达水平,结果显示AP-ALI组患者血浆外泌体内miR-216a水平显著高于AP组,AP组血浆外泌体miR-216a水平又显著高于健康志愿者,间接提示miR-216a以外泌体形式存在于血浆中。
内皮细胞通透性的改变是ALI发病的中心环节。TEER是衡量内皮细胞通透性的常用指标。有研究报道miR-216a可能是急性呼吸窘迫综合征的一个保护因素,可通过JAK2/STAT3/NF-κB通路缓解脂多糖诱导的炎性损伤[15]。但在miR-216a与AP的相关研究中认为,miR-216a是AP发生发展的危险因素。miR-216a可通过靶向作用于PTEN和smad7,调节PI3K/AKT/TGF-β通路,诱导AP的发生[16]。细胞间紧密连接蛋白(如ZO-1、Occludin等)的表达改变可直接影响细胞通透性[17]。为探讨miR-216a是否参与调节内皮细胞的通透性,本研究以HUVEC细胞作为研究对象,将anti-miR-216a 转染入HUVEC细胞,与AP-ALI患者血浆外泌体共培养。另将未转染anti-miR-216a的HUVEC细胞与AP-ALI患者血浆外泌体共培养,结果发现与AP-ALI患者血浆外泌体共培养后的HUVEC细胞通透性显著高于对照组,而与AP-ALI患者血浆外泌体共培养的转染anti-miR-216a的HUVEC细胞通透性与对照组差异无统计学意义,表明miR-216a可增加内皮细胞通透性,可能与肺损伤的发生相关。miR-216a是否通过改变紧密连接蛋白的表达增加内皮细胞通透性,及其具体调节机制有待进一步的研究。
利益冲突所有作者均声明不存在利益冲突
