外科手术在伴有门静脉系统侵犯的胰腺癌治疗中的临床价值
2020-08-25吕少诚贺强郎韧李立新赵昕任章勇曹迪
吕少诚 贺强 郎韧 李立新 赵昕 任章勇 曹迪
首都医科大学附属北京朝阳医院肝胆外科,北京 100020
胰腺癌是临床比较常见的消化道恶性肿瘤,其恶性程度高,预后极差[1]。据最新统计数据显示,我国胰腺癌发病率呈逐年增加的趋势,目前居于恶性肿瘤第10位,病死率居于恶性肿瘤第6位[2]。胰腺癌由于其解剖位置的特殊性,起病隐匿,容易侵犯周围组织脏器。据美国国家癌症中心统计数据显示[3],胰腺癌确诊时肿瘤位于胰腺内且适合手术切除的患者仅占10%。依据文献数据显示[4-6],17%~32%的胰腺癌患者确诊时已经侵犯门静脉系统(门静脉、肠系膜上静脉和脾静脉),而对于此类患者的首选治疗方案目前尚存在争议。本研究回顾性分析66例伴有门静脉系统侵犯的胰腺癌患者的临床资料,探讨此类患者采用外科治疗的临床疗效。
资料与方法
一、一般资料
收集2011年1月至2018年12月间首都医科大学附属北京朝阳医院肝胆外科收治的66例伴有门静脉系统侵犯的胰腺癌患者的临床资料,所有患者均接受联合血管切除重建的胰腺癌根治性手术,归为门静脉系统侵犯组。选取同期129例无血管侵犯和远处转移并行手术切除的胰腺癌患者作为对照组。排除标准:(1)术前影像学检查提示远处转移;(2)术前影像学检查提示腹腔重要动脉(腹腔干、肝总动脉、腹主动脉)受侵犯;(3)术中因各种原因(腹腔种植转移、术前未发现的转移灶、下腔静脉侵犯、家属因素等)未行肿瘤切除;(4)术后病理证实为非胰腺癌(胰腺神经内分泌肿瘤、胰腺囊实性肿瘤等)或门静脉系统血管壁未受肿瘤侵犯者。66例患者中男性30例,女性36例,年龄(62±10)岁(35~81岁)。临床表现:黄疸33例,腹痛25例,胃肠道不适5例,体检发现3例。16例患者术前因黄疸行经皮经肝胆管穿刺引流术减黄治疗,26例患者既往有糖尿病病史。术前CA19-9水平为375(55,1034)U/ml(2~7 000 U/ml)。
二、手术方式和围手术期处理
依据肿瘤部位决定胰腺癌根治性手术切除范围:胰头及钩突部肿瘤行胰十二指肠根治术;胰体尾肿瘤行胰体尾癌根治术;胰腺颈部或范围广的肿瘤行全胰十二指肠根治术。依据静脉侵犯的类型和部位决定血管重建方式:静脉局部侵犯行楔形切除后直接缝合;静脉部分侵犯行血管区段切除后依据吻合张力行端端吻合或异体血管置换;多支静脉侵犯行受侵静脉切除后异体血管置换。
术后处理:常规应用舒普森预防感染,在除外术后出血风险的前提下应用低分子肝素抗凝预防重建后静脉血栓形成,依据患者胃肠道功能恢复情况拔除胃管并逐渐恢复饮食,依据患者引流液的性状及实验室检查结果逐渐拔除引流管。术后建议患者在肿瘤内科实施后续化疗方案。
三、随访策略
出院后随访采用门诊复查及电话随访相结合方式。术后第1、3个月返院复查,2年内每3个月返院复查1次,2年以上每半年返院复查1次。比较门静脉系统侵犯组和对照组的远期预后。随访复查内容主要包括血液检查(血常规、血生物化学、CA19-9)、影像学检查(腹部增强CT、肺部CT)、后续治疗方案、肿瘤复发和生存情况。
四、统计学处理

结 果
一、手术情况
66例患者均顺利完成手术。依据肿瘤部位,行胰十二指肠根治术55例,全胰十二指肠根治术8例,胰体尾癌根治术3例。肿瘤侵犯血管的部位包括单独侵犯肠系膜上静脉27例,侵犯肠系膜上静脉、门静脉和脾静脉汇合处22例,单独侵犯门静脉17例。依据静脉侵犯的类型和部位,行异体血管置换术43例,血管区段切除后端端吻合术16例,血管楔形切除后直接缝合7例。患者术中出血量600(400,1000)ml(200~2 400 ml),输血31例,手术时间(11.7±2.3)h(6~17 h)。
二、围手术期情况
66例患者均无围手术期死亡。术后发生并发症19例(28.8%),并发症Clavien分级为Ⅰ级7例,Ⅱ级7例,Ⅲa级2例,Ⅲb级3例。其中生化瘘6例(9.1%),均经非手术治愈;腹腔感染5例(7.6%),1例行剖腹清创术,1例行介入穿刺,3例非手术治愈;腹腔出血3例(4.5%),1例行介入栓塞术,1例行剖腹清创止血术,1例非手术治愈;胃排空延迟3例(4.5%),均经非手术治愈;C级胰瘘合并腹腔出血1例(1.5%),行剖腹清创止血术;胆瘘1例(1.5%),经非手术治愈。66例患者均顺利出院,术后住院天数为(20.8±9.7)d(6~58 d)。
三、病理学检查
66例患者术后病理学检查结果证实均为胰腺恶性肿瘤,同时伴有静脉血管壁侵犯。肿瘤部位:胰头部53例,胰颈部5例,胰腺钩突部5例,胰体尾部3例;肿瘤分化程度:中分化43例,中低分化17例,中高分化3例,高分化2例,低分化1例;肿瘤大小(3.5±1.0)cm(1.5~6.0 cm);淋巴结平均检出(23.7±14.9)个(7~86个),淋巴结阳性41例(62.1%)。达到根治性(R0)切除患者63例,R0切除率为95.5%。
四、术后随访及生存率
随访截至2019年3月,65例患者获得随访,随访率为98.5%。随访期间26例(40.0%)患者术后接受辅助化疗,化疗周期为1~4个周期。44例(67.6%)患者肿瘤复发,首次复发部位包括肝脏转移34例,腹腔广泛转移8例,肺部转移2例。
门静脉系统侵犯组和对照组患者术后中位生存时间分别为13个月和22个月,术后1、2、3年无瘤生存率分别为39.9%、30.1%、22.7%和57.5%、42.2%、38.2%(χ2=10.002,P=0.002,图1),1、2、3年总体生存率分别为53.3%、30.4%、23.4%和73.1%、45.8%、40.1%(χ2=7.438,P=0.006,图2)。
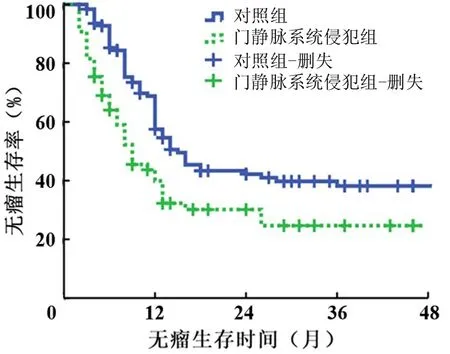
图1 伴有门静脉系统侵犯的胰腺癌患者的无瘤生存曲线
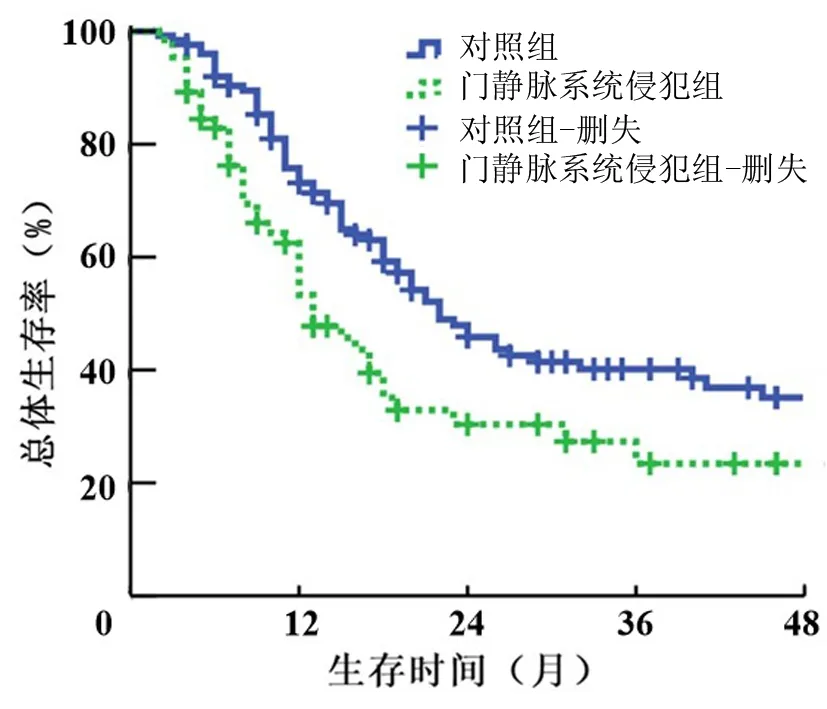
图2 伴有门静脉系统侵犯的胰腺癌患者的总体生存曲线
讨 论
胰腺癌由于其解剖位置的特殊性和肿瘤本身的恶性程度,总体手术切除率不足20%,5年生存率不足10%[7-8]。因此,如何提高胰腺癌患者的手术切除率一直是胰腺外科临床研究的重点。
对于胰腺癌侵犯静脉而言,上世纪末因限于围手术期技术和辅助治疗的发展,静脉侵犯一直被认为是胰腺癌手术的禁忌。但到了本世纪初,越来越多的研究表明[9],胰腺癌静脉侵犯患者手术治疗的预后明显优于非手术治疗患者。Ravikumar等[10]回顾性分析了英国9家胰腺外科中心患者的资料,其中联合血管切除患者230例,姑息性手术患者518例,联合血管切除患者的中位生存时间为18.2个月,明显长于姑息性手术者的8个月。2006年美国安德森癌症中心胰腺外科专家Varadhachary等[11]首次提出了交界可切除胰腺癌的概念,不再将单独静脉侵犯作为胰腺癌手术的禁忌。2009年美国肝胆胰协会引入此概念,写入美国国立综合癌症网络指南并沿用至今[12]。德国汉堡大学Yekebas等[13]回顾性分析了136例胰腺癌门静脉系统侵犯患者的资料,总体根治性手术切除率为87%,中位生存时间为15个月,3年生存率为21.4%。本研究结果与其相似,也表明伴有门静脉系统侵犯的胰腺癌患者的远期预后较无静脉侵犯的胰腺癌患者差。
本研究结果显示,对伴有门静脉系统侵犯的胰腺癌患者实施外科手术是安全可行的,术中可根据静脉侵犯的具体情况采用不同的静脉重建方式。Yekebas等[13]依据肿瘤侵犯的位置和重建方式将其分为直接缝合法、直接端端吻合法(侵犯肠系膜上静脉、侵犯门静脉、侵犯汇合部)、成形后端端吻合法和血管移植物法。2014年,国际胰腺外科小组[14]将胰腺癌受侵静脉切除后的重建方式分为直接缝合法、血管补片法、端端吻合法和血管移植物法。本研究未采用血管补片法,笔者认为需要采用血管补片的患者往往受侵范围相对较大,为保证R0切除,行血管区段切除后重建更为安全。本研究共采用直接缝合法7例,端端吻合法16例,血管移植物法43例。目前临床上对于血管移植物的选择主要有3种,分别为自体血管、人工血管和异体血管。笔者所在医疗中心采用异体血管作为血管移植物[15-16],一方面避免了获取自体血管时的手术创伤,另一方面也避免了人工血管组织相容性差和规格单一的问题,并取得了不错的效果。
需要指出的是,目前对于伴有静脉侵犯的胰腺癌患者而言,是首选新辅助化疗还是直接手术切除,尚存在争议[17]。2016年美国Katz等[18]发表的对于交界可切除胰腺癌新辅助化疗的Ⅲ期临床研究结果显示,22例患者经FOLFIRINOX化疗方案后,15例患者行后续手术,手术转化率为68.2%,术后1年和2年生存率分别为93.3%和46.7%,但是未行手术切除患者的1年和2年生存率仅为42.8%和14.3%。限于人种的差异,我国新辅助化疗的转化率更低,白雪莉等[19]采用改良FOLFIRINOX方案进行新辅助化疗后,局部进展期胰腺癌患者的手术转化率也仅为50%(9/18)。因此,如何有效评估患者的化疗有效性和差异性,可能是临床决策首选新辅助化疗还是直接手术切除的关键。
利益冲突所有作者均声明不存在利益冲突
