单克隆抗体糖基化修饰研究进展
2020-08-14张忠兵罗建辉
张忠兵,罗建辉
·综述·
单克隆抗体糖基化修饰研究进展
张忠兵,罗建辉
100022 北京,国家药品监督管理局药品审评中心生物制品药学部
单克隆抗体药物是近五年来生物技术药物开发的热点,其市场近来成倍增长[1]。单抗类药物的活性除了由氨基酸顺序决定外,翻译后修饰亦对活性有重大影响。常见的翻译后修饰包括脱酰胺、二硫键形成、末端赖氨酸剪切、糖基化等。其中糖基化主要发生于内质网和高尔基体,是一种复杂的翻译后修饰[2]。根据单克隆抗体的作用机制,其糖基化的位点、糖型种类及丰度都可能影响产品的有效性、安全性和质量稳定性,因此糖基化被普遍认为是单抗药物的关键质量属性(CQA)之一[3]。多数单抗产品的生产宿主细胞为哺乳动物细胞表达体系,由于生产工艺控制的程度不同,糖基化水平在不同厂家、不同批次之间经常存在差异,给这类产品的研发和审评带来了较大挑战。研发单位应当在单抗产品早期研发阶段高度重视和设计规划糖基化修饰,建立相关检测方法,并在工艺变更和优化研究时密切关注糖基化及修饰水平;在产品临床阶段检测积累多批次糖基化检测数据,并在上市申报阶段制订合理、适用的控制标准;产品上市后开展对糖基化水平密切监测,以保证单抗产品质量持续稳定。鉴于糖基化修饰在单抗产品中的重要性,近年来工业界和研究机构对其结构、功能、工艺和质量控制进行了大量深入的研究,本文主要对这些研究进展作一综述。
1 单克隆抗体的糖基化位点和结构
单克隆抗体糖基化修饰多数为 N-连接的聚糖。IgG 型单克隆抗体一般在 Fc 段的 Asn-297 有一个保守的 N 糖基化位点,另外约 20% 的 IgG 在 Fab 区域存在另一个 N-连接的糖基化位点,这两个糖基化位点都位于重链上[4]。研究发现,单克隆抗体两条重链的糖基化程度多数情况下并不对称,进一步增加了糖基化抗体的多样性[5]。除 N-连接的糖基化外,极少数单克隆抗体药物中也存在 O-连接的糖基化。Fc 聚糖分子的核心结构是由 3 个甘露糖(Man)和 2 个 N-乙酰葡糖胺(GlcNAc)分子组成的复杂“双触角型”五糖分子的结构,并且不同的糖型可含有不同数量的其他分子,如岩藻糖(Fuc)、甘露糖、N-乙酰葡糖胺、半乳糖(Gal)、二等分 N-乙酰葡糖胺和唾液酸(Sia)。糖链的长度、分叉的方式、单糖的排列顺序的差异造成了 N-聚糖复杂多变的结构。这种 N-聚糖的核心结构可通过各种酶的作用进一步多样化,总结起来大致可分为三种结构,即高甘露糖型、杂合型和复合型,其中杂合型和复合型在大多数情况下均存在核心岩藻糖基化(图 1)。抗体中常见的糖基化结构见图 2。
单克隆抗体上的 N-聚糖结构对维持抗体构象和稳定性有重要的作用。Fc 段的 N-聚糖可以稳定 IgG 抗体的 CH2结构域,去 N-连接糖基化修饰的单克隆抗体热不稳定性加剧,其构象更容易展开和去折叠,更易于发生聚集[6]。亦有报道去 N-糖基化的 IgG 其 CH2结构域弹性增加且不可结晶[7]。NMR 分析表明 G2F 糖基化的单克隆抗体其 Fc 段末端半乳糖暴露,易与受体蛋白结合,且 1,3 糖苷键和 1,6 糖苷键两个分支的结合能力存在差异[8]。单抗 Fc 段N-聚糖可以通过 CH2结构域影响抗原和单抗分子结合产生的效应功能,Fab 段的糖基化修饰除了可能影响与抗原的结合外,也可能影响该效应功能[9]。
2 单克隆抗体的糖基化相关功能
单克隆抗体与抗原分子结合后可以引发效应功能,效应功能由 Fc 段介导,Fc 与 Fc 受体或相关补体蛋白结合,可引发抗体依赖的细胞毒作用(ADCC)或补体依赖的细胞毒作用(CDC)。单抗 Fc 段的糖基化水平可以影响 ADCC 和 CDC,并能改变抗体的药代动力学性质,部分糖型结构还能影响抗体的免疫原性。
2.1 核心岩藻糖对抗体功能的影响
ADCC 由 Fc 与 Fc-γ 受体(FcγR)结合后引发,其结合力明显受 CH2结构域中 N-聚糖影响,如降低/去除核心糖结构中的岩藻糖可以提高 ADCC 效应[10]。研究发现由Lec13 突变株表达的岩藻糖敲除的 IgG 抗体,其与 FcγRIIIa 结合能力提高了 50 倍,ADCC 效应提高了 100 倍[11]。抗体 N-聚糖核心结构中的岩藻糖是由于蛋白通过高尔基体时,在 α-1,6-岩藻糖转移酶的作用下从 GDP-Fuc 上转移岩藻糖基而得。采用敲除或低表达 α-1,6-岩藻糖转移酶的工程细胞株,或其他途径降低 IgG 抗体中的核心岩藻糖水平,可以达到提高抗体 ADCC 效应的目的[12]。
2.2 半乳糖对抗体功能的影响
末端半乳糖基对抗体效应功能的影响目前了解得相对较少。有研究表明 CDC 效应是由补体蛋白 C1q 与 IgG 抗体 Fc 段结合后引发,末端半乳糖含量增加可以提高 CDC 效应[13]。采用糖苷酶处理去除半乳糖基可以减少补体的溶解活性[14]。还有研究表明末端半乳糖化可诱导 CH2结构域构象变化,导致其结合的 FcγR 增加;高半乳糖和去岩藻糖改造的抗体其 ADCC 活性较未改造前增加 78 倍[15]。提高的半乳糖化可能导致 Fc 段 CH2结构域之间空间距离增大,暴露出更多的氨基酸序列与 FcγRⅢa 结合[7]。因此,综合以上研究基本表明末端半乳糖可以提高 CDC 效应,但目前 CHO 细胞表达的抗体其末端半乳糖化水平普遍较低,尚未有提高半乳糖化水平的工程细胞株报道。
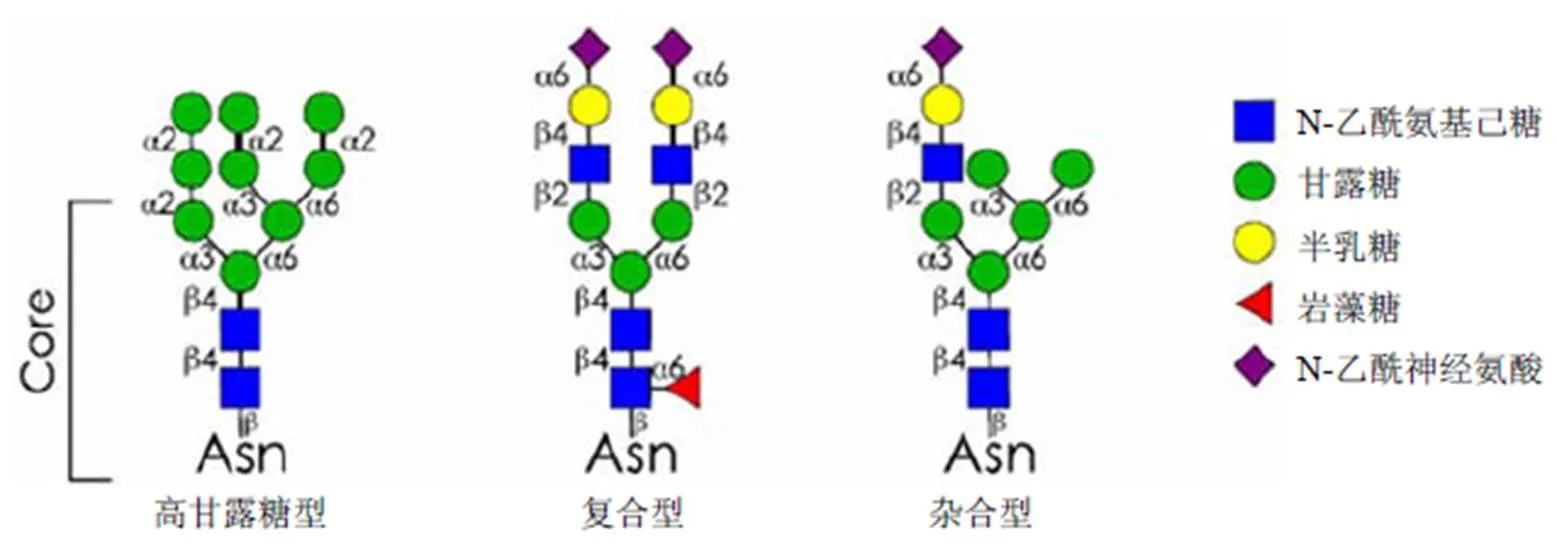
图 1 N-连接聚糖的 3 种类型
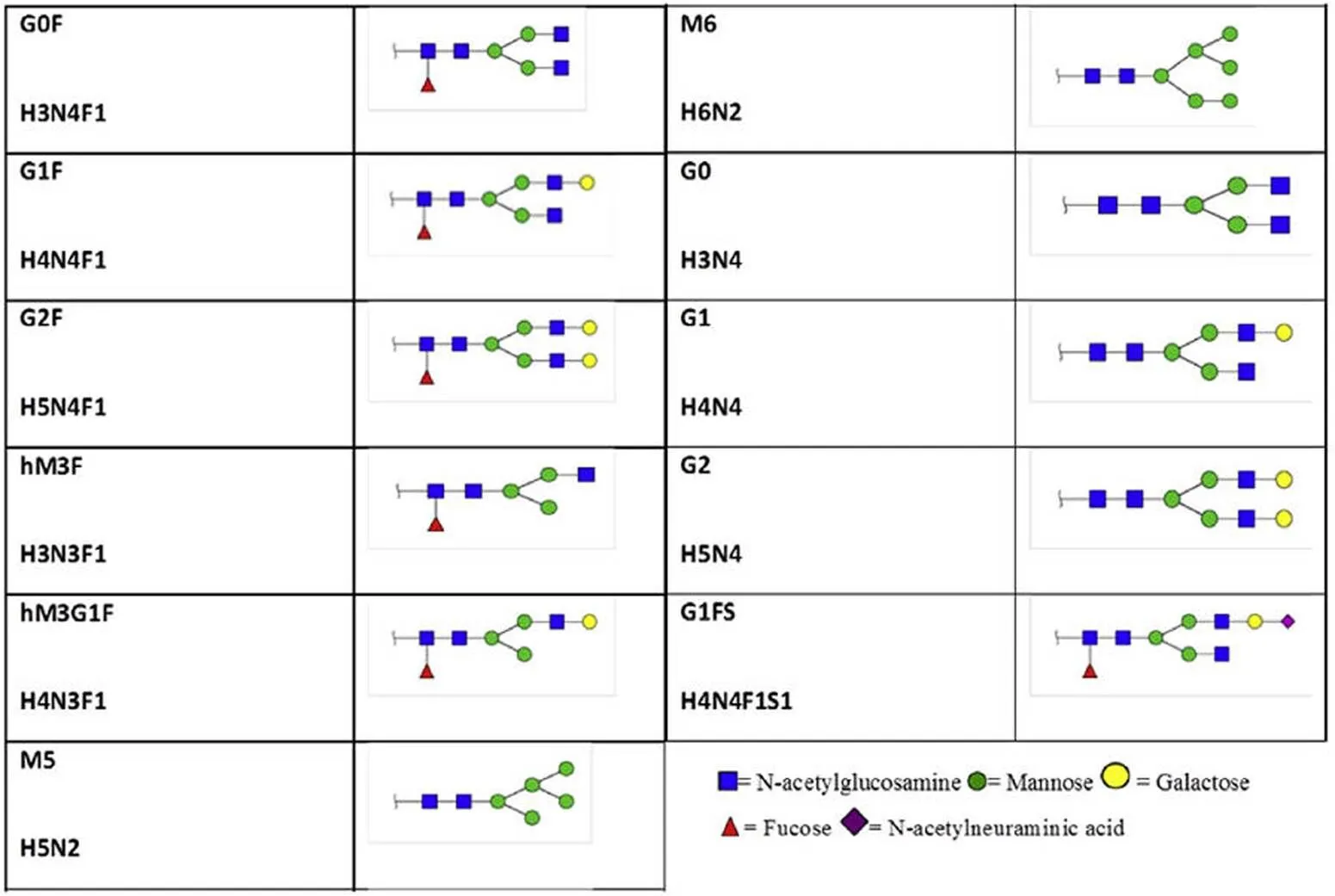
聚糖组成描述常用单糖缩略词:H:己糖(hexose);N:N-乙酰氨基己糖(N-acetylhexosamin);F:脱氧己糖(deoxyhexose);S:N-乙酰神经氨酸(唾液酸,sialic acid)。双触角结构描述常用的单糖缩略词:G:半乳糖(galactose);F:岩藻糖(fucose);M:甘露糖(mannose);N:N-乙酰氨基己糖(N-acetylhexosamin);S:N-乙酰神经氨酸(唾液酸,sialic acid)
2.3 末端唾液酸对抗体功能的影响
哺乳动物细胞表达蛋白的唾液酸修饰类型分为 N-乙酰基神经氨酸(Neu5Ac,NANA)和 N-羟乙基神经氨酸(Neu5Gc,NGNA)。人体内 IgG 的唾液酸类型为 NANA,而 NGNA 型唾液酸主要存在于动物如小鼠体内。而采用哺乳动物细胞(如 CHO 细胞)表达制备的单克隆抗体,经常带有非人的唾液酸 NGNA 修饰。带有 NGNA 的单克隆抗体可能在人体中引发免疫原性[16]。另外,唾液酸含量越高,IgG 与 Fc 受体的亲和力越低,从而导致 ADCC 活性降低,且与细胞表面的抗原结合减弱,其原因可能是唾液酸所占较大的空间导致抗体铰链区弹性减小,从而降低了受体结合能力[17]。有研究通过在表达 IgG 的宿主细胞中共分泌表达唾液酸酶 A 制备的非唾液酸化抗体,显示出更强的 ADCC 活性[18]。
唾液酸化水平可能影响到蛋白药物的代谢。研究表明 Fc 融合蛋白的代谢受唾液酸化水平影响显著,融合蛋白中唾液酸 NANA 含量越高,体内清除速率越慢,且不受O-连接还是 N-连接的影响,但 NGNA类型唾液酸对蛋白的清除速率基本没有影响[19]。
2.4 N-乙酰葡萄糖胺对抗体功能的影响
研究表明末端 N-乙酰葡糖胺基(GlcNAc)可以影响 CH2结构域的热力学稳定性。去除 GlcNAc 后可以观察到明显的热不稳定性,同时对可溶性 FcγRIIb 的结合力略有降低[20]。带有末端 GlcNAc 的 IgG 抗体具有更长的清除半衰期[21]。带有并表达 GnTIII 基因的工程细胞株其表达的抗体的双触角结构中含二等分的 GlcNAc,与 FcγRIIIa 结合能力提高,ADCC 效应增强,10 ~ 20 倍低浓度时即可显示杀伤效应,这也可能是由于空间位阻导致的核心 1,6-岩藻糖暴露减少所致[22-23]。
2.5 甘露糖对抗体功能的影响
高甘露糖型对 Fc 聚糖的异质性程度影响较为显著,常见的末端甘露糖基团包括 Man5GlcNAc2、Man6GlcNAc2、Man7GlcNAc2、Man8GlcNAc2、Man9GlcNAc2。研究表明高甘露糖型的单抗分子与 C1q 的亲和力较低,其 CDC 活性也较低[24];与 FcγRIIIa 亲和力则较高,相应的显示出了较强的 ADCC 活性,但也可能是核心岩藻糖缺失的缘故[25]。高甘露糖型对单抗的药代动力学性质影响较大,大量文献报道高甘露糖型 IgG 分子在人血循环中具有较短的半衰期[26]。FUT-8 突变的 CHO 细胞生产的高甘露糖型和杂合型的 IgG 较复合型具有较高的清除速率[25]。高甘露糖型结构在人体中容易引起免疫原性。文献[27]报道酵母、昆虫细胞、植物来源的糖蛋白多为高甘露糖型,在人体中易引起高免疫原性。抗体中带有寡聚甘露糖的较无寡聚甘露糖的具有显著的免疫原性[28]。虽然多数抗体药物中高甘露糖水平较低,但仍需密切关注产品可能引起免疫原性。细胞株和生产工艺的变化常伴随着甘露糖含量的变化。鉴于甘露糖型对单抗产品的活性、药代动力学性质、免疫原性都具有重要影响,末端甘露糖的糖型和含量一般应被视为单抗产品的关键质量属性(CQA)之一。
3 生产工艺对单抗产品糖基化的影响
鉴于聚糖结构对抗体功能的重要影响,生产工艺中应严格控制糖型种类、比例和含量。细胞株、培养基、培养工艺都可能影响单抗产品的糖基化修饰水平。
3.1 细胞株的影响
不同宿主细胞由于内质网和高尔基体中糖基转移酶和糖苷酶配置不同,其表达的单克隆抗体的糖基化修饰一般都存在差异。单抗生产常用的均为哺乳动物细胞,包括 CHO、BHK、HEK 293、PER.C6 等细胞,以及鼠骨髓瘤细胞 NS0、SP2/0、Y0 等。CHO 细胞是最常用的宿主细胞,主要是因为其基因组及扩增的稳定性较好,而且糖基化修饰稳定且类似于人的细胞系。但 CHO 细胞与人细胞系表达产物在唾液酸与半乳糖的连接方式方面有所不同,CHO 细胞缺少 α-2,6 唾液酸转移酶,只能产生 α-2,3 连接的唾液酸化聚糖;人细胞系则有两种酶能产生 α-2,3 和 α-2,6 连接的两种唾液酸化聚糖,且以 α-2,3 连接的唾液酸化聚糖为主[29]。缺少 α-2,6 连接的两种唾液酸化聚糖可能导致单抗分子体内具有不同的半衰期[30]。另外 CHO 细胞缺少功能性的 GnTIII 酶,其可以阻断连接上二等分的 GlcNAc 残基[23-24]。NS0 细胞则由于可以添加 α-1,3 半乳糖和 Neu5Gc 而不是 Neu5Ac,导致其表达产物在人体中引起较高的免疫原性[31-32]。宿主细胞对单抗的质量有重要的影响,研发单位应该在立项开始即选择合适的宿主细胞,如在后期进行宿主细胞变更需要进行大量的试验对比研究。
3.2 培养方式的影响
细胞的培养方式可以影响糖基化的种类和水平。有研究表明,从分批培养变更为分批补料式培养,即使补料成分不变,糖基化修饰有明显不同。而培养方式不变,只是规模扩大,一般不会影响糖基化水平[33-34]。因此,在单抗产品的开发过程中,培养方式应慎重变更,进行规模扩大时应注意关键工艺参数(CPP)的一致性。
3.3 培养基成分的影响
无血清培养基在单抗产品中已经得到广泛应用,然而与有血清培养相比,培养时间延长,更易造成糖基化的多样性和复杂性。培养基中的糖类等营养成分作为糖基化组成的结构片段或能量的来源,能够显著影响糖基化的异质性,分批补料培养方式可以在一定程度上保持糖含量的稳定,因此有利于糖基化水平的保持。有研究证明培养基中糖含量提高后,CHO 等细胞表达的抗体分子中相应的糖基化修饰和唾液酸化水平均得到提高[35]。低糖培养时,细胞将优先利用培养基中的糖满足能量需求,分配到糖基化修饰相应减少,分批补料培养基中去掉糖成分会导致了副产物的积累,减低了目标产物的糖基化水平[36]。
Mn2+是高尔基体中 β-1,4-糖基转移酶的辅因子,无血清培养基中 Mn2+与氨基酸成分的加入会造成更高的糖基化和唾液酸化[37]。Mn2+自身并不足以造成最大程度的糖基化,必须与核糖类、半乳糖或尿苷类协同作用。另外有研究发现,当用半乳糖等其他糖类替代培养基中的葡萄糖,且 Mn2+含量较高时容易造成高甘露糖型修饰[38]。
其他成分方面,丁酸钠可以通过阻断细胞周期特异地提高抗体的产量,但有报道培养基中加入丁酸钠可以减少半乳糖化和唾液酸化水平,增加抗体的电荷异质性[39]。单糖在核糖存在时可以促进低聚糖天线形成,且核糖的存在对于糖型种类有重要影响。尿苷可以促进核糖合成,因此单糖、核糖、尿苷都可以影响产品的糖基化,进一步影响产品的质量[40-41]。
3.4 培养温度的影响
培养温度是影响细胞生长和产物质量的重要因素之一。应该明确的是,对细胞生长最适合的温度不一定适合重组蛋白生产。较低的培养温度(30 ~ 35 ℃)可以导致细胞周期阻滞在 G0/G1 期,具有最强的细胞活力和最低凋亡,表达产物的 mRNA 水平也较高[42-43]。但较低温度时,细胞内的 UDP-GlcNAc 和UDP-GalNAc 降低,糖分支合成酶水平下降,可能造成未成熟的糖基化修饰结构出现[44]。
3.5 其他因素的影响
溶氧、pH 值、游离氨、渗透压都可以影响抗体糖基化修饰的结构和水平。溶氧可能通过影响糖酵解途径或重链间二硫键的形成造成空间位阻进而影响到糖基化。氨或 pH 值可能通过影响细胞高尔基体内酶活性进而影响抗体糖基化修饰[45]。渗透压常与培养基成分、pH 值等因素联合影响糖基化水平[46]。
细胞培养中众多因素都可以影响糖基化修饰,往往单因素的变化会引起多因素的协同作用,基于数理统计模型的实验设计(DoE)已经用于研究细胞培养参数和原材料的变化对糖型结构的影响[47]。在质量源于设计 QbD 理念下的生产过程更需要对糖基化进行实时监控,通过及时中止或调整异常糖基化的产品生产将可以使生物类似药等产品的工艺开发时间大大缩短,目前这类实时分析技术正在开发过程中。
4 糖基化的检测技术
蛋白糖基化中的聚糖为非模板合成,结构非常复杂,因此,糖基化结构表征难度远超核酸和氨基酸序列表征,一般需要综合生物活性方法和理化分析方法,并借助质谱等现代分析仪器进行片段分析和鉴定。生物活性测定可以通过测定受体和靶蛋白的结合或测定受体/靶蛋白结合后的生物效应实现。如采用表面等离子体共振法测定抗体与其靶抗原的结合、各种 Fc 受体亚型的结合,基于作用机制开发的细胞内报告基因活性分析方法,细胞毒性测定方法,测定 ADCC 或 CDC 效应等。生物活性方法虽然灵敏度低于理化分析的仪器检测方法,但对于动物和人体试验有较大的参考价值。
理化分析方法采用色谱、电泳、质谱等分析设备,一般具有比较高的灵敏度。根据测试样品分子量大小一般分三个水平进行,即完整抗体(top)和抗体亚单位(middle-up)、抗体片段(bottom-up)、游离寡糖。完整抗体和亚单位的水平分析中常见的技术包括 RPLC-MS、CE/CIEF、MS(MALDI 或 ESI)、凝集素糖蛋白识别芯片等,一般均具有快速、方便、重现性好等优点,并不能提供糖基化修饰结构的精细信息,主要用于糖型结构的比较分析。抗体片段水平的分析通常用胰酶等蛋白酶对抗体进行酶解,产生分子量为 0.5 ~ 5 kD 的小肽,采用色谱或电泳分离后再进行 MALDI-MS 或 ESI-MS 分析,可以提供氨基酸序列、糖基化结构和位点、微小的化学和酶修饰等信息。游离寡糖的分析通常采用酶法或化学试剂法使寡糖从完整蛋白中游离出来后,借助色谱-光谱(质谱)技术,可以对寡糖进行定性和定量分析。
近年来,随着新材料和检测设备的开发,生物制品领域一些先进的分析技术逐渐涌现出来。亲水作用色谱(HILIC)采用大孔径、2 μm 以下的固定相使游离聚糖、糖肽和完整糖蛋白良好分离成为可能,再联合质谱的 HILIC-MS 技术可以获得不同糖型结构的定量信息,以便快速比较生物类似药与原研药的糖基化差异[48]。二维(2D)色谱技术选用 IEX、HILIC、RPLC、SEC、HIC 中两种不同分离原理技术进行偶联,垂直方向上互补的分离技术结合在一起更易于鉴定一些未知的蛋白变异体。离子迁移色谱质谱(IM-MS)技术根据离子形状与电荷比实现分离,可以分离质量相同而形状不同的离子,其与质谱技术联用可为研究者提供更加丰富的结构信息,IM-MS 技术已经证明在糖基化修饰结构、位点,尤其是同分异构体的糖基化结构鉴定中发挥了重要作用[49],是一种极具前景的分离检测技术。这些分析技术的出现将大大提高对抗体糖基化的认知能力,使抗体药物的质量研究不断完善。
5 结语
抗体的糖基化是一种复杂的翻译后修饰,对单抗药物的疗效、稳定性、免疫原性、药代动力学性质等具有重要影响。一般情况下公认的糖基化修饰如核心岩藻糖、唾液酸、高甘露糖水平等均被认为是产品的关键质量属性(CQA)。研发单位应该在开发过程中对糖基化修饰的可能影响进行文献调研,并结合动物或人体试验选择产品的最优糖型。生物类似药的研发单位应对参照药的糖基化修饰进行深入分析,从理化分析、生物活性、动物及临床试验分层次对糖基化“相似性”进行评估。FDA 生物类似药相关指导原则中关于糖基化的质量相似性评价一般得出“不够相似(insufficient analytical similarity)、未确定性相似(analytical similarity with residual uncertainty)、实验性相似(tentative analytical similarity)、指纹相似(fingerprint-like analytical similarity)”4 个结论,建议质量研究(包括理化分析、生物活性等)存在的不确定性,可以通过药代动力学、药效学研究进一步评价,以此来确定理化分析后糖型相关参数的相似性可接受范围[50]。本文综述了抗体糖基化修饰结构、功能、工艺和质量控制方面的进展以及相关法规方面的思考,希望能为开发治疗性单克隆抗体药物及其他糖蛋白类生物仿制药提供参考。
[1] Grilo AL. The increasingly human and profitable monoclonal antibody market. Trends Biotechnol, 2019, 37(1):9-16.
[2] Hossler P, Khattak SF, Li ZJ. Optimal and consistent protein glycosylation in mammalian cell culture. Glycobiology, 2009, 19(9): 936-949.
[3] Rathore AS, Weiskopf A, Reason AJ. Defining critical quality attributes for monoclonal antibody therapeutic products. Biopharm Int, 2014, 27(7):34-43.
[4] Abel CA, Spiegelberg HL, Grey HM. The carbohydrate contents of fragments and polypep tide chains of human gamma-G-myeloma proteins of different heavy-chain subclasses. Biochemistry, 1968, 7(4): 1271-1278.
[5] Masuda K, Yamaguchi Y, Kato K, et al. Pairing of oligosaccharides in the Fc region of immunoglobulin G. FEBS Lett, 2000,473(3):349-357.
[6] Zheng K, Bantog C, Bayer R. The impact of glycosylation on monoclonal antibody conformation and stability. MAbs, 2011, 3(6): 568-576.
[7] Krapp S, Mimura Y, Jefferis R, et al. Structural analysis of human IgG-Fc glycoforms reveals a correlation between glycosylation and structural integrity. J Mol Biol, 2003, 325(5):979-989.
[8] Barb AW, Prestegard JH. NMR analysis demonstrates immunoglobulin G Nglycans are accessible and dynamic. Nat Chem Biol, 2011, 7(3):147-153.
[9] Jefferis R. Isotype and glycoform selection for antibody therapeutics. Arch Biochem Biophys, 2012, 526(2):159-166.
[10] Abès R, Teillaud JL. Impact of glycosylation on effector functions of therapeutic IgG. Pharmaceuticals (Basel), 2010, 3(1):146-157.
[11] Shields RL, Lai J, Keck R, et al. Lack of fucose on human IgG1 NLinked oligosaccharide improves binding to human FccRIII and antibody-dependent cellular toxicity. J Biol Chem, 2002, 277(30): 26733-26740.
[12] Imai-Nishiya H, Mori K, Inoue M, et al. Double knockdown of a1,6-fucosyltransferase (FUT8) and GDP-mannose 4,6-dehydratase (GMD) in antibodyproducing cells: a new strategy for generating fully nonfucosylated therapeutic antibodies with enhanced ADCC. BMC Biotechnol, 2007, 7:84.
[13] Hodoniczky J, Zheng YZ, James DC. Control of recombinant monoclonal antibody effector functions by Fc N-Glycan remodeling in vitro. Biotechnol Prog, 2005, 21(6):1644-1652.
[14] Boyd PN, Lines AC, Patel AK. The effect of the removal of sialic acid, galactose and total carbohydrate on the functional activity of Campath-1H. Mol Immunol, 1995, 32(17-18):1311-1318.
[15] Houde D, Peng Y, Berkowitz SA, et al. Post-translational modifications differentially affect IgG1 conformation and receptor binding. Mol Cell Proteom, 2010, 9(8):1716-1728.
[16] Tangvoranuntakul P, Gagneux P, Diaz S, et al. Human uptake and incorporation of an immunogenic nonhuman dietary sialic acid. Proc Natl Acad Sci U S A, 2003, 100(21):12045-12050.
[17] Scallon BJ, Tam SH, McCarthy SG, et al. Higher levels of sialylated Fc glycans in immunoglobulin G molecules can adversely impact functionality. Mol Immunol, 2007, 44(7):1524-1534.
[18] Naso MF, Tam SH, Scallon BJ, et al. Engineering host cell lines to reduce terminal sialylation of secreted antibodies. mAbs, 2010, 2(5): 519-527.
[19] Flesher AR, Marzowski J, Wang WC, et al. Fluorophore-labeled carbohydrate analysis of immunoglobulin fusion proteins: Correlation of oligosaccharide content with in vivo clearance profile. Biotechnol Bioeng, 1995, 47(3):405.
[20] Mimura Y, Sondermann P, Ghirlando R, et al. Role of oligosaccharide residues of IgG1-fc in FccRIIb binding. J Biol Chem, 2001, 276(49):45539-45547.
[21] Jones AJS, Papac DI, Chin EH, et al. Selective clearance of glycoforms of a complex glycoprotein pharmaceutical caused by terminal Nacetylglucosamine is similar in humans and cynomolgus monkeys. Glycobiology, 2007, 17(5):529-540.
[22] Umaña P, Jean-Mairet J, Moudry R, et al. Engineered glycoforms of an antineuroblastoma IgG1 with optimized antibody-dependent cellular cytotoxic activity. Nat Biotech, 1999, 17(2):176-180.
[23] Ferrara C, Brünker P, Suter T, et al. Modulation of therapeutic antibody effector functions by glycosylation engineering: Influence of Golgi enzyme localization domain and co-expression of heterologous β1, 4-N-acetylglucosaminyltransferase III and Golgi α-mannosidase II. Biotechnol Bioeng, 2006, 93(5):851-861.
[24] Kanda Y, Yamada T, Mori K, et al. Comparison of biological activity among nonfucosylated therapeutic IgG1 antibodies with three different N-linked Fc oligosaccharides: the high-mannose, hybrid, and complex types. Glycobiology, 2007, 17(1):104-118.
[25] Zhou Q, Shankara S, Roy A, et al. Development of a simple and rapid method for producing non-fucosylated oligomannose containing antibodies with increased effector function. Biotechnol Bioeng, 2008, 99(3):652-665.
[26] Goetze AM, Liu YD, Zhang Z, et al. High-mannose glycans on the Fc region of therapeutic IgG antibodies increase serum clearance in humans. Glycobiology, 2011, 21(7):949-959.
[27] Durocher Y, Butler M. Expression systems for therapeutic glycoprotein production. Curr Opin Biotechnol, 2009, 20(6):700-707.
[28] Lam JS, Mansour MK, Specht CA, et al. A model vaccine exploiting fungal mannosylation to increase antigen immunogenicity. J Immunol, 2005, 175(11):7496-7503.
[29] Kim JY, Kim YG, Lee GM. CHO cells in biotechnology for production of recombinant proteins: current state and further potential. Appl Microbiol Biotechnol, 2012, 93(3):917-930.
[30] Raju TS. Terminal sugars of Fc glycans influence antibody effector functions of IgGs. Curr Opin Immunol, 2008, 20(4):471-478.
[31] Padler-Karavani V, Yu H, Cao H, et al. Diversity in specificity, abundance, and composition of anti-Neu5Gc antibodies in normal humans: potential implications for disease. Glycobiology, 2008, 18(10):818-830.
[32] Beck A, Wagner-Rousset E, Bussat MC, et al. Trends in glycosylation, glycoanalysis and glycoengineering of therapeutic antibodies and Fc-fusion proteins. Curr Pharm Biotechnol, 2008, 9(6):482-501.
[33] Goldman MH, James DC, Rendall M, et al. Monitoring recombinant human interferon-gamma N-glycosylation during perfused fluidized-bed and stirred-tank batch culture of CHO cells. Biotechnol Bioeng, 1998, 60(5):596-607.
[34] Kunkel JP, Jan DCH, Butler M, et al. Comparisons of the glycosylation of a monoclonal antibody produced under nominally identical cell culture conditions in two different bioreactors. Biotechnol Prog, 2000, 16(3):462-470.
[35] Liu B, Spearman M, Doering J, et al. The availability of glucose to CHO cells affects the intracellular lipid-linked oligosaccharide distribution, site occupancy and the N-glycosylation profile of a monoclonal antibody. J Biotechnol, 2014, 170:17-27.
[36] Gawlitzek M, Ryll T, Lofgren J, et al. Ammonium alters N-glycan structures of recombinant TNFR-IgG: degradative versus biosynthetic mechanisms. Biotechnol Bioeng, 2000, 68(6):637-646.
[37] Zhang Y, Wang PG, Brew K. Specificity and mechanism of metal ion activation in UDP-galactose:beta -galactoside-alpha -1,3- galactosyltransferase. J Biol Chem, 2001, 276(15):11567-11574.
[38] Surve T, Gadgil M. Manganese increases high mannose glycoform on monoclonal antibody expressed in CHO when glucose is absent or limiting: implications for use of alternate sugars. Biotechnol Prog, 2015, 31(2):460-467.
[39] Hong JKM, Lee S, Kim KY, et al. Effect of sodium butyrate on the assembly, charge variants, and galactosylation of antibody produced in recombinant Chinese hamster ovary cells. Appl Microbiol Biotechnol, 2014, 98(12):5417-5425.
[40] Wong NSC, Wati L, Nissom PM, et al. An investigation of intracellular glycosylation activities in CHO cells: effects of nucleotide sugar precursor feeding. Biotechnol Bioeng, 2010, 107(2): 321-336.
[41] St Amand MM, Radhakrishnan D, Robinson AS, et al. Identification of manipulated variables for a glycosylation control strategy. Biotechnol Bioeng, 2014, 111(10):1957-1970.
[42] Shi M, Xie Z, Yu M, et al. Controlled growth of Chinese hamster ovary cells and high expression of antibody-IL-2 fusion proteins by temperature manipulation. Biotechnol Lett, 2005, 27(23-24):1879- 1884.
[43] Fox SR, Tan HK, Tan MC, et al. A detailed understanding of the enhanced hypothermic productivity of interferon-gamma by Chinese-hamster ovary cells. Biotechnol Appl Biochem, 2005, 41(Pt3):255-264.
[44] Sou SN, Sellick C, Lee K, et al. How does mild hypothermia affect monoclonal antibody glycosylation? Biotechnol Bioeng, 2015, 112(6):1165-1176.
[45] Chen P, Harcum SW. Effects of elevated ammonium on glycosylation gene expression in CHO cells. Metabolic Eng, 2006, 8(2):123-132.
[46] Ivarsson M, Villiger TK, Morbidelli M, et al. Evaluating the impact of cell culture process parameters on monoclonal antibody N-glycosylation. J Biotechnol, 2014, 188:88-96.
[47] Grainger RK, James DC. CHO cell line specific prediction and control of recombinant monoclonal antibody N-glycosylation. Biotechnol Bioeng, 2013, 110(11):2970-2983.
[48] D'Atri V, Fekete S, Beck A, et al. Hydrophilic interaction chromatography hyphenated with mass spectrometry: a powerful analytical tool for the comparison of originator and biosimilar therapeutic monoclonal antibodies at the middle-up level of analysis. Anal Chem, 2017, 89(3):2086-2092.
[49] Hinneburg H, Hofmann J, Struwe WB, et al. Distinguishing N-acetylneuraminic acid linkage isomers on glycopeptides by ion mobility-mass spectrometry. Chem Commun (Camb), 2016, 52(23): 4381-4384.
[50] Center for Drug Evaluation and Research of U.S. Food and Drug Administration, Center for Biologics Evaluation and Research of U.S. Food and Drug Administration. Clinical pharmacology data to support a demonstration of biosimilarity to a reference product. 2016. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/clinical-pharmacology-data-support-demonstration-biosimilarity-reference-product.
·协会之窗·
2020 年 7 月 11 日,由中国医药生物技术协会、中国医药企业管理协会支持指导,苏州市相城区人民政府主办,苏州市相城区黄埭镇人民政府、苏州市相城区发展和改革委员会、苏州市相城区卫生健康委员会、E 药经理人、中国医疗健康产业投资 50 人论坛承办的“2020 中国抗病毒药物创新大会”在苏州举行。中国工程院院士樊代明、张伯礼、李校堃,中国疾病预防控制中心流行病学首席科学家曾光等专家学者出席会议,并以线上线下相结合的方式发表主题演讲。超过 200 位来自医疗健康领域的科学家、企业家、投资人参加了本次会议。
会议伊始,由中国工程院院士、中国医药生物技术协会副理事长、温州医科大学校长兼病毒研究院院长李校堃,中国医药企业管理协会名誉会长郭云沛,中国医药生物技术协会副理事长、信达生物制药集团董事长兼总裁俞德超致辞。郭云沛在致辞中指出,在此次疫情之下,对抗病毒药物(疫苗)研发和创新得到更加广泛的关注,全球研发创新机构只有通过协同创新,才能为人类健康做出更大的贡献。俞德超在致辞中表示,药物创新不仅要有研发投入、人才队伍支撑,更关键的是要通过此次疫情,使我国的医药卫生体制机制得到根本性的完善。
在全球疫情还未得到有效控制的当下,曾光教授围绕“全球新冠疫情研判与下一步中国防疫策略”这一主题,分析了全球疫情发展的趋势走向,同时也为中国下一阶段防疫提出了建设性策略。樊代明院士与张伯礼院士则从抗疫后的医学发展和中医药抗疫的优势与特点与现场观众进行了交流。清华大学交叉医学院国际生物经济中心主任、科技部中国生物技术发展中心原主任王宏广则从顶层设计角度就如何为疫情防控提供制度支撑、科技支撑进行了主题发言。
此外,本次大会特设“抗病毒药物(疫苗)研究进展发布”环节,来自江苏省疾控中心、山东大学、上海医药、康希诺生物等 8 家研究机构、医药企业分别披露了各自在抗新冠病毒药物和疫苗的研发进展情况。
会议最后,以“完善国家平战结合的抗疫药物(疫苗)科研攻关和供应保障体系,如何更好发挥企业作用”、“面对病毒大流行,产、学、研、资如何打破藩篱,实现有效的共享合作”为主题举行了两场圆桌讨论,13 位来自政府、学界、产业界、投资界的代表参与讨论。
10.3969/j.issn.1673-713X.2020.04.015
罗建辉,Email:luojh@ cde.org.cn
2020-03-07
