病毒灭活技术及产业发展报告
2020-08-14杨春晖容新宗
杨春晖,容新宗
·行业发展报告·
病毒灭活技术及产业发展报告
杨春晖,容新宗
610052 成都,中国医学科学院北京协和医学院输血研究所
1 国际病毒灭活技术及产业发展现状
1.1 产业规模和产值
生物制品的原材料主要来源于血液及哺乳动物细胞培养产物。由于其具有病原体传播的风险,因此在生产过程中需要应用病毒灭活工艺来保障生物安全。不同的制品因工艺的差异也决定了病毒灭活策略的选择。
血液是一种不可替代的重要的治疗资源。血液的采集方式分为成分血和单采血浆。成分血一般由各国的血液中心采集全血后分离,直接输注给患者。而单采血浆则是单采浆站利用单采技术从人体内收集的血浆,用以制备血浆衍生的医疗产品。
根据世界卫生组织(WHO)的数据[1],全球每年共采血 1.1 亿次,其中血液中心采集约 1 亿次,单采血浆 1190 万次。在 173 个国家中,仅有 50 个国家制备和生产血浆衍生的医疗产品。2020 年,全球血液市场的规模达到了 72.01 亿美元,预计到 2027 年将达到 102.53 亿美元,2020 – 2027 年的年复合增长率为 4.5%。
与我国不同的是,欧美等国家制备血液制品的原料血浆不仅来源于单采血浆,也可来源于回收血浆,即从全血提取血细胞后剩余的血浆。目前成分血的制备,世界多个国家虽然已采用了病毒灭活技术,但大部分国家并未进行强制的规定。而血液制品的生产,均规定了在生产过程中必须应用病毒灭活工艺。
除血液外,在药物合成过程中,来源于人或哺乳动物的原材料中的内源性病毒和其他在生产过程中引入的外来病毒对生物制品的污染是一个主要问题。这些制品包括单克隆抗体、细胞因子、生长因子、干扰素、基因重组蛋白及疫苗等。
随着生物技术的进步,生物药品已改变了之前传统的临床治疗方式,一些之前无法治疗的疾病如慢性病、自身免疫性疾病和肿瘤等在生物药品的支持下,已获得了较好的疗效。这些因素积极地推动了生物制药市场的发展。2017 年全球生物制品行业(含血液制品)市场规模为 2549 亿美元,每年增长率为 10% 左右[2]。在生物制品领域,根据美国药监局(FDA)、欧洲药监局(EMA)和国际人用药品技术要求协调委员会(ICH Q5A)的指导原则,病毒灭活也是不可缺少的要求,且在药品研发过程,需要完成多次验证。
1.2 主要企业及市场份额
1.2.1 光化学病毒灭活技术 利用某些化学光敏剂能与病原微生物的核酸或蛋白结合,在适当波长光照射下,发生系列光化学及光生物学效应导致病原体失活的方法,多用于成分血病毒灭活。各国应用光化学灭活技术的情况见表 1。
美国 Cerus 公司研发的病毒灭活系统为 INTERCEPT Blood System,分为 INTERCEPT Blood System-platelet,INTERCEPT Blood System-plasma 和 INTERCEPT Blood System-red blood cell,该系统以光化学病毒灭活技术为基础,其灭活原理是利用补骨脂复合物和 UVA 光照破坏病原体的复制,对多种病毒、细菌及寄生虫都可进行有效灭活。目前该产品已应用于单人份血浆和血小板的灭活,在美国、瑞士、比利时、冰岛、澳大利亚、科威特、斯洛文尼亚和法国等国家每年售出超过 500 万套耗材。产品在红细胞中的应用也已进行了临床 III 期试验,并已在欧洲提交了 CE 认证申请。随着 INTERCEPT 系统越来越广泛的应用,Cerus 公司的产品收入呈现持续增长的趋势,2014 – 2018 年,5 年间从 3641.6 万美元增长到了 6090.8 万美元[3]。
日本 Terumo BCT 公司生产的病毒灭活系统为 Mirasol pathogen reduction system,其原理与 INTERCEPT 类似,是采用核黄素结合 UV 光照射灭活病原体。可用于灭活单人份血浆和血小板。该产品从2009 年开始投入应用,目前已售往欧洲、中东、拉美、亚太地区的 20 多个国家。配套的耗材已售出超过 75 万套[4]。
法国 Macopharma 公司生产的两种病毒灭活产品分别是 THERAFLEX MB-plasma 和 THERAFLEX UV-Platelets,分别用于血浆和血小板的灭活。THERAFLEX MB-plasma 是利用亚甲蓝(methylene blue,MB)结合可见光照射灭活病原体,1992 年开始应用于临床,至今已在美国、欧洲、中东、澳大利亚、东南亚等 10 多个国家和地区使用,产品售出超过 550 万套。THERAFLEX UV-Platelets 是使用 254 nm 的 UVC 光照结合血袋振荡对血小板中的病原体进行灭活,目前在欧洲已获得了 CE 认证,在美国还在进行临床 III 期试验。
1.2.2 有机溶剂/清洁剂病毒灭活技术 有机溶剂/清洁剂(solvent/detergent,S/D)病毒灭活技术利用有机溶剂和清洁剂的混合物破坏病毒的脂包膜,可灭活有包膜的病毒,但对无包膜病毒没有作用。可用于血浆、血液制品和生物制品。S/D 血浆的应用见表 1[5]。
瑞士 Octapharma 是一家致力于研发、生产和销售高品质血浆蛋白制品的私营公司,拥有全球最大的独立血浆分馏器,产品销售覆盖全球 118 个国家和地区。公司在血浆收集设施上进行大量投资,除了在欧洲和美国拥有 120 个血浆中心外,还在奥地利、法国、德国、墨西哥和瑞典拥有7 处研发设施和 6 处制造设施。该公司创新采用的 S/D 病毒灭活工艺成为血液制品行业的金标准。其生产的病毒灭活血浆从 1992 年开始投入市场,经过不断的工艺改良,目前最新的产品为 2009 年注册的 Uniplas®/UniplasLG®。目前工厂每批次汇集 600 ~ 1500 人份的单采血浆,经过 24 h 的生产流程,产出 3600 袋病毒灭活血浆。一周可生产 4 ~5 个批次,售往欧洲、美国和澳大利亚等多个国家和地区[6]。
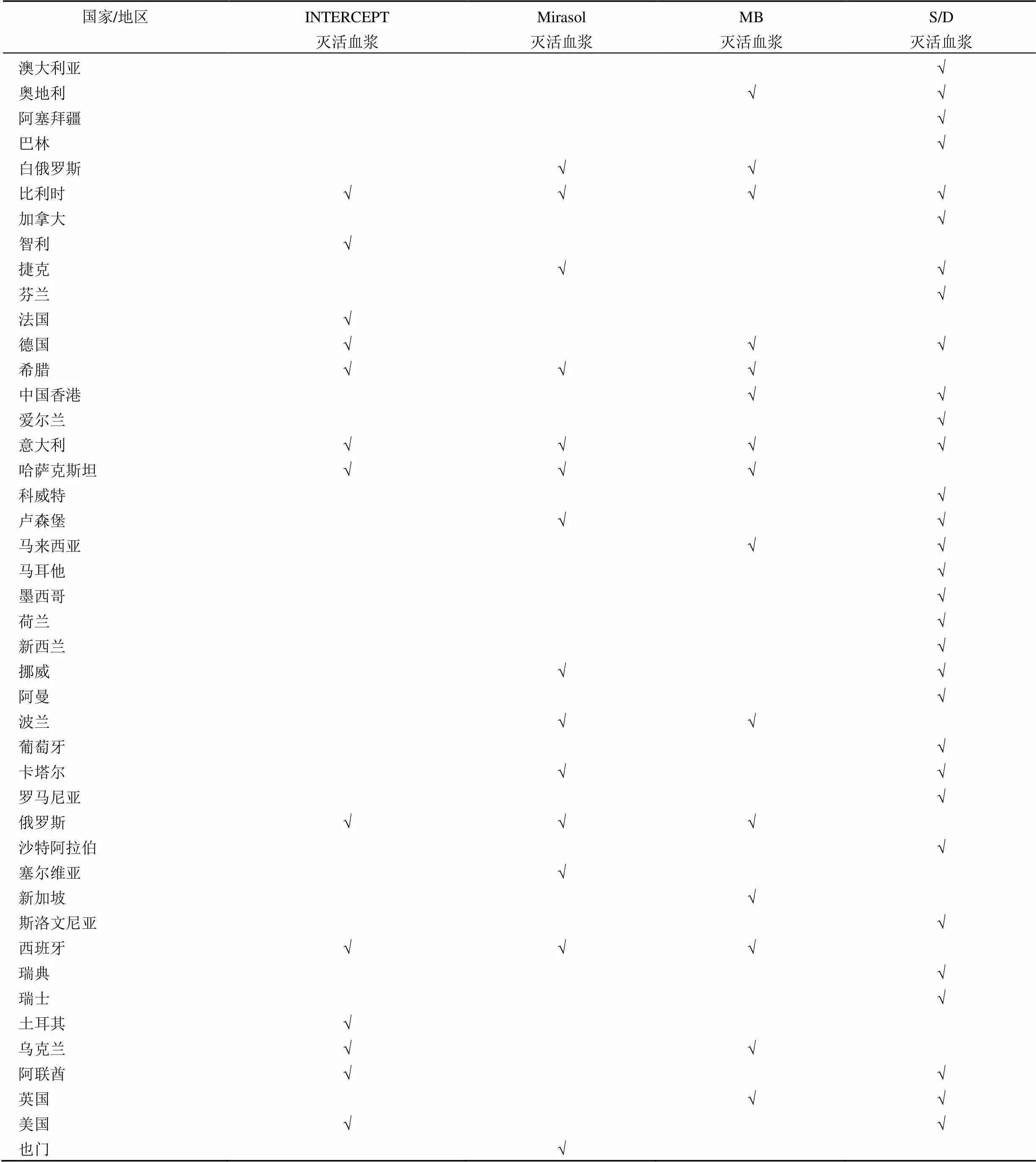
表1 各国(地区)灭活血浆应用情况[5]
注:√代表已应用
此外,Octapharma 公司还将 S/D 工艺授权给南非 Pinetown 的国家生物产品研究所及意大利 Kedrion 公司,生产了 Bioplasma FDP®和 Plasmasafe®品牌的 S/D 灭活血浆。
除了 S/D 灭活血浆外,Octapharma 公司还生产多种经过病毒灭活的血液制品,已上市产品包括重组凝血因子 VIII、凝血因子 VIII、凝血因子 IX、血管性血友病因子、静注免疫球蛋白、皮下注射免疫球蛋白、抗 D 免疫球蛋白、人血白蛋白、凝血酶原复合物、抗凝血酶 III、纤维蛋白原等 14 种。灭活的方法包括 S/D、纳滤及加热等。
根据公司年报,2019 年 Octapharma 公司年全球销售收入 22.14 亿欧元,较 2018 年增加 4.17 亿欧元(23.2%)。
1.2.3 纳滤除病毒 纳滤是一种通过孔径大小过滤来滤除病毒的技术,多用于血液制品和生物制品的病毒去除。2018 年全球病毒滤除的市场规模为 27 亿美元。病毒滤除是生物制品净化过程中最常用的技术之一,其目的是达到有效的净化效果,保证生物制品的安全。得益于生物治疗产品如单克隆抗体、干细胞产品、血液成分、生物制剂和疫苗不断增长的需求,未来几年全球病毒过滤市场预计呈现增长的趋势。目前市场上在售的纳滤产品见表 2[7]。
日本 Asahi Kasei 是一家涵盖了材料、住宅和医疗领域的综合化工厂家。其医疗领域的除病毒滤器可应用于血液制品、单克隆抗体、重组蛋白产品及培养基生产过程中的病毒去除。Asahi Kasei 公司从 1989 年开始生产 Planova 除病毒滤器,是全球首个生产除病毒滤器的厂家。目前已研发出 15N、20N、35N、75N 及 BioEX 等不同孔径大小的除病毒滤器,适用于不同性状的蛋白产品。随着除病毒滤器需求的增加,2019 年该公司病毒滤器的销售额增长了 40%[8]。
美国 Pall 公司是一家专注于过滤、分离与纯化的公司,业务领域涉及了生物医药、工业、食品和航天等。2015 年被美国 Danaher 公司收购。主要生产多种除病毒滤器、层析柱等,也有低 pH 灭活系统产品,可应用于血液制品、生物药品及疫苗。近年来,销售呈增长趋势,2010 年,Pall 公司生物制药领域的销售收入达到 6.2 亿美元,2014 年,则达到了 9.92 亿美元,客户主要在欧美和亚洲地区[9]。
德国 Sartorius 公司生物医药部门专业生产过滤、发酵、细胞培养、一次性袋、一次性容器等产品。其病毒滤除产品包括用于单克隆抗体除病毒的Virosart®HF,用于血液制品的 Virosart®HC以及病毒灭活前处理的Virosart®MAX。此外,公司也生产低 pH 病毒灭活产品和层析产品,同时提供病毒灭活效果验证的服务。2019 年,该公司生物工艺部分的销售收入达到13.7 亿欧元[10]。
德国 Merck 公司是一家综合的生物制药公司,病毒滤除属于其生命科学部门中的生物工艺条件类。此外,公司还生产 S/D 灭活试剂、低 pH 灭活试剂和除病毒层析柱等产品,这部分业务 2019 年销售额达到了 3000 万欧元,比2008 年增长了 15.1%[11]。
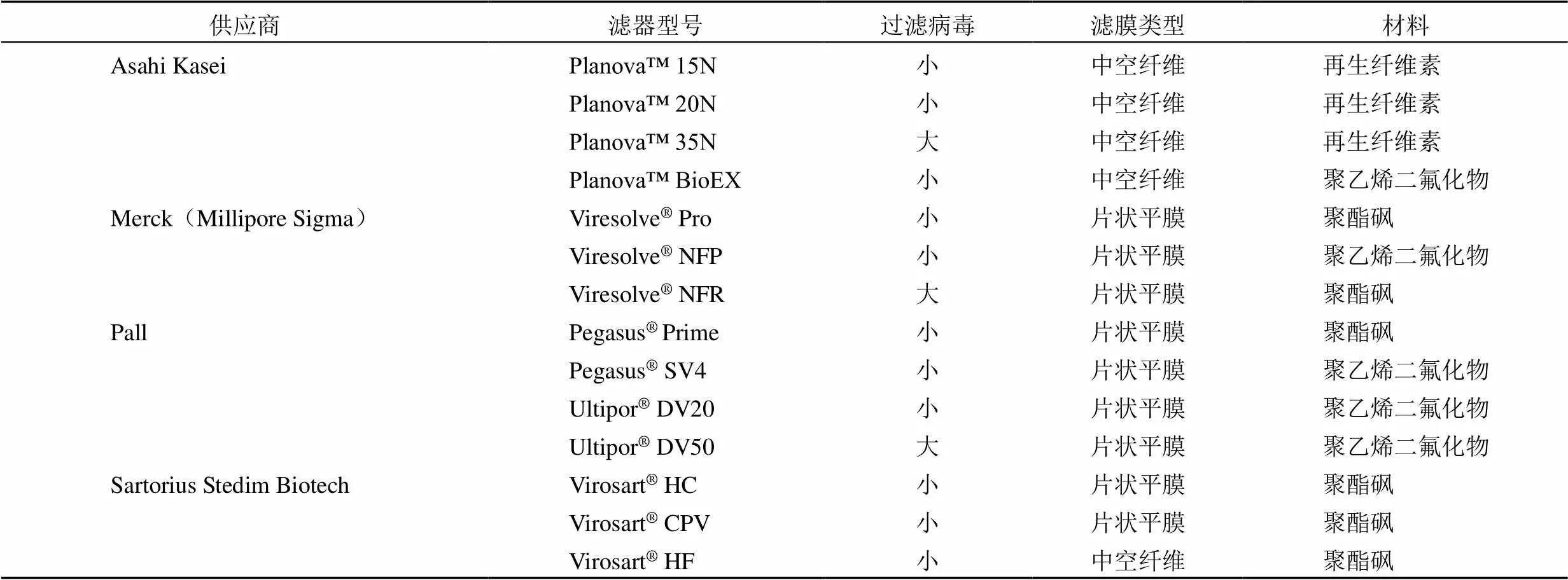
表2 主要纳滤产品供应商及商品[7]
1.3 病毒灭活验证服务
由于病毒灭活的有效性关系到生物产品的安全及各种灭活工艺技术的复杂性,因此对其监管也非常严格。各国针对生物制品病毒灭活工艺都做出了相应的规定。欧洲和美国药监局都出台了对病毒灭活效果验证的指导原则,其中国际人用药品注册技术协调会于 1999 年发布的《Viral Safety Evaluation of Biotechnology Products Derived from Cell Lines of Human or Animal Origin》是国际通用的病毒灭活验证指导原则。
病毒灭活效果验证需要进行病毒的培养及滴度检测,因此对实验室安全级别要求很高,大部分生物制品企业都选择第三方服务公司进行验证。根据市场分析报告,2020 年,全球病毒清除服务市场规模为2.175亿美元,预计到 2026 年底将达到2.443 亿美元,2021 – 2026 年的年复合增长率预计为11.4%[12]。
从事病毒灭活验证服务的公司包括 Charles River、BioReliance(Merck)、Eurofins Scientific、Sartorius、Covance、ViruSure、Texcell、Bioscience Labs、Vironova Biosafety、Mérieux NutriSciences、WuXi AppTec、Syngene、Labor Dr. Merkare 等,其中前三位的公司占据了整个市场份额的 39.43%,其余公司呈碎片化分布。
1.4 产业发展趋势
全球病毒灭活产业的主要驱动力是制药和生物技术行业的需求不断增加。各个领域新药物推出数量的增加以及相关的药物审批增加也在推动市场增长。目前,美国是全球生物制品领头者,拥有最多的生物制药公司,生物技术的研发占据世界的 80%。而亚太地区增长速度最快,有望超过欧洲占据全球第二的位置。
随着行业的发展,进入生物制品行业的企业不断增加,激烈的竞争使生物制药公司必须降低生产成本,提高效率。越来越多的生物制药企业已转向连续生物生产工艺。生物制药目前都是以批次生产的方式,即从工艺起点开始,经过多个有停顿的中间步骤,最终获得终产品。连续生产工艺即连续生产,理论上中间没有停留。与之相适应,病毒灭活技术也向在线持续的工艺转变。很多公司都开发了可整合至连续生产工艺中的病毒灭活产品或定制整体的病毒灭活系统。产品趋向一次性和整体性。如 Pall 公司的Cadence™ 低 pH 病毒灭活系统[13]、Sartorius 的FlexAct®低 pH 病毒灭活系统[14]和 Merck 的Mobius®整体病毒灭活方案[11]等。
在血液成分领域,还缺乏适用于红细胞和全血的病毒灭活技术。目前,INTERCEPT-red blood cells 和Mirasol 应用于红细胞和全血的临床试验还在进行中,如果获得批准,将填补这一领域的空白。
除了工艺的进步外,新发病原体也是病毒灭活领域需要关注的部分。生物来源材料的多样性,新的生产工艺的引入以及全球化(包括国际旅行、原材料供应链及商业)使得病毒灭活工艺需要适应多变的状态。对原材料进行灭活处理可从源头上降低病毒传播的风险。
2 国内病毒去除/灭活验证行业发展研究
2.1 生物制品病毒污染事件回顾
2.1.1 血液制品病毒污染事件 病毒污染是威胁治疗用生物制品用药安全的重要风险之一,尤其是对于血浆来源的血液制品。20 世纪 80 ~ 90 年代,世界各地有许多患者由于使用了被病毒污染的血液或血液制品而感染了各种血源性病毒,部分事件见表 3。
这些血液制品病毒污染恶性事件造成严重后果的同时,也促成了血液制品病毒安全保障的提升,旨在提高血液安全的各种政策法规陆续颁布出台,多种病毒灭活与去除技术被引入血液制品制造过程。正如欧洲血液制品指南中所描述:20 世纪 80 年代中期血液制品特别是凝血因子类产品导致的 HIV 和 HCV 感染事件,使血液制品生产工艺流程发生重要变化,生产工艺中必须引入特定步骤针对 HIV 和 HCV 以及其他血源病毒进行病毒灭活或病毒去除。
2.1.2 治疗用生物制品病毒污染事件 迄今为止,血液制品以外的治疗用生物制品所造成的患者感染病毒恶性事件尚无报道,但工程细胞表达的治疗用生物制品在制造过程中被病毒污染的案例并非罕见,部分病毒污染事件整理参见表 4。

表 3 20 世纪 80 ~ 90 年代国外部分血液制品污染事件统计表
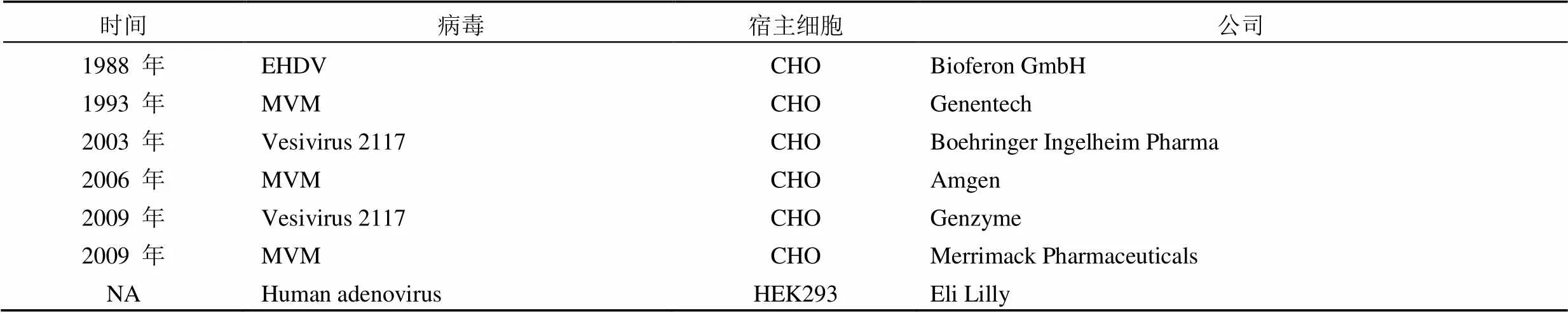
表 4 治疗用生物制品的病毒污染事件
在病毒污染事件中,有的在培养阶段检测到病毒污染,培养液和中间体因此被废弃而没有发生最终产品受到污染的现象。2009 年,Genzyme 公司发生 Vesivirus 2117 污染培养基,导致了 17.5 亿美元的罚款,10 亿 ~ 30 亿美元的产品销售额损失。为降低培养过程中的病毒污染风险,越来越多的制药企业开始对培养基采取伽马辐射处理、UV-C 辐射处理、短时间高温处理或病毒过滤处理。
工程细胞表达生产的治疗用生物制品在表达体系构建和生产制造过程中可能会使用动物来源或是含有动物来源成分的物料,例如牛血清和胰蛋白酶等,也可能会使用被病毒污染的物料,如被病毒污染的化学成分培养基。此外,用于表达生产治疗用生物制品的工程细胞较大比例是动、植物细胞或使用了病毒载体,表达系本身存在病毒安全风险。例如,中国仓鼠卵巢细胞(CHO)是表达生产抗体的主要宿主细胞之一,它本身会表达内源性逆转录病毒样颗粒,在细胞培养上清中常可以检测到 103~ 109/ml 逆转录病毒样颗粒。这些颗粒的形态、生化性质和基因序列与传染性逆转录病毒相似。因此,对于工程细胞表达生产的治疗用生物制品,必须对生产工艺中清除感染性病毒的能力进行评估,确保产品未受感染性病毒的污染。
2.2 国内外病毒去除/灭活验证相关法规
2.2.1 国外病毒去除/灭活验证相关法规 不同的国家和地区对于生物制药或生物制品的病毒安全性均有较为严格且成熟的法规监管体系(表 5)。
在业内,相对较早且较为系统化的描述生物制品的病毒安全性的要求是 ICH Q5A(R1)《来源于人或动物细胞系的生物技术产品的病毒安全性评价》(Viral Safety Evaluation of Biotechnology Products Derived from Cell Lines of Human or Animal Origin)。该指南发布于 1999 年,着重讨论人类或动物细胞经生物工程技术培养而获得的生物制品的病毒安全检测和评价,此外其技术要求也涵盖重组类疫苗和杂交瘤体内培养腹水收获的制品,但不涵盖灭活疫苗、活疫苗和其他基因工程改造所得的活载体等。此指南中所讨论的对象为传统意义上的病毒,并不包括疯牛病病毒、瘙痒病病毒等传染性海绵状脑病朊病毒类。另外,基于生物制品中有很大一部分是由细胞培养产生的,ICH 在 Q5D 中详细阐述了对细胞基质的鉴定和检测相关原则。
在欧盟药监部门及美国药监局的多项单行本的法规文件当中,几乎均会以 Q5A 和 Q5D 作为一份核心的技术及法规性引用来源。除此之外,EMA 和 FDA 还发布了一些更加细化的法规要求。
由 EMA 在 1996 年颁布的指南《病毒验证研究:对病毒灭活及去除的验证研究的设计、功用和解析》(Virus Validation Studies: The Design, Contribution and Interpretation of Studies validating the Inactivation and Removal of Viruses),讨论了病毒验证研究对生物制品病毒安全性的要求和功用,其主要目的是为验证研究的设计提供指导,包括指示病毒的选择以及对随后产生数据的解析,尤其适用于确定可被认为是有效的病毒灭活或去除的工艺步骤。该指南适用于多种类型的生物制品,包括人或动物来源细胞系体外培养产物,来源于人体细胞或动物来源的器官或组织的体内培养产物以及来源于血液、尿液或人类及动物来源的其他生物制品。

表 5 国外病毒安全性相关法规及技术文件
EMA 在 2006 年颁布的《生物技术新型药物产品的病毒安全性评价指南》(Guideline on Virus Safety Evaluation of Biotechnological Investigational Medicinal Products)为有关临床试验中使用的生物技术新型药物产品的病毒安全性提供了科学指导。其描述了生物技术新型药物病毒安全性评估研究的标准和程度,特别是在临床研发之前和期间所需的验证研究;介绍了制药企业应在何种程度上借鉴其有关病毒安全评估的内部经验;并讲解了对于生物技术药物产品安全性评价的风险评估工作。该文件以 ICH Q5A 侧重于生物技术药物产品获批市场准入许可所需的数据要求的思想精髓作为基础,将相关的基本原则应用到了生物技术药物产品在临床开发阶段当中。
EMA 在 2008 年发布的《单克隆抗体及其相关产品的开发、生产、特性鉴定和规范指南》[Guideline on Development, Production, Characterization and Specifications for Monoclonal Antibodies and Related Products (EMA/CHMP/BWP/532517/ 2008)],则以单克隆抗体制品的制备作为其重点研究和监管的内容。该指南涉及单抗类制品在获取市场准入许可的背景下的质量要求,对这类产品的开发、生产、特性鉴定和控制提供了指导。在指南中提出了平台制造工艺的概念,以支持在适当和合理的情况下使用源自经验的数据用以实现相应的生产工艺。该指南不包括关于使用特定分析方法的要求,以便在选择方法时考虑灵活性,并考虑未来的技术演变。
纵观上述涉及 EMA 所颁布的 3 份与生物制品病毒安全性相关的法规指南文件,可以看出 EMA 监管当局对于该领域监管理念及方法与策略的不断完善的历程:即先从控制起始原材料及建立合适的病毒清除工艺入手,随之进入到临床期研究药品制备过程中的病毒安全性控制,然后再进入到获批上市的药物的生产制备环节。依此顺序逐步建立有效控制病毒污染风险的机制及相应的研究方法,从而使得EMA 对于生物制品的病毒安全性控制策略得以健全、完善。
EMA 颁布的指南对已较为标准化的生产平台所制备的单克隆抗体类生物制品提供了相应的指导及要求,这里所提到的标准化生产平台是指大多数单克隆抗体制品均具有比较相似的制备流程,例如采用同样的种子细胞库和工作细胞库、相同或相近的细胞扩培方法、比较相似的下游纯化工艺等。针对市场上较为成熟的单抗制品的制备、法规的监管理念和方法等方面,标准化的生产工艺即意味着有一定的前车之鉴可以被应用到新注册品种、新工艺、新的生产厂房设计等工作中,并有利于各工艺环节的法规监管水平得以有效的更新和发展。因此该指南也对制药企业提出要求,即须有合理的原因及背后所涵盖的基本原理来说明为什么之前的生产工艺数据可以应用于制备新的产品。以病毒清除工艺为例,对于生物制药生产过程中某个特定的病毒灭活/去除的工艺步骤,可由之前生产工艺平台中获取的数据(如产品中间体处于相同的工艺位置、具有类似的生化特性并经历过一致的纯化工艺处理),来说明该病毒灭活/去除步骤的合理性和可行性。
美国 FDA 在 1997 年发布的《人用单克隆抗体制品制备和测试中的考量要点》(简称:单抗考量要点)(Points to Consider in the Manufacture and Testing of Monoclonal Antibody Products for Human Use)对单克隆抗体新药申请以及上市许可申请需要递交的资料信息提出了要求。对于单克隆抗体产品的细胞安全性保障,从细胞库/原材料控制、生产工艺控制、病毒去除/灭活步骤等多方面阐述考量要点。考量要点中还提到模块化病毒清除工艺、模块化验证的概念,对于模块化步骤生产的单抗制品,或可借鉴同类产品的病毒清除研究数据。需要指出具体的“考量点”并非是法规要求,也不是指导原则,但是它们可以代表美国 FDA 生物制品评价和研究中心(CBER)专家们当前的普遍认识。整体上美国 FDA 遵从 ICH Q5A 的要求,并将之收录在美国药典当中(USP General Chapters: <1050> Viral Safety Evaluation of Biotechnology Products Derived from Cell Lines of Human or Animal)。USP1050.1 为 USP1050 的“姊妹”文件,着重于对病毒清除工艺的设计、评估和特性鉴定方面,在试验病毒的选择、工艺清除能力、缩小的纯化模型的建立以及确认、取样时间点的选择、检测方法选择及确认、储存以及冷冻对病毒清除样品的影响、试验用病毒储存液的确认以及对清除工艺的影响、如何执行病毒清除试验方面给出了更为细化、更具有可参考性的指导。
2.2.2 国内病毒去除/灭活验证相关法规 2020 年 6 月 30 日,国家药品监督管理局发布了新版《生物制品注册分类及申报资料要求》,外源因子安全性评价应按照相关技术指南进行外源因子安全性系统分析。目标病毒灭活验证资料在 3.2.S.2.5 工艺验证部分提交。非目标病毒的去除/灭活验证研究在 3.2.A.2 外源因子安全性评价部分提交。
在我国,目前关于生物制品(血液制品、重组 DNA 制品、人用单克隆抗体、细胞治疗产品、预防用以病毒为载体的活疫苗制剂)病毒安全的相关要求分散于相关产品质量控制指导原则和《中华人民共和国药典》等文件之中。
国内病毒安全相关法规(表 6)与国际上保证产品病毒安全性的主要原则是一致的,即基于美国、欧盟和日本的人用药品注册协调大会标准(ICHQ5A)。该指南文件建议用3 种互补的方法来保证病毒安全性。
⑴筛选和检测用于制备产品的原材料,确保所有进入生产的物质,包括生物组织来源动物、生物组织原材料、细胞、细胞培养基和添加成分没有病毒污染;
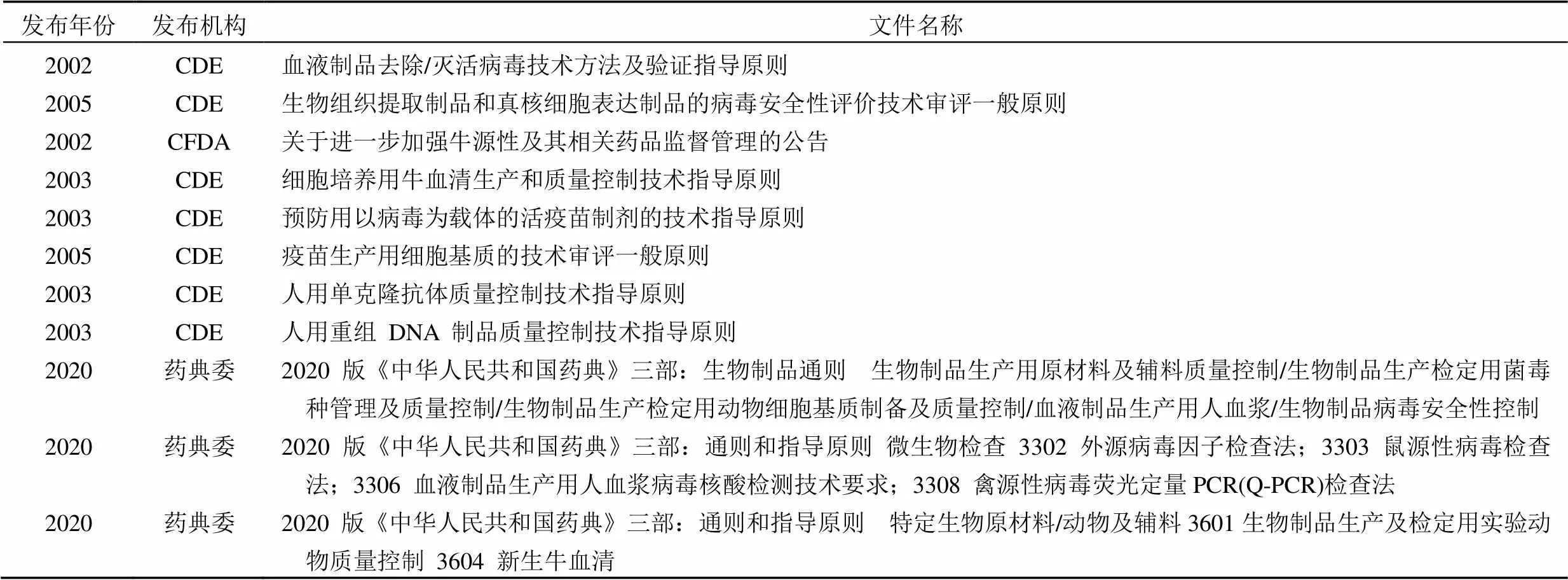
表 6 国内病毒安全评估相关性法规和技术文件
⑵在细胞培养结束时进行病毒检测,保证在细胞培养过程中没有任何病毒污染;
⑶纯化工艺清除病毒验证,证明纯化工艺能清除已知病毒和任何病毒检测未能检出的外源性污染病毒。
对于血液制品,国内企业需参照 2002 年 CDE 发布的《血液制品去除/灭活病毒技术方法及验证指导原则》,该指导原则对血液制品生产过程以及特定的去除/灭活病毒方法验证进行了阐述,包括不同类型血液制品指示病毒和病毒去除/灭活方法的选择、验证方案的设计、结果判定以及技术验证申报的程序。
对于生物技术产品(重组 DNA 制品、人用单克隆抗体、细胞治疗产品等),细胞基质以及部分生产原材料(胰酶、血清)等均存在病毒污染的风险。而且,由于 CHO、SP2/0 等细胞基因组中含有逆转录病毒颗粒,因此,生物制品的病毒安全性工艺验证既要关注细胞基质来源、原材料,还需重点考察纯化工艺中对于病毒的去除/灭活能力。国内目前一般要求生物制品进入临床试验前完成关键工序的病毒清除与灭活验证,申报生产阶段则要结合层析介质的使用寿命完成对整个工艺的病毒灭活及去除验证。国内可参考的主要法规为《生物组织提取制品和真核细胞表达制品的病毒安全性评价技术审评一般原则》。该原则于 2005 年 12 月印发,通过阐明病毒安全性验证研究应包括的基本内容和要求,例如病毒污染的来源和筛查、生物组织原材料、种子库细胞和生产过程中使用的动物性添加材料的病毒检测、病毒检测的具体方法、病毒去除/灭活工艺验证的基本要求等,为特定品种的生产工艺和条件,制定适合的病毒去除/灭活试验研究方案提供参照依据和选择原则。该原则重点突出了对生物组织原材料/种子细胞进行病毒筛查的方法、选择检测的病毒种类、检测要求、病毒去除/灭活验证试验设计应考虑的主要内容,以及在验证研究设计时如何正确选择指示病毒,如何选择病毒去除/灭活的方法,如何总结分析试验资料,如何正确理解验证的试验结果及其代表的意义,如何正确评价病毒安全性检测与感染风险性之间的关系等。
2.3 病毒去除/灭活技术介绍
2.3.1 有机溶剂/去污剂病毒灭活法
2.3.1.1 技术原理 在有机溶剂/去污剂(S/D)病毒灭活法发明以前,人们发现甲肝病毒能通过消化道传播,而乙肝病毒通常不能通过消化道传播,但是胆汁分泌障碍的人群通过消化道传播乙肝病毒的概率较高。科学研究发现,这和胆汁能溶解乙肝病毒的脂包膜有关。根据以上原理,通过研究和临床观察发现,使用吐温 80 或Triton-X 100,也有报道用Triton-X 45[15]这类的非离子型表面活性剂(去污剂)和磷酸三丁酯(有机溶剂)能够有效破坏这类病毒的类脂膜,类脂从病毒表面脱落,使病毒失去黏附和感染细胞的能力来达到灭活病毒的效果,并且对蛋白质分子的结构的影响也非常小。但是这种灭活方法仅对脂包膜病毒有效,对于非脂包膜病毒无任何效果。
2.3.1.2 工艺参数
理论上:1% 吐温 80(或 Triton-X100),0.3% 磷酸三丁酯(TNBP),24 ℃/6 h(或 4 h)。
实际上:1% ± 0.3% 吐温 80(或 Triton-X 100),0.3% ± 0.1% TNBP,(24 ± 1)℃,不少于 6 h(或 4 h)。
血液制品[16]常用病毒灭活条件为 24 ℃下用 0.3% TNBP 加 1% Tween 80 处理至少 6 h,或用 0.3% TNBP 加 1% Triton-X100 处理至少 4 h。
细胞表达工艺的抗体、重组蛋白,在 20 ~ 25 ℃ 0.3% TNBP 加 1% Tween 80 处理≥ 2 h。
S/D 处理前应先用 1 μm 滤器除去蛋白溶液中可能存在的颗粒(颗粒可能藏匿病毒从而影响病毒灭活效果)。加入 S/D 后应确保是均一的混合物。在灭活病毒全过程中应将温度控制在规定的范围内。如果在加入 S/D 后过滤,则须检测过滤后 S/D 的浓度是否发生变化,如有变化应进行适当调整。吐温 80 应采用植物源性,并应采用称量法量取。
2.3.1.3 注意事项 待灭活的制品中可能含有颗粒性物质,将病毒包裹其中,使 S/D 试剂无法接触到病毒,因此需要事先进行 1 μm(或更高的精度)的过滤以避免这种风险;加入 S/D 后制品应充分混匀,如果加入 S/D 后再行过滤,应确保过滤后 S/D 浓度仍在有效范围内;S/D 试剂能够与混合容器内每一滴制品接触(特别是罐壁、灌顶上附着的制品可能在灭活工艺结束后又滴入罐内),因此通常是将加入 S/D 后的制品混合均匀后,泵入另外的容器内恒温,执行灭活程序;病毒灭活间与后面的生产工序间分开,以免造成交叉污染。通常病毒灭活间应有独立的设备和空气供应系统。
2.3.2 低 pH 孵放技术
2.3.2.1 技术原理 低 pH 孵放法是重组蛋白药物纯化工艺中常用的关键步骤,其操作过程简单、病毒灭活效果好,但低 pH 环境容易使很多重组蛋白不稳定,产生聚体、降解等质量问题。相比较而言,抗体类免疫球蛋白在低 pH 环境普遍表现更加稳定,成为工艺中常用步骤。其利用有脂包膜类病毒的囊膜和病毒衣壳蛋白在低 pH 条件下会逐渐变性而使病毒颗粒失去感染能力,从而达到病毒灭活效果。本方法对于无脂包膜类病毒作用微弱,但在工艺中的低 pH(如 pH 4)处理(有时加胃酶)能灭活几种脂包膜病毒。除此之外,病毒灭活效果还可能受 pH 值、孵放时间和温度、胃酶含量、蛋白质浓度、溶质含量等因素影响,验证试验应该研究这些参数允许变化的幅度。随着 pH 升高,灭活效果降低,随着温度升高,灭活效果升高,通常可以达到 5 ~ 6 LRV 灭活效果。在 pH 3.6 时,X-MuLV 可以快速失活,且不受其他因素影响,但是在 pH 3.7、pH 3.8 时,其灭活效果会受多因素干扰[17]。而样品中含有一定量的精氨酸时可以改善病毒灭活效果,即使在 pH 4.0的条件下也有显著的灭活效果[18]。低 pH 孵放不仅可以灭活有脂包膜类病毒,还可以沉淀 HCP、DNA 等杂质,对纯化工艺中的杂质去除也起到重要作用。
2.3.2.2 工艺参数 低 pH 孵放步骤通常设置为抗体亲和层析纯化后一步,抗体经低 pH 溶液洗脱收集后,用低 pH 溶液(通常为盐酸、柠檬酸等酸性溶液)调节至优化后设定的 pH 值进行孵育,如工艺中有胃酸等其他试剂,则按照工艺条件添加,孵育结束后再用高 pH 溶液(通常为 Tris 等碱性溶液)回调至设定 pH 值,根据需要还可进行电导率调节、深层过滤等后续步骤。不同类型的抗体对 pH 耐受不同,例如 IgG4 对于低 pH 耐受较差,容易产生聚体,故在设定孵育 pH 值时需充分测试抗体对于 pH 值、时间耐受的程度,避免引起抗体质量问题。
2.3.2.3 注意事项 低 pH 孵育主要应用在 IgG 类产品。调整溶液 pH 在4 左右,保持在 20 ~ 30 ℃,可以分解多聚体或降低多聚体产生,还有病毒灭活效果。对病毒灭活来说,主要是对脂包膜病毒有效,对部分非脂包膜病毒有效。为了捕获特异性抗体常使用 Protein A 柱。单抗在 pH4 的缓冲溶液下溶出,溶出液调整 pH 值以后,保持一段时间进行病毒灭活处理。
2.3.3 纳米膜过滤技术
2.3.3.1 技术原理 病毒膜过滤是利用病毒和蛋白大小的不同,小于平均孔径的蛋白通过滤膜,大于平均孔径的病毒截留在膜内,从而达到去除病毒的效果[19]。病毒去除膜过滤可以同时满足病毒去除效果好、目的蛋白质通过性高(回收量、过滤时间)、目的蛋白质不变性的特点,另外不管是脂包膜病毒还是非脂包膜病毒,无论病毒基因组是 RNA 还是 DNA,基本靠孔径大小来去除病毒,所以是当前最可靠的病毒去除、灭活技术。根据目的蛋白的大小,可以选择平均孔径不同的滤膜。其中平均孔径为 20 nm 左右的产品被称为细小病毒滤膜。特别是近年来,由于去除小病毒的需求的提高,这种产品得到了广泛的应用。平均孔径 35 ~ 50 nm 的滤膜被称为逆转录酶病毒滤膜。
与除菌过滤膜处理同样,在病毒去除膜处理之后,应该实施制造商推荐的金胶粒子去除试验、泄漏测试、扩散流法等对于滤膜的完整性测试。大部分情况下,病毒去除过滤在生产流程的最后阶段加以实施。
2.3.3.2 工艺参数
料液性质:蛋白浓度、离子强度(导电率)、pH
操作:圧力(流速)、过滤时间、蛋白过滤量,平衡液后冲洗、压力暂停时间和次数。
2.3.3.3 注意事项 根据 PDA Technical Report 41,高 TMP(跨膜压差)是病毒过滤的最劣条件之一。近年来的报告表明,过滤过程中的压力释放以及之后的再加压会影响病毒去除效果。特别是在对于添加细小病毒和噬菌体进行的实验中,在压力暂停并再次加压之后,从滤液中检测出病毒粒子。比如在实际的生产过程中,为了提高蛋白回收率,需要暂停压力,然后流路切换到清洗缓冲槽进行后冲洗就是一个具体例子。这种现象不是某种病毒滤膜所特有的,而是所有病毒滤膜产品的普遍现象。发生这种现象的原因在于,暂停压力后,被截留在膜内的病毒粒子会再进行布朗运动,离开膜壁,再次加压后,附近若有粒径较大的滤孔,病毒粒子又会通过而漏出膜外。
当然,这不意味着病毒粒子一定会漏出。病毒漏出与否、漏出量取决于过滤对象溶液的性质、过滤压力、压力暂停时间、病毒种类、病毒滴度/量和病毒滤膜的种类。为了判断生产工艺的影响,需要使用模拟实际工艺的缩小模型进行病毒去除试验。如果生产工艺中有压力释放过程的话,做病毒验证实验方案时要考虑这一因素。实际生产过程中的流路一般会有阀门,在模拟时可以使用旋塞来代替阀门,尽可能使用试验流路接近实际的生产环境。如果观察到病毒漏出,可以通过改变过滤条件来降低或消除风险。压力释放的影响取决于具体情况,应设想在预想不到的压力释放的情况下,是继续过滤,还是更换滤膜,针对不同的蛋白提前采取对应措施是有意义的。
2.4 国内外病毒去除/灭活验证申报差异
在国内进行新药申报时,提交的病毒清除验证以《生物组织提取制品和真核细胞表达制品的病毒安全性评价技术审评一般原则》及《血液制品去除/灭活病毒技术方法及验证指导原则》为主。如果需要在国外申报或中外双报,则需以《Viral Safety Evaluation of Biotechnology Products Derived from Cell Lines of Human or Animal Origin》《Points to Consider in the Characterization of Cell Lines Used to Produce Biologicals》《Guide Line on Virus Safety Evaluation of Biotechnological Investigational Medicinal Products》为主。指导原则的不同必然造成国内外申报存在一些差异(表 7),具体主要有以下 3 个方面:
2.4.1 指示病毒的差异 国内的指导原则要求比较详细具体,明确指出了病毒的类型。规则要求:“一个典型的验证研究所选择的病毒,至少应包括单链和双链的 RNA 及 DNA、脂包膜和非脂包膜、强和弱抵抗力、大和小颗粒等病毒;去除/灭活技术方面可根据采用的具体方法选择恰当的适宜病毒,例如 S/D 法可选用脂包膜病毒,膜过滤法可选用粒径小的病毒,加热法可选用脂包膜和非脂包膜病毒,低 pH 孵放法可选用对理化因素比较耐受的指示病毒等。”
当然,选择指示病毒的核心需要以生物组织原材料、种子细胞或组织原材料匀浆、培养细胞结束时的混悬液中可能出现的污染病毒为主,结合能够用于评价验证效果的指示病毒的可获得性与相关培养试验条件进行合理选择。
国外规则没有写明病毒的具体要求,仅要求尽可能选择污染产品最相似的病毒进行验证,即特异性指示病毒;同时需要关注理化性质较宽的非特异性病毒。没有像 CFDA 中那样详细描述病毒的特点。
2.4.2 工艺选择上的差异 国内 IND 申报时,一般选择低 pH 和膜过滤这两个工艺。国外进行申报时,除了选择低 pH 和膜过滤这两个工艺,还需进行层析工艺。
低 pH 处理法属于化学病毒去除/灭活的一种。原理是利用病毒表面的抗原在低 pH 值的条件下,电荷发生改变,蛋白质的空间结构也发生不可逆的改变,从而使病毒丧失与细胞受体结合的能力,阻止其侵染细胞。常用于单克隆抗体的病毒灭活工艺。一般选择 pH 3 ~ 3.7 处理 2 ~ 24 h。
膜过滤工艺是一种物理病毒去除/灭活方法。原理是选择孔径比病毒有效直径小的滤膜,将病毒与产品分离。膜过滤不能单独使用,需要与其他方法联合使用。在病毒验证时,需要综合考虑蛋白溶液的浓度、滤速、压力和过滤量等重要参数。
层析法最常用的是亲和层析和离子交换层析。层析法是目前常用的样品不同组分分离技术,利用各组分与固定相亲和力的差异或相互作用不同的原理,实现病毒与样品分离的目的。
2.4.3 工艺重复性方面的差异 国内的指导原则虽然没有硬性的规定,但通常需要做 3 个批次。在国外的指导原则中,明确指出至少分别做 2 次独立的研究来证实清除的可重复性,因此一般是一批样品重复两次。
病毒去除/灭活工艺验证流程涉及多个方面,比如指示病毒的选择、验证方案的选择、清除效果的判定以及统计处理分析等。
2.5 我国病毒清除/灭活验证技术第三方服务机构
2.5.1 中国医学科学院北京协和医学院输血研究所 作为我国唯一的国家级输血医学研究机构,中国医学科学院北京协和医学院输血研究所主要从事输血医学科学研究、输血相关技术研究,为国家血液安全管理、应急医疗体系建设、输血科学技术发展及全民知识普及等方面提供信息咨询和技术支持,担负着我国输血医学研究与发展的重要使命。科研体系由输血传播疾病、临床输血、血液干细胞、输血医学工程、血浆蛋白质、血液资源管理等 6 个科研平台组成,其中输血传播疾病研究平台对外提供血液制品、医疗器械类病毒去除/灭活工艺开发以及验证服务,暂不涉及重组产品类服务。
2.5.2 国药中生上海生物制品研究所有限责任公司 上海生物制品研究所有限责任公司现隶属于中国医药集团有限公司中国生物技术股份有限公司,是国家医学微生物学、免疫学、细胞工程、基因工程、血液制品的主要研究机构、生物制品产、学、研、销一体的国家认定的高新技术企业,是国家第一批生物化学和分子生物学、病原生物学专业硕士学位授予单位,前身为上海生物制品厂,由卫生部直属领导。上海生研所科研部第七研究室对外承接病毒去除/灭活验证服务,是国内最早一批开展该类业务的机构之一,服务范围包括血液制品、单抗、重组蛋白、生化药品等。
2.5.3 中科世生(北京)医药科技有限公司 中科世生(北京)医药科技有限公司主要开展生物医药产品的病毒检测灭活去除验证、植入性医疗器械材料的生物学/免疫学评价、生物医药项目的咨询评估、具有自主知识产权产品的研发等业务活动。该公司是在病毒检测、灭活、去除工艺验证领域获得“双认证”(CMA 和 CNAS)的第三方专业检测机构,其出具的报告具有法律效力。所用的指示病毒来源于 ATCC 和 CVCC 的标准保藏毒株。目前,该公司指示病毒库存有伪狂犬病毒(PRV)、水疱性口炎病毒(VSV)、脑心肌炎病毒(EMCV)、猪细小病毒(PPV)、犬细小病毒(CPV)、鼠细小病毒(MVM)、呼肠孤病毒III型(Reo3)、鼠白血病病毒(MuLV)、牛病毒性腹泻病毒(BVDV)、Sindbis 病毒、EV71 病毒、流感病毒等毒株,为病毒检测/灭活/去除验证研究提供了溯源保障。
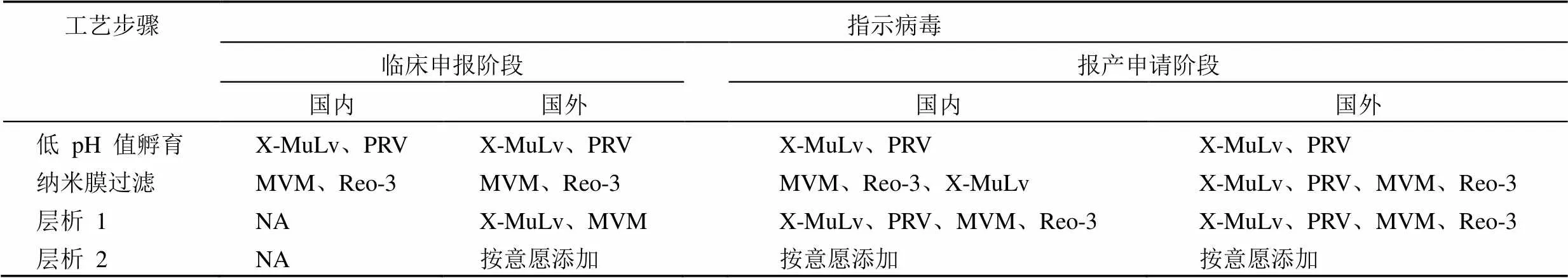
表 7 国内外申报中病毒选择差异
2.5.4 上海药明生物技术有限公司 药明生物的科研和质量团队在工艺开发、利用感染实验和定量 PCR 进行病毒检测和滴度分析,以及初期和后期产品的国际监管等方面具备丰富的专业知识。作为专注于病毒安全领域的非官方第三方生物安全检测服务机构,药明生物是少有的可以在公司内部完成所有生物安全相关检测的医药合同定制研发生产企业。通过消除传统多供应商模式的弊端,可以显著缩短客户药物研发的周期。
2.5.5 北京义翘神州科技股份有限公司 北京义翘神州科技股份有限公司病毒去除/灭活验证研究,最早开始于2007 年,至今已有超过 10 年的经验,有超过 500 次病毒灭活/清除验证研究,涉及到的产品类型包括抗体、蛋白、疫苗等。所用的指示病毒包括鼠白血病病毒(X-MuLv)、PRV、MVM、Reo3、VSV、杆状病毒、弹状病毒等。该公司提供的病毒去除/灭活验证服务范围包括 CHO 蛋白表达系统产品、昆虫蛋白表达系统产品、生化药品,其服务阶段涵盖生产工艺研发阶段、新药临床试验申报阶段(investigational new drug,IND)、生物制品许可申请(biologics license application,BLA)等。病毒灭活/清除验证服务遵循 CFDA、FDA、EMEA、ICH 和 WHO 相关法规规定,方法学验证达到 ICH 标准。
2.5.6 苏州良辰生物医药科技有限公司 苏州良辰生物医药科技有限公司的主要项目是生物制品的病毒去除/灭活验证服务,所用的指示病毒有:BVDV、MuLV、人疱疹病毒(HSV-1)、PRV、Sindbis 病毒、VSV、PPV、EMCV、MVM、呼肠孤病毒(Reo-V)等。该公司服务范围包括动物源性医疗器械、生化药品、生物制品,含动物源性材料中药等。
2.5.7 武汉珈创生物技术股份有限公司 武汉珈创生物技术股份有限公司是由原武汉大学中国典型培养物保藏中心主任郑从义教授领衔组建的高新技术公司。珈创生物研制并验证了:①低pH 孵育工艺病毒灭活验证技术;②纳米膜过滤工艺病毒去除验证技术;③阴离子层析工艺技术;④亲和层析工艺病毒去除验证技术;⑤疏水层析工艺病毒去除验证技术。同期建立病毒大规模扩增及纯化技术;病毒滴度测定TCID50 技术;病毒滴度测定PCR 技术等,构建了包括PRV、MuLV、VSV、Reo3、PPV 在内的多种标准毒株库。珈创生物病毒去除/灭活技术服务包括药品、生物制品生产工艺等。
[1] World Health Organization. Global status report on blood safety and availability. 2016.
[2] Plasma Protein Therapeutics Association. The PPTA vision on the plasma protein therapies sector for the next decade in Europe. (2014- 04-10).
[3] Cerus Corporation. 2017 Cerus annual report. http://www.cerus.com/ Contact-Us/Search-Results/default.aspx?SearchTerm=annual+report.
[4] Terumo Corporation. Terumo report 2019. https://www.terumo.com/ investors/library/annual-reports/.
[5] Cicchetti A, Berrino A, Casini M, et al. Health Technology Assessment of pathogen reduction technologies applied to plasma for clinical use. Blood Transfus, 2016, 14(4):287-386.
[6] Octapharma AG. Octapharma annual report 2018. https://www. octapharma.com/about-us/who-we-are/annual-report/.
[7] Inouye M, Burnouf T. The role of nanofiltration in the pathogen safety of biologicals: an update. Curr Nanoscience, 2020, 16(3):413-424.
[8] Asahi Kasei Corporation. Medium-term management initiative (FY 2016-2018) progress and outlook. https://www.asahi-kasei.com/ir/ library/asahikasei_ report/.
[9] Pall Corporation. 2014 Fact book. https://shop.pall.com/us/en/search? CatalogCategoryID=&SearchParameter=&PageSize=20&SortingAttribute=&industry=&filtertype=&topnav=&selectedtab=document&resetallqueries=false&modifyallqueries=false&resetdatecondition=&categorylevel=&SearchTerm=annual+report.
[10] Sartorius AG. Sartorius annual report 2019. https://ir-reports.sartorius. com/en/ag/fy-2019/.
[11] Merck KGaA. Mobius® sINGLE-uSE mANUfacturing. https://www. merckmillipore.com/CN/zh/Mobius-Single-Use-Manufacturing/yWmb.qB.tSUAAAFZ0i1iYtcT,nav?ReferrerURL=https%3A%2F%2Fcn.bing.com%2F.
[12] MarketWatch, Inc. Viral clearance market size, share 2020 global industry trends, statistics, competition strategies, revenue analysis, key players, regional analysis by forecast to 2026. (2020-07-16). https://www. marketwatch.com/press-release/viral-clearance-market-size-share-2020-global-industry-trends-statistics-competition-strategies-revenue-analysis-key-players-regional-analysis-by-forecast-to-2026-2020-07-16.
[13] Pall Corporation. Scalability of Cadence™ Inline concentrator modules for bovine igg processing. https://cn.bing.com/search?q=% 5B13%5D%09Scalability%20of%20Cadence%E2%84%A2%20Inline%20Concentrator%20Modules%20for%20Bovine%20IgG%20Processing&qs=n&form=QBRE&sp=-1&pq=%5B13%5D%20scalability%20of%20cadence%E2%84%A2%20inline%20concentrator%20modules%20for%20bovine%20igg%20processing&sc=0-82&sk=&cvid=DFE97637BF174084A1B9958306FD2E9D.
[14] Sartorius AG. Flexact® Modular | Single-use Automated Solutions. https://www.sartorius.com/en/products/process-filtration/flexact-single-use-automated-solutions.
[15] Burnouf T, Chou ML, Cheng LH, et al. Dengue virus inactivation by minipool TnBP/Triton X-45 treatment of plasma and cryoprecipitate. Vox Sang, 2013, 104(1):1-6.
[16] Horowitz B, Prince AM, Horowitz MS, et al. Viral safety of solvent-detergent treated blood products. Dev Biol Stand, 1993, 81: 147-161.
[17] Chinniah S, Hinckley P, Connell-Crowley L. Characterization of operating parameters for XMuLV inactivation by low pH treatment. Biotechnol Prog, 2016, 32(1):89-97.
[18] Yamasaki H, Tsujimoto K, Koyama AH, et al. Arginine facilitates inactivation of enveloped viruses. J Pharm Sci, 2008, 97(8):3067- 3073.
[19] Hamamoto Y, Harada S, Kobayashi S, et al. A novel method for removal of human immunodeficiency virus: filtration with porous polymeric membranes. Vox Sang, 1989, 56(4):230-236.
容新宗,Email:48740770@qq.com
2020-07-03
10.3969/j.issn.1673-713X.2020.04.018
