微生物来源的唾液酸转移酶研究进展
2019-04-01,,,,,,,,,,
, , ,,,,,,,,
(河南科技学院食品学院,河南新乡 453003)
糖蛋白、糖脂和多糖存在于许多生物的细胞表面,参与细胞识别、细胞分化和各种受体与配体间的相互作用过程。这些有生物活性的聚糖中含有一种具有九碳结构骨架的酮基酸性单糖,其衍生物被称为唾液酸(Sialic Acids,SAs)。SAs是一类普遍存在于生物系统中的天然糖酸类化合物,因最初是从牛下颌唾液腺中分离出而得名[1-2]。目前确定的SAs有50多种天然衍生物,其中最常见的有N-乙酰神经氨酸(N-acetylneuraminic Acid,Neu5Ac)、N-羟乙酰基神经氨酸(N-glycolylneuraminic Acid,Neu5Gc)和脱氨基神经氨酸(2-keto-deoxy-D-glycero-D-galacto-nonulosonic Acid,KDN)(图1)以及O-甲基、O-乳酰基、O-磺基、O-磷酸基和单或多个O-乙酰基衍生物[3]。SAs通常以短链残基的形式,通过α-糖苷键连接在细胞膜最外面的糖类部分以及分泌的糖脂、糖蛋白和脂多糖等糖缀合物的尾端[4],是细胞信息传输的首个接触位点,在很多病理和生理进程中起着重要的作用,如细胞间的信息通讯、细胞增殖分化、肿瘤的发生及转移、免疫反应调节等[5-6]。另外,在神经系统中,唾液酸的表达尤为丰富,其中聚唾液酸共价修饰的神经细胞粘附分子,是聚唾液酸的主要载体蛋白。唾液酸是大脑神经节苷脂及糖蛋白结构和功能的主要构成部分,对大脑神经系统的发育具有重要的作用[7]。因此,在食品中外源性的添加SAs可促进婴儿的大脑发育及认知能力,在功能性食品的开发中具有广泛的应用前景。

图1 三种常见的唾液酸衍生物分子结构[8]Fig.1 Three common molecular structures of sialic acid derivatives[8]
唾液酸转移酶是一种典型的含有二硫键的Ⅱ型跨膜糖蛋白,通常位于内质网和高尔基体内侧[9],负责将唾液酸从活化的糖基供体—CMP-Neu5Ac转移至受体糖链末端半乳糖或乙酰氨基半乳糖上,进而合成唾液酸化糖链,属糖基转移酶家族,是生物合成唾液酸化寡糖的关键酶[10]。迄今为止,唾液酸转移酶已在哺乳动物的器官、细菌及病毒中被识别,其酶活性、作用底物和催化特异性、晶体结构等均有所差异。当前国内关于唾液酸转移酶的研究大多以动物来源为主,而对于细菌来源的研究还有所欠缺。哺乳动物来源的唾液酸转移酶具有严苛的受体底物特异性,对糖的类别和构成的键型专一性要求特别高[11],而细菌来源的唾液酸转移酶具备更加广泛的底物特异性,如Pd2,6ST(Pasteurella damselae 2,6-sialyltransferase)能以C2位岩藻糖基化的半乳糖作为受体底物,把Neu5Ac转移至2′-Fucosyllactose中半乳糖的C6位。细菌来源的唾液酸转移酶目前已被广泛用于合成各式各样天然的以及非天然的唾液酸化寡糖,并作为碳水化合物活性酶(CAZy)数据库(http://www.cazy.org)的一部分,用于生物学研究[12]。本文主要对唾液酸转移酶的微生物来源与分类、晶体结构、催化反应机理、酶学性质、异源表达以及在唾液酸寡糖合成中的应用等几个方面进行了综述,为唾液酸转移酶酶学特性的研究以及开发具备各种生物学功能的唾液酸化寡糖提供一定的理论参考依据。
1 唾液酸转移酶的微生物来源与分类
细菌酶对糖类化合物的修饰和合成非常重要,与哺乳动物酶相比,细菌来源的酶具有稳定性强、活性较高的特点。唾液酸转移酶的微生物来源主要为大肠杆菌(Escherichiacoli)、多杀巴斯德氏菌(Pasteurellamultocida)、空肠弯曲杆菌(Campylobacterjejuni)、淋球菌(Neisseriagonorrhoeae)和脑膜炎奈瑟氏球菌(Neisseriameningitidis)等一些致病菌。在CAZy数据库中,基于唾液酸转移酶蛋白质序列的同源性,所有已知的唾液酸转移酶被分为六个糖基转移酶(GT)家族,其中有5个GT家族来自细菌,分别为GT4、GT38、GT42、GT52和GT80[13]。根据唾液酸转移酶的底物特异性和催化生成糖苷键的连接方式,该类酶被进一步细分为α-2,3唾液酸转移酶、α-2,6唾液酸转移酶和α-2,8 唾液酸转移酶,分别以α-2,3、α-2,6和α-2,8糖苷键将CMP-Neu5Ac的唾液酸残基连接至新的糖基受体上,形成不同的唾液酸化糖苷化合物[14-15]。唾液酸糖基转移酶的微生物来源及划分归类见表1。

表1 唾液酸转移酶的微生物来源及分类Table 1 Microbial sources and classification of sialyltransferase
2 唾液酸转移酶的晶体结构
唾液酸转移酶是一种II型跨膜糖蛋白,其结构(图2[31])由一段短N-末端胞质尾区(cytoplasmic tail)、相对较短的跨膜域(TMD)、一段所谓的“茎”区域(stem region)以及一长段暴露于高尔基体内的C-末端催化结构域(catalytic domain)组成。其中N-末端是与糖基供体结合的结构域,负责糖基供体的特异性识别,相对较短的TMD对唾液酸糖基转移酶在高尔基体膜定位中起着关键作用,而蛋白质大小的变化通常由茎部长度的差异决定[32],最近报道表明,ST6GalI的茎区可以在鉴别糖蛋白受体方面发挥作用,并对催化结构域进行空间控制[33],此外唾液酸转移酶可通过催化结构域进行同源或异源寡聚化,增强其在高尔基体系中的保留活性。

图2 唾液酸转移酶的晶体结构Fig.2 The crystal structure of sialic acid transferase
唾液酸糖基转移酶依据其结构折叠形式的不同,可以划分成两类:GT-A(glycosyltransferase A)折叠和GT-B(glycosyltransferase B)折叠。其中GT-A 折叠由单个核苷酸结合的Rossmann结构域组成,以 DXD 基序作为结束,具有典型的三明治结构和较小的折叠[34]。GT-A酶含有对催化作用至关重要的Asp-x-Asp(DxD)保守序列,对金属离子具有依赖性,但微生物来源的GT-A折叠唾液酸转移酶具有不用结合DxD的两种特异体,通常不需要金属离子的催化。GT-B折叠由两个独立的Rossmann结构域组成,连桥区域及催化活性位点位于两个结构域之间。虽然一些非唾液酸转移酶的GT-B酶可能需要二价金属离子提高催化活性,但迄今为止所表征的GT-B折叠的糖基转移酶结构中未见与催化相关的结合金属离子[35-36]。唾液酸转移酶的结构研究对进一步理解唾液酸糖基转移酶受体底物特异性以及细胞内糖基化机制至关重要。
迄今为止,在所有已知的细菌唾液酸转移酶中,共有7种唾液酸转移酶的晶体结构被报道,分别是CAZy GT42家族的空肠弯曲杆菌α-2,3/8唾液酸转移酶Cst-II 和α-2,3唾液酸转移酶Cst-I、CAZy GT52家族的脑膜炎奈瑟氏球菌α-2,3唾液酸转移酶、GT80家族的多杀巴斯德氏菌PmST1、弧菌科发光细菌JT-ISH-224 pst3-224和pst6-224以及脑膜炎奈瑟氏球菌α-2,3/6唾液酸转移酶[37]。2004年Chiu等[38]首次报道了来自空肠弯曲杆菌的多功能唾液酸转移酶Cst-II(GT42家族)的晶体结构,空肠弯曲杆菌CstII晶体结构研究表明,CstIIΔ32的每个单体由259个氨基酸残基组成。这些残基构成了两个结构域,第一结构域(1~154,189~259位氨基酸残基)为混合性α/β折叠,第二个较小的区域(155~188位氨基酸残基)在活性位点上形成一种类似于盖状结构的折叠,此结构域的175~187位氨基酸残基仅在与CMP-NeuAc底物完全结合时才发生有序排列。首个细菌唾液酸转移酶晶体结构的确定为此类酶结构和机制以及受体特异性的研究提供了一定的理论基础。Breton等[39]研究发现,空肠弯曲菌(CampylobacterjejuniOH4384)所产生的唾液酸糖基转移酶CstI和CstII有42%氨基酸序列是一致的,同属于GT-A结构,CstII是双功能酶,可以α-2,3/8糖苷键催化唾液酸转移至新的糖基受体上,而Cst I是单功能酶,仅表现出α-2,3转移酶活性,对半乳糖苷受体表现出高度特异性。Nhung Huynh等[40]研究了美人鱼发光杆菌(Photobacteriumdamselae)来源的Δ15Pd2,6ST(N)的晶体结构。Δ15Pd2,6ST(N)晶体的每个不对称单元中含有四个单体,每个单体由24~497位氨基酸残基有序组成,第一个N-末端结构域(24~111位氨基酸残基)是最小的结构域,采用类似于免疫球蛋白的折叠方式,第二结构域(112~334位氨基酸残基)和第三结构域(335~497位氨基酸残基)是两个独立的 Rossmann结构域,CMP的结合位点位于两个Rossmann结构域之间的裂缝中,构成了GT-B折叠。
3 唾液酸转移酶的催化反应机理
尽管不同来源的唾液酸转移酶在其氨基酸序列和结构上存在差异,但所有的唾液酸转移酶都是反向型(inverting)糖基转移酶[41],遵循一个单一的取代机制,催化CMP-唾液酸供体底物中α-唾液酸化糖苷键的形成。唾液酸转移酶的催化作用基础在于该酶可促进受体对供体底物唾液酸残基C-2的亲核攻击,经过一个氧鎓正离子的过渡态,利用另一酶群的静电稳定或局部质子化作用协助CMP唾液酸残基转移[32]。糖基转移酶活性位点的共同功能特征是可有效地排除催化中心的水分子,减少催化反应过程中出现“错误水解”的可能性[42]。Kakuta等[43]提出了来源于发光弧菌JT-ISH-224的Δ16psp26ST催化α-2,6糖苷键的底物与CMP-Neu5Ac反应的催化机理(图3):在此催化反应中,Asp232上的羧基负离子为酶的催化活性中心,它能和半乳糖C-6位羟基上的质子进行结合,以加强羟基的亲核性,同时由此羟基上的氧原子进攻CMP-Neu5Ac上唾液酸的C-2位,此时位于酶活性中心的His405提供质子给CMP内和磷原子相邻的氧原子,从而使氧鎓正离子的过渡态得以稳定,最后以α-2,6糖苷键将唾液酸残基从CMP-Neu5Ac转移到半乳糖上。
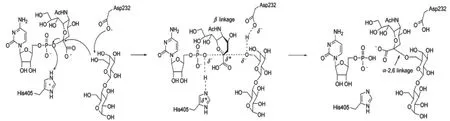
图3 α-2,6唾液酸转移酶的催化反应机理Fig.3 The catalytic reaction mechanism of α-2,6-sialyltransferase
4 唾液酸转移酶的酶学性质
唾液酸转移酶因来源不同,相对分子质量、最适温度、最适pH及最适作用底物等性质也各不相同。细菌来源的唾液酸转移酶的相对分子质量一般在30000~60000之间,同一菌株的不同唾液酸转移酶的相对分子质量也存在较大差异,如明亮发光杆菌JT-ISH-224来源的α-2,3唾液酸转移酶的相对分子质量为58518,而α-2,6唾液酸转移酶的相对分子质量为43995[24]。已发现的唾液酸转移酶的最适温度范围一般为30~40 ℃,少数会在25 ℃,最适pH通常在7.0~9.0之间,但大多来自海洋细菌的唾液酸转移酶在酸性条件下活性较高,如来源于明亮发光杆菌和海洋弧菌JT-FAJ-16的α-2,3唾液酸转移酶,最适pH范围为5.0~6.0[44]。唾液酸转移酶通常不需要金属离子作为辅因子,但也有个别微生物来源的唾液酸转移酶由于二价金属离子的存在使其酶活性明显提高,如脑膜炎奈瑟氏球菌来源的PSTNMα-2,3唾液酸转移酶,加入20 mmol/L的 Mg2+后酶活性增加了4倍[17]。与哺乳动物来源的唾液酸转移酶相比,微生物来源的唾液酸转移酶具有广泛的底物特异性,如来源于幽门螺杆菌α-2,3/6唾液酸糖基转移酶,乳糖、N-乙酰-D-乳糖胺(LacNAc)及乳糖-N-二糖(Lacto-N-biose)都可作为其合成的底物[45]。
5 唾液酸转移酶的异源表达
唾液酸转移酶在生物体的含量普遍较低,较难提取并大量制备。随着20世纪70年代重组DNA技术的建立及发展,以及DNA序列测定和蛋白质结构与功能关系数据的积累,人们能较容易地克隆各种天然酶的基因,并利用适当载体导入到可以大量繁殖的生物系统里实现高效表达,提高了唾液酸转移酶的产量。Talafová等[30]从海藻糖巴氏杆菌中克隆出α-2,3唾液酸糖基转移酶基因BtST1,经PCR扩增后,定向插入到原核表达载体pET-51b(+),在载体表达的蛋白N端引入Strep标签,随后将重组表达载体转化到大肠杆菌中进行表达。结果表明,在1 L大肠杆菌细胞培养物的细胞裂解物中可获得大约31.3 mg的BtST1蛋白,其相对分子质量约为 40 kDa,最适pH为9.0,最适作用温度为37 ℃,以CMP-Neu5Ac为作用底物时,BtST1的催化效率为44.2 s-1mmol/L-1。Okino等[46]将发光杆菌(Photobacteriasp. JT-ISH-224)α-2,6唾液酸转移酶编码基因插入到pTrc99A载体,重组表达质粒被转化到大肠杆菌TB1中进行表达,经色谱纯化,目的蛋白的最终产量约为24 mg,通过SDS-PAGE确定其分子量约为55 kDa,实现了α-2,6唾液酸转移酶在大肠杆菌中的活性表达。Katharina等[26]从达可马巴斯德菌中发现了一种新的α-2,8唾液酸转移酶基因PdST,将其定向插入到表达载体pET23a(+)中得到重组表达载体,转化到大肠杆菌BL21(DE3)中进行表达,成功获得了相对分子质量为45300的PdST蛋白,在温度25 ℃、pH8.0条件下,以CMP-Neu5Ac为供体、乳糖为受体底物时,该酶的酶活力水平可达5.7 U/mg。
6 唾液酸转移酶在唾液酸寡糖合成中的应用
利用酶促合成寡糖及其衍生物的可行性源于糖基转移酶及糖核苷酸的有效性。近年来已开发了许多用于其合成的化学及化学酶促方法,明显提高了酶的活性以及糖的制备量[47]。化学酶法合成结合了化学合成的灵活性和酶法合成的高度选择性,是高效获得复合碳水化合物的途径。在细菌来源的唾液酸转移酶未被识别与克隆之前,哺乳动物来源的唾液酸转移酶,已被应用于酶法及化学酶法合成系统中,但由于它们在哺乳动物细胞的表达水平较低、具有严格的受体底物特异性,且核苷酸糖基供体CMP-Neu5Ac价格昂贵,限制了该类酶在唾液酸糖苷合成中的应用。相比之下,自从1996年Gilbert等[23]成功地克隆了来自脑膜炎奈瑟氏球菌和淋球菌的α-2,3唾液酸转移酶,越来越多的细菌唾液酸转移酶被应用到唾液酸糖苷的酶促合成中。唾液酸化寡糖的合成常采用“一锅多酶”法,即将糖核苷酸供体CMP-唾液酸、相应的合成酶、唾液酸转移酶及相应的受体底物在一个体系中进行有序的多步反应。在此系统中,所有酶的催化反应都可以在一个罐子里进行,不需要隔离中间产物,简化了产品的净化过程,大大节省了产品合成的时间。Yu等[48]利用多杀巴斯德氏菌α-2,3唾液酸转移酶及美人鱼发光杆菌α-2,6唾液酸转移酶以乙酰甘露糖胺作为Neu5Ac前体,3-叠氮丙基乳糖苷(3-azidopropyl lactoside)为受体底物,在“一锅多酶”系统中进行合成反应,产物Neu5Acα2,3LacβProN 3 和Neu5Acα2,6LacβProN 3的合成率分别可达84%、98%。一锅多酶法也被应用于α-2,8糖苷键连接的唾液酸糖苷的合成中,Cheng等[49]报道了来源于空肠弯曲杆菌的CstIIΔ32I53S,该酶具有催化α-2,8糖苷键形成的活性,被用于一系列唾液酸化寡糖包括GM3(Neu5Acα2-3Lac)、GD3(Neu5Acα2-8Neu5Acα2-3Lac)、GT3(Neu5Acα2-8Neu5Acα2-8Neu5Acα2-3Lac)的酶促合成中。
7 结论与展望
糖生物学和糖医学的发展极大地推动了寡糖合成的发展进程,唾液酸化的寡糖具有促进双歧杆菌增值、降低血内毒素及血氨、增强机体免疫力的作用,其合成研究逐渐成为人们关注的热点。微生物来源的唾液酸转移酶具有广泛的底物特异性,在唾液酸寡糖的合成中具有广阔的应用前景。但与国外相比,我国的唾液酸转移酶研究还存在许多问题,如唾液酸转移酶大多从国外进口,价格昂贵,增加了该酶在唾液酸寡糖合成中的应用成本;国内唾液酸转移酶微生物资源开发不足、唾液酸转移酶种类较少,产量远不能满足市场需求;唾液酸转移酶在细菌表达系统中的稳定性、可溶性及活性蛋白水平较低,可利用性不高,应用范围受到限制。因此,选育高产唾液酸转移酶的菌株、完善唾液酸转移酶的高效表达与纯化工艺依然是当前的研究重点。此外,在蛋白质晶体结构的研究基础上,设计具有改变唾液酸转移酶底物特异性的酶突变体,对新型唾液酸糖苷化合物的开发具有重要的研究意义。
