以金色分枝杆菌为模式菌株筛选抗结核活性化合物可行性研究
2020-08-14蒙建州王潇关艳肖春玲刘忆霜
蒙建州,王潇,关艳,肖春玲,刘忆霜
·论著·
以金色分枝杆菌为模式菌株筛选抗结核活性化合物可行性研究
蒙建州,王潇,关艳,肖春玲,刘忆霜
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所重点室
评估以金色分枝杆菌作为结核分枝杆菌模式菌株筛选抗结核抑制剂的可行性。
以结核分枝杆菌标准菌株 H37Rv 建立细胞水平的抑制剂高通量筛选模型,对本单位化合物库部分样品进行筛选,获得具有抗结核活性的化合物;进一步比较模式菌株金色分枝杆菌、耻垢分枝杆菌、海分枝杆菌及谷氨酸棒状杆菌对具有较强抗结核活性样品的敏感性差异。
利用基于结核分枝杆菌建立的全细胞筛选模型,从本单位化合物库的 5 万个样品中筛选得到 67 个最低抑菌浓度≤ 5 µg/ml 的化合物。对金色分枝杆菌、耻垢分枝杆菌、海分枝杆菌和谷氨酸棒状杆菌有抑制活性的样品分别有22 个(32.84%)、10 个(14.93%)、12 个(17.91%)和6 个(8.96%),其中抑菌活性与抗结核活性差异在 4 倍以内的样品分别有 16 个(72.73%)、5 个(50%)、7 个(58.33%)和 3 个(50%)。
相对于其他 3 种模式菌株,金色分枝杆菌对本单位样品库化合物的敏感性与结核分枝杆菌的最为接近,以金色分枝杆菌为模式菌株开展抑制剂筛选研究更有可能获得具有抗结核活性的化合物。
结核分枝杆菌; 金色分枝杆菌; 表型筛选; 抗结核化合物
结核病是由结核分枝杆菌(,Mtb)感染引起的传染性疾病,具有高致病性和致死性的特点。2017 年全球结核病患者大约有 1000 万,其中死于结核病的患者有 130 万[1]。目前结核病的治疗主要是采用 WHO 推荐的 DOTS 方案,治疗周期长达半年。由于治疗周期长、患者依从性差以及 Mtb 独特的生理特征,结核病出现了严重的耐药问题。2017 年,全球利福平耐药新发病例有 55.8 万(82% 为耐多药结核病患者),其中 13% 的病例发生在我国[1]。传统抗结核药物不能有效治疗由耐药 Mtb 感染引起的结核病,其治愈率仅为 55%。新型抗结核药物研制进展缓慢,近五十年来仅有贝塔奎宁和德拉玛尼两种具有全新结构的抗结核药物被批准用于治疗耐药结核病[2-3]。但这两种药物具有较强的心脏毒性,而且临床很快出现了对它们具有耐药性的 Mtb 突变株[4-5]。因此迫切需要开发出新型抗结核药物用于治疗由耐药 Mtb 感染引起的结核病。
贝塔奎宁和德拉玛尼的成功研制表明具有全新作用机制、结构新颖的化合物能够成功避开 Mtb 已有的耐药机制。目前获得新结构抑制剂的研究策略主要有两种:一是基于酶的生化反应原理建立高通量筛选模型,寻找具有抗菌活性的酶抑制剂,但通过这种方法难以得到有抑菌活性的样品[6];另一种方法是建立细胞水平的抑制剂筛选模型,从样品库中直接筛选到具有抑菌活性的样品。传统抗结核药物(或其先导物)都是利用全细胞筛选模型获得的,新型抗结核药物贝塔奎宁、德拉玛尼、PA824以及利奈唑胺等的先导物也是通过这种方式发现的[7]。因此在细胞水平开展抑制剂的筛选研究更有可能获得具有开发价值的先导物。但是生长缓慢且具有很强致病性的 Mtb 难以直接用于大量样品的筛选研究,而与 Mtb 遗传背景接近、不具有致病性且生长快速的分枝杆菌如耻垢分枝杆菌(,Msm)、海分枝杆菌(,Mma)、金色分枝杆菌(,Mau)和牛结核分枝杆菌 BCG 以及与 Mtb 具有相似细胞壁结构的谷氨酸棒状杆菌(,Cgl)常被用作模式菌株筛选抗结核抑制剂[8-12]。其中以 Mau和 BCG 对临床抗结核药物的敏感性与 Mtb 最为接近[13-14]。Altaf 等[15]采用 Mtb、Msm 和 BCG 对来自 LOPAC、NIH 和 Spectrum 的化合物样品进行筛选,发现 3 种菌株对不同来源样品的敏感性不一致,筛选结果的阳性率与菌种及样品特征都有相关性。因此选择合适的模式菌株针对特定样品库开展抑制剂筛选研究能够提高筛选效率、降低假阴性率和假阳性率,尽可能多地获得具有抗结核活性的苗头化合物。
本实验室长期从事抗结核抑制剂筛选研究,拥有 Msm、Mma、Mau 和 Cgl 4 种 Mtb 模式菌株。本研究将通过比较它们对从本单位化合物库(部分)样品中得到的抗结核化合物的敏感性差异,从而挑出敏感性与 Mtb 一致性最高的菌株,以便于采用该菌株对本单位化合物库样品开展全面的筛选研究。
1 材料与方法
1.1 材料
1.1.1 菌株 Mtb H37Rv(ATCC 27294)由首都医科大学附属北京胸科医院北京市结核病胸部肿瘤研究所细菌免疫室保存;Mau(ATCC23366)、Msm mc2155、Mma BAA-535及 Cgl(ATCC 13032)均购自 ATCC。
1.1.2 化合物样品 筛选样品来自中国医学科学院医药生物技术研究所国家新药(微生物)筛选实验室化合物库保藏的 5 万种单体化合物,浓度为 10 mg/ml;异烟肼(isoniazide,INH)购自美国Sigma 公司,用 DMSO 溶解配成 10 mg/ml 的溶液,于 4 ℃保存。
1.1.3 培养基 培养分枝杆菌的培养基 7H9、7H10 及其添加剂 OADC和培养 Cgl 的BHI 培养基均购自美国BD 公司。
1.2 方法
1.2.1 种子液培养 采用接种环蘸取保存在–80 ℃的 Mtb H37Rv、Mau、Msm 和 Mma 于 7H10固体培养基(含 10% OADC)划线,静置培养直至长出单菌落(Mtb H37Rv、Mau 和Msm 最适生长温度为 37 ℃,Mma 最适生长温度为 28 ℃);挑取单菌落接种于 5 ml 7H9培养基(含 10% OADC 和 0.05% Tween80),静置培养;它们生长至平台期的时间分别为 10 ~ 14、12 ~ 14、2 ~ 3 及 5 ~ 7 d。将保存于–80 ℃的 Cgl 在含有 BHI 的琼脂平板上划线,37 ℃过夜培养;挑取单菌落接种于 5 ml BHI 培养基,静置培养 12 ~ 14 h 至平台期。
1.2.2 高通量筛选模型建立及评价
1.2.2.1 Mtb生长情况监测 于 96 孔板第1 列加入 0.6 μl INH 溶液(阳性对照,p),第 2 列加入 0.6 μl溶剂DMSO(阴性对照,n),于第 1、2、3(正常生长)列加入 200 μl接种有对数期 Mtb H37Rv 的 7H9 培养液(终浓度600≈ 0.1),第4 列加入不含菌液的培养基 200 μl(空白对照,b)。将 96 孔板用保鲜膜密封、37 ℃静置培养并采用酶标仪测定菌株 7 d 内600光吸收的变化情况,制作生长曲线。
1.2.2.2 高通量抑制剂筛选模型建立 对“1.2.2.1”中测定的 Mtb 在液体培养基的600光吸收值,采用 Z'因子评估高通量筛选模型的可靠性。其计算公式如下:
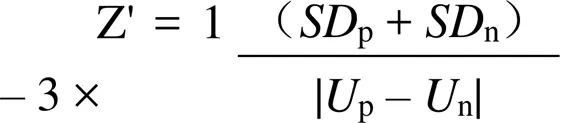
表示600吸收值的标准差,表示600吸收值的平均值。
1.2.3 高通量抑制剂筛选 利用建立的高通量筛选模型对本单位化合物库部分样品(约 5 万个)进行筛选,样品初筛浓度为 30 μg/ml。筛选体系如表 1 所示。

表 1 Mtb H37Rv 高通量抑制剂筛选体系
注:–表示不添加相应成分。
Note: – Indicated that the corresponding ingredients were not added.
将 96 孔板用保鲜膜封闭、37 ℃静置培养7 d 后,测定600光吸收值并计算化合物对菌株生长的抑制率。抑制率 IR 计算公式如下:
1.2.4 化合物抗结核活性测定 采用二倍稀释法在 96 孔板中测定“1.2.3”获得的抑制剂对Mtb H37Rv 的最低抑制浓度(minimum inhibitory concentrations,MIC)。第 1 排和第 8 排加入200 μl 7H9 培养基以防止干燥。测试浓度最高为 20 μg/ml,最低为 0.625 μg/ml,每个浓度做 3 个平行。溶剂 DMSO 为阴性对照,INH为阳性对照。
1.2.5 化合物对模式菌株的抑制活性测定 采用二倍稀释法测定“1.2.4”项中对 Mtb H37Rv MIC ≤ 5 μg/ml 的化合物对 Mau、Msm、Mma 和 Cgl的 MIC值。最高测定浓度为 32 μg/ml,最低浓度为 0.0625 μg/ml,每个浓度设 3 个平行,对照组设置同“1.2.4”。
2 结果
2.1 结核分枝杆菌生长情况
采用生长缓慢的 Mtb建立细胞水平的高通量抑制剂筛选模型时,在兼顾模型的灵敏性和重复性的前提下应尽量节约时间。我们首先监测了 Mtb H37Rv在 7 d 内的生长情况。从图 1 可以看出,Mtb H37Rv 在含有 0.3% DMSO 的 7H9 培养基中的生长情况与正常培养基中的一致,表明 DMSO 在此浓度下不会影响菌株的生长。本研究中样品初筛浓度为 30 μg/ml,因此也将阳性对照样品 INH 的浓度设为 30 μg/ml。而 INH 对 H37Rv 的 MIC 值为 0.1 ~ 0.2 μg/ml[16],所以菌株在含有 30 μg/ml INH 的培养基中不能生长,与本研究实验现象一致。
2.2 筛选模型评估
根据“2.1”项实验结果,采用公式⑴对体系在第 5 ~ 7 天的光吸收600值进行计算,3 个 Z' 值分别为 0.07、0.70 和 0.76,通常情况下 Z' 值大于 0.5 的筛选模型被认为是可靠的[17]。本研究中,Mtb H37Rv 在第 5 天后进入对数生长期,600吸收值迅速提高,模型的 Z' 值从第 6 天开始超过 0.5。Z' 越大,模型的可靠性也越高,为了兼顾可靠性和实验效率,我们的筛选模型将在加样后第7 天观测实验结果。
2.3 高通量抑制剂筛选
利用建立的筛选模型对本单位化合物库的50 000 个单体样品进行筛选,并根据公式⑵计算化合物对 Mtb 的抑制活性。为了不遗漏骨架结构新颖的化合物,我们将抑制率大于 50% 的化合物定义为阳性样品,该抑制率大于同等浓度下 D-环丝氨酸对野生 Mtb 的抑制率[18]。本实验中我们总共获得了 528个阳性样品,阳性率为 1.05%。
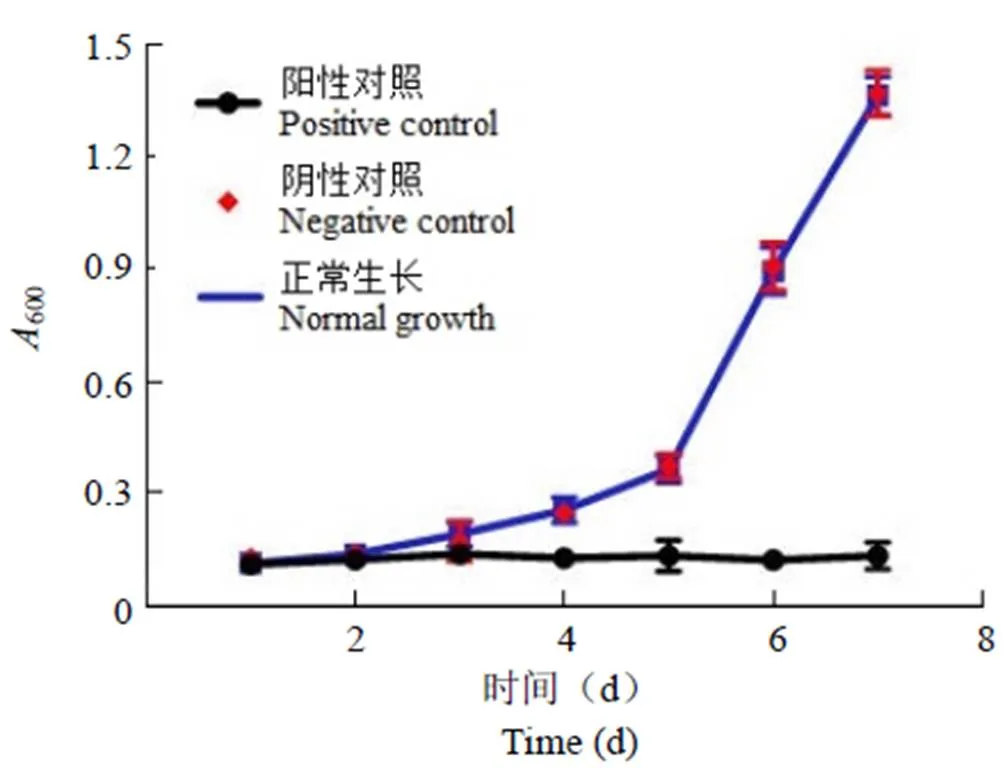
图 1 Mtb H37Rv 在 7 d 内的生长情况
Figure 1 Growth curve of Mtb H37Rv incubated for 7 days
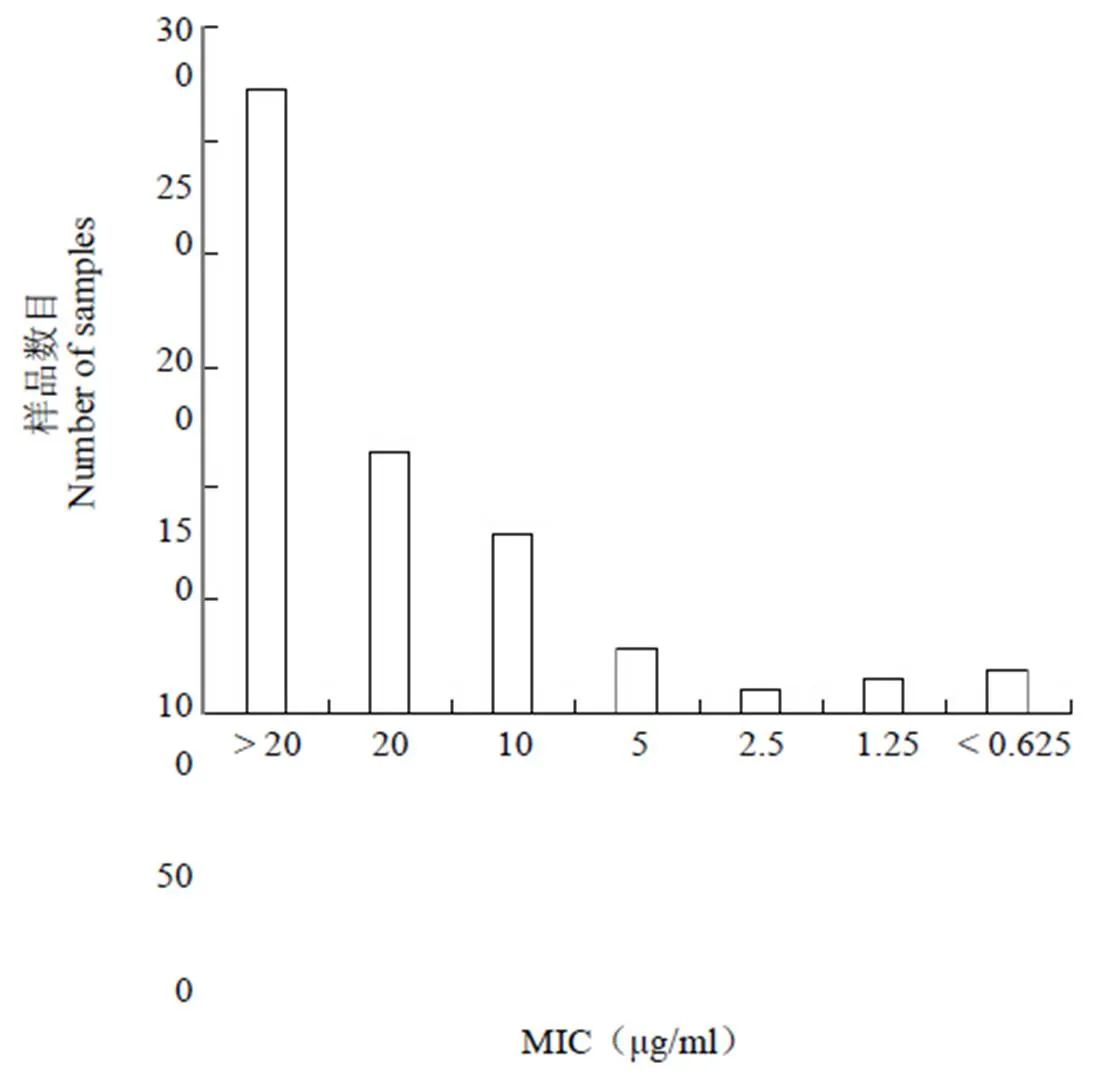
图 2 抗结核化合物 MIC 值分布情况
Figure 2 Minimal inhibitory concentration (MIC) distributions of anti-MTB compounds
2.4 化合物抗结核活性测定
进一步测定了“2.3”项中获得的抑制剂对 Mtb 的 MIC 值,样品的 MIC 值分布情况如图 2 所示。从图中可以看出,绝大多数样品对 Mtb的抑制活性较弱,MIC 值大于 20 μg/ml 的有271 个,占比 51.33%;MIC 值为 20 μg/ml 的样品有 113 个,占比 21.40%;MIC 值为 10 μg/ml 的样品有 77 个,占比 14.58%。MIC 值小于 10 μg/ml的化合物有 67 个,占比 12.69%,其中 MIC 值为 5 μg/ml 的样品有 27 个,2.5 μg/ml 的样品有 9 个,1.25 μg/ml 的样品有 13 个,≤ 0.625 μg/ml 样品有 18 个。
2.5 化合物对模式菌株的抑制活性
由于获得的活性样品较多,为了降低工作量,我们只对具有较强抗结核活性(MIC 值≤ 5 μg/ml)的样品开展了后续研究。这些样品中共有 24 个化合物分别对 Mau、Msm、Mma 和 Cgl 表现出抑制活性。从表 2 中可以看出,对 Mau、Msm、Mma 和 Cgl 具有抑制活性的样品分别有 22 个(32.84%)、10 个(14.93%)、12 个(17.91%)和 6 个(8.96%)。其中抑菌活性与抗结核活性相当(MIC 值差异≤ 4倍)样品的数目分别为 16 个(72.73%),5 个(50%),7 个(58.33%)和 3 个(50%)。这些活性样品中,只有 MCC53 对所有菌株都表现出抑制活性。
同时,我们也对 Mtb 及本研究中所采用的模式菌株测试药物敏感性需要耗费的时间做了统计图,如图 3 所示。从中可以看出,采用模式菌株 Mau 和 Cgl 开展抑制剂筛选研究耗时最短,仅需 12 h 就能获得实验结果。结合表 2 可知,相对于其余 3 种模式菌株,采用 Mau 开展抗结核抑制剂筛选研究能够快速获得具有潜在研究价值的先导物样品。
3 讨论
本实验室长期从事抗结核药物筛选研究,针对 Mtb 关键酶 GuaB2、Dxs、Alr、IspD、Icl 和 Sd 等建立了分子水平的抑制剂高通量筛选模型并对本单位化合物库样品进行筛选,获得了 10 余个具有抗结核活性的酶抑制剂[19-24],而多数酶抑制剂并不具有抗菌活性。出现这种情况的主要原因有两点:首先是 Mtb 关键酶作为药物靶标的理论基础有待验证,其次酶抑制剂能否穿过 Mtb 复杂的细胞壁、细胞膜结构是其能否发挥抗菌作用的重要因素。而细胞水平的抑制剂筛选模型是以菌株的存活或生长为指标,从而直接获得具有抑菌活性的化合物样品。到目前为止几乎所有的抗结核药物(或其先导物)都是通过这种筛选方式得到的[7]。这也表明在全菌水平筛选抑制剂更有可能获得具有成药前景的先导物,同时也能发现具有全新作用机制的化合物。
先导物发现研究是药物开发过程中极为重要的环节,而先导物的质量直接关系到化合物最终能否被开发为药物[25]。多年来,本实验室采用分子水平的高通量筛选模型对本单位化合物库的 15 万样次合成样品进行筛选,获得了多个具有抗结核活性的样品,但是药物靶向筛选方法的局限性使得我们不可能全面掌握化合物库中样品的抗结核活性,也不可能对这些数据进行深入挖掘。因此有必要采用细胞水平的筛选模型对这些样品进行再次筛选。利用 Mtb 筛选抗结核化合物耗时耗力、且严重威胁着实验人员的健康,而采用模式菌株开展研究不仅能降低实验者被感染的风险,还能提高研究效率。不同模式菌株与 Mtb 的遗传背景、毒力及感染能力存在很大差异,采用不同模式菌株从同一化合物库中筛选获得活性化合物的阳性率是不一致的[15]。为了最大限度地获得具有抗结核活性的样品,我们开展了本项研究。通过比较 Mau、Msm、Mma 及 Cgl 对化合物库部分样品中筛选得到的抗结核化合物的敏感性差异,发现 Mau对这些样品的敏感性最高。我们可以推断出基于 Mau 建立细胞水平的抑制剂筛选模型开展实验,能够快速发现化合物库中近 3 成的抗结核样品,而其中 7 成样品的抗结核活性能被准确预测。
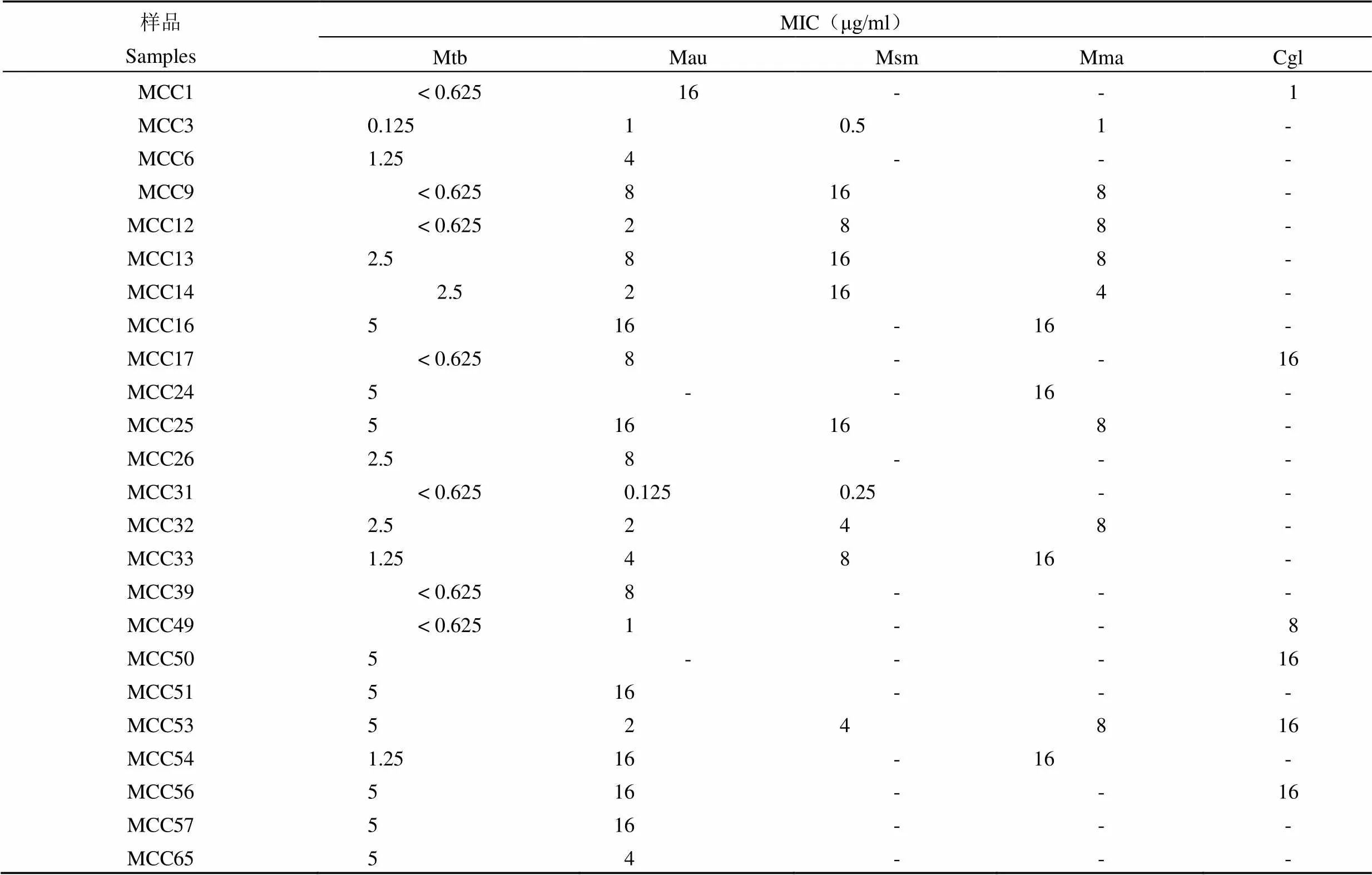
表 2 抗结核化合物对模式菌株的抑制活性
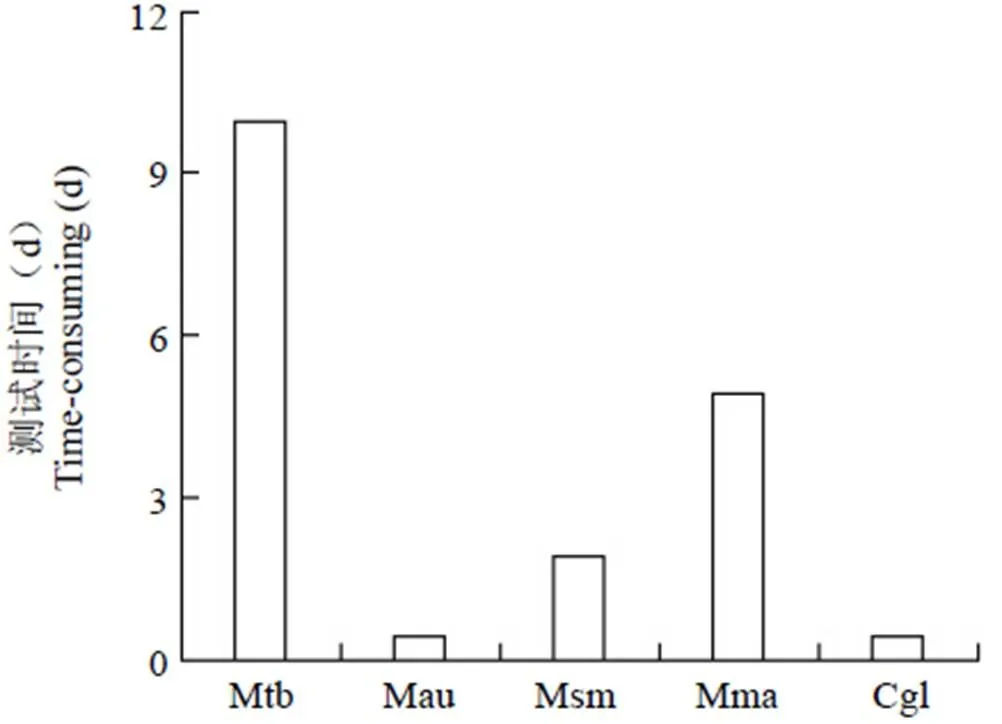
图 3 Mtb 及模式菌株测定药物敏感性耗时情况
Figure 3 Time for determining drug sensitivity in Mtb and its model strains
本研究中我们获得了 500 余个具有抗结核活性的化合物样品,在此基础上我们将对这些样品进行结构分析、细胞水平的毒性测试,排除与现有抗结核药物结构类似的化合物和毒性较大的样品,进一步测定剩余样品对临床耐药 Mtb 的抑制活性,最终获得结构新颖、毒性较低、对耐药 Mtb 具有抑制活性的苗头化合物;同时将采用Mau 建立细胞水平的抑制剂筛选模型对化合物库剩余 10 万样品进行筛选,从而掌握本单位样品库全部样品的抗结核活性情况,最终建立独具特色的抗结核活性样品库,为开发抗结核药物奠定基础。
[1] World Health Organization. Global tuberculosis report 2018. World Health Organization, 2018. https://apps.who.int/iris/handle/10665/ 274453.
[2] Kakkar AK, Dahiya N. Bedaquiline for the treatment of resistant tuberculosis: promises and pitfalls. Tuberculosis (Edinb), 2014, 94(4): 357-362.
[3] Sotgiu G, Pontali E, Centis R, et al. Delamanid (OPC-67683) for treatment of multi-drug-resistant tuberculosis. Expert Rev Anti Infect Ther, 2015, 13(3):305-315.
[4] Tadolini M, Lingtsang RD, Tiberi S, et al. Cardiac safety of extensively drug-resistant tuberculosis regimens including bedaquiline, delamanid and clofazimine. Eur Respir J, 2016, 48(5):1527-1529.
[5] Hoffmann H, Kohl TA, Hofmann-Thiel S, et al. Delamanid and bedaquiline resistance in mycobacterium tuberculosis ancestral Beijing genotype causing extensively drug-resistant tuberculosis in a tibetan refugee. Am J Respir Crit Care Med, 2016, 193(3):337-340.
[6] Payne DJ, Gwynn MN, Holmes DJ, et al. Drugs for bad bugs: confronting the challenges of antibacterial discovery. Nat Rev Drug Discov, 2007, 6(1):29-40.
[7] Islam MM, Hameed HMA, Mugweru J, et al. Drug resistance mechanisms and novel drug targets for tuberculosis therapy. J Genet Genomics, 2017, 44(1):21-37.
[8] Stanley SA, Grant SS, Kawate T, et al. Identification of novel inhibitors of M. tuberculosis growth using whole cell based high-throughput screening. ACS Chemi Biol, 2012, 7(8):1377-1384.
[9] Tükenmez H, Edström I, Ummanni R, et al. Mycobacterium tuberculosis virulence inhibitors discovered by Mycobacterium marinum high-throughput screening. Sci Rep, 2019, 9(1):26.
[10] Gupta A, Bhakta S, Kundu S, et al. Fast-growing, non-infectious and intracellularly surviving drug-resistant Mycobacterium aurum: a model for high-throughput antituberculosis drug screening. J Antimicrob Chemother, 2009, 64(4):774-781.
[11] Khan A, Sarkar D. A simple whole cell based high throughput screening protocol using Mycobacterium bovis BCG for inhibitors against dormant and active tubercle bacilli. J Microbiol Methods, 2008, 73(1):62-68.
[12] Magnet S, Hartkoorn RC, Székely R, et al. Leads for antitubercular compounds from kinase inhibitor library screens. Tuberculosis (Edinb), 2010, 90(6):354-360.
[13] Gupta A, Bhakta S. An integrated surrogate model for screening of drugs against Mycobacterium tuberculosis. J Antimicrob Chemother, 2012, 67(6):1380-1391.
[14] Namouchi A, Cimino M, Favre-Rochex S, et al. Phenotypic and genomic comparison of Mycobacterium aurum and surrogate model species to Mycobacterium tuberculosis: implications for drug discovery. BMC Genomics, 2017, 18(1):530.
[15] Altaf M, Miller CH, Bellows DS, et al. Evaluation of the Mycobacterium smegmatis and BCG models for the discovery of Mycobacterium tuberculosis inhibitors. Tuberculosis (Edinb), 2010, 90(6):333-337.
[16] Fu LM, Shinnick TM. Understanding the action of INH on a highly INH-resistant Mycobacterium tuberculosis strain using Genechips. Tuberculosis (Edinb), 2007, 87(1):63-70.
[17] Zhang JH, Chung TD, Oldenburg KR. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J Biomol Screen, 1999, 4(2):67-73.
[18] Rastogi N, Labrousse V, Goh KS. In vitro activities of fourteen antimicrobial agents against drug susceptible and resistant clinical isolates of Mycobacterium tuberculosis and comparative intracellular activities against the virulent H37Rv strain in human macrophages. Curr Microbiol, 1996, 33(3):167-175.
[19] Xiong XJ, Zhou S, Yang YH, et al. Establishment and application of a novel high-throughput screening model targeting to inosine monophosphate dehydrogenase for antitubercular drugs. Chin Med Biotechnol, 2011, 6(6):445-449. (in Chinese)
熊小椒, 周爽, 杨延辉, 等. 以次黄嘌呤单核苷酸脱氢酶为靶点的新型抗结核药物高通量筛选模型的建立及应用. 中国医药生物技术, 2011, 6(6):445-449.
[20] Bu HQ, Yang YH, Meng JZ, et al. Establishment and application of a high-throughput screening model targeting to 1-deoxy-d-xylulose-5- phosphate reductoisomerase from Mycobacterium tuberculosis H37Rv. Chin J Antibiot, 2014, 39(6):401-407. (in Chinese)
步洪强, 杨延辉, 蒙建州, 等. 结核分枝杆菌1-脱氧-D-木酮糖-5-磷酸还原异构酶抑制剂高通量筛选模型的建立与应用. 中国抗生素杂志, 2014, 39(6):401-407.
[21] Zhou S, Meng JZ, Guan Y, et al. Establishment and application of a novel high throughput screening model targeting alanine racemase from mycobacterium tuberculosis H37Rv. Chin Med Biotechnol, 2014, 9(2):116-123. (in Chinese)
周爽, 蒙建洲, 关艳, 等. 以丙氨酸消旋酶为靶点的高通量抗结核药物筛选模型的建立及应用. 中国医药生物技术, 2014, 9(2):116- 123.
[22] Lu ZY, Yang YH, Meng JZ, et al. Screening of novel antitubercular drugs targeting IspD. Chin J New Drugs, 2015, 24(17):1947-1953. (in Chinese)
鲁众阳, 杨延辉, 蒙建州, 等. 以IspD为靶点的新型抗结核药物筛选研究. 中国新药杂志, 2015, 24(17):1947-1953.
[23] Liu Y, Zhou S, Deng Q, et al. Identification of a novel inhibitor of isocitrate lyase as a potent antitubercular agent against both active and non-replicating Mycobacterium tuberculosis. Tuberculosis (Edinb), 2016, 97:38-46.
[24]Deng Q, Meng J, Liu Y, et al. IMB-SD62, a triazolothiadiazoles derivative with promising action against tuberculosis. Tuberculosis (Edinb), 2018, 112:37-44.
[25] Keserü GM, Makara GM. The influence of lead discovery strategies on the properties of drug candidates. Nat Revi Drug Discov, 2009, 8(3):203-212.
Study on the feasibility of searching anti-tuberculosis agents using Mycobacterium aureus
MENG Jian-zhou, WANG Xiao, GUAN Yan, XIAO Chun-ling, LIU Yi-shuang
Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
We aim to evaluate the feasibility of screening for anti-tuberculosis agents using(Mau).
Firstly, a phenotypic high-throughput screening model was constructed using(Mtb) H37Rv to screen through sub-pool of our chemical-library for anti-tuberculosis agents, and their minimum inhibitory concentrations (MIC) to Mtb were tested via double broth dilution method. The best surrogate was determined by comparing sensitivities of Mau,(Msm),(Mma) and(Cgl) to compounds with potent anti-tuberculosis activities.
Via the screening model, we obtained 67 compounds with potent anti-tuberculosis activities (MIC ≤5 μg/ml). Among these compounds, 22 (32.84%), 10 (14.93%), 12 (17.91%) and 6 (8.96%) displayed antibacterial activities to Mau, Msm, Mma and Cgl, respectively. Comparing with their anti-tuberculosis activities, 16 (72.73%), 5 (50%), 7 (58.33%) and 3 (50%) of these active compounds demonstrated < 4 times discrepancies in antibacterial potencies respectively.
Among these bacteria, Mau is the most suitable surrogate of Mtb used for searching anti-tuberculosis agents from our chemical library.
;; Phenotypic screening; anti-Mtb agents
LIU Yi-shuang, Email: rememberfrost@163.com
国家自然科学基金(81803412);中国医学科学院医学与健康科技创新工程(2016-I2M-1-013);中央高校基本科研业务费专项资金资助(3332019084)
刘忆霜,Email:rememberfrost@163.com
10.3969/j.issn.1673-713X.2020.04.009
2020-04-06
