2014–2018年河北北方学院第一附属医院呼吸科痰培养细菌的分布及耐药性分析
2020-08-14杨焰刘建华李聪然游雪甫
杨焰,刘建华,李聪然,游雪甫
·论著·
2014–2018年河北北方学院第一附属医院呼吸科痰培养细菌的分布及耐药性分析
杨焰,刘建华,李聪然,游雪甫
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所药理研究室/抗感染药物研究北京市重点实验室(杨焰、李聪然、游雪甫);075000 张家口,河北北方学院第一附属医院呼吸科(刘建华)
分析河北北方学院第一附属医院呼吸科痰培养细菌的分布及耐药性,为临床医师合理选用抗菌药物提供依据。
收集 2014 年 1 月 1 日 – 2018 年 12 月 31 日河北北方学院第一附属医院呼吸科痰培养阳性菌株,采用 BD Phoenix™-100 全自动微生物鉴定药敏分析系统测定菌株对抗菌药物的敏感性,采用 WHONET 5.6 软件对数据进行分析。
共分离出细菌 1268 株,其中革兰氏阴性菌株 1160 株(91.5%),革兰氏阳性菌株 108 株(8.5%)。检出率最高的前五位是肺炎克雷伯菌(15.9%)、铜绿假单胞菌(10.4%)、产酸克雷伯菌(10.4%)、鲍曼不动杆菌(9.8%)、阴沟肠杆菌(8.9%)。革兰氏阴性菌对氨苄西林、头孢唑林、氨苄西林/舒巴坦、阿莫西林/克拉维酸的耐药率较高,分别为 72.2%(255/353)、55.6%(293/527)、47.8%(367/767)、46.8%(252/538),对黏菌素、阿米卡星、美罗培南、亚胺培南的耐药率较低,分别为 3.5%(39/1101)、5.6%(61/1082)、6.4%(68/1065)、7.7%(83/1081)。革兰氏阳性菌以金黄色葡萄球菌占比最高,为38%(41/108),耐甲氧西林葡萄球菌(MRS)的检出率有不断增加的趋势。
2014 – 2018 年河北北方学院第一附属医院呼吸科痰培养细菌主要以革兰氏阴性菌为主,其对抗生素的耐药性呈现出先下降再升高的趋势,MRS 检出率有不断增加的趋势。
呼吸科; 痰培养; 病原菌; 耐药性
医院不同科室患者的病因和疾病的严重程度不同,导致同一医院不同科室的病原菌耐药监测结果会有所差异。呼吸科是医院感染的高发病区,而痰标本是主要的病原菌来源。本研究采用回顾性研究方法,对 2014 – 2018 年河北北方学院第一附属医院(三级甲等)呼吸科痰培养细菌共 1268 株进行分析,了解呼吸科临床分离菌的构成,分析常见病原菌的耐药性及耐药趋势,为临床医师合理选用抗菌药物提供依据。
1 材料与方法
1.1 菌株来源
收集 2014 年 1 月 1 日 – 2018 年 12 月 31 日河北北方学院第一附属医院呼吸科痰培养临床菌株,剔除同一患者重复菌株。
1.2 方法
临床菌株的培养按照《全国临床检验操作规程》操作,菌株的鉴定及药敏实验采用BD Phoenix™-100 全自动微生物鉴定药敏分析系统及配套细菌鉴定和药敏复合板卡,操作方法及判断标准参照美国临床实验室标准化研究协会(CLSI)2019 年文件[1]。检测的临床常用抗生素包括阿莫西林/克拉维酸、氨苄西林、氨苄西林/舒巴坦、哌拉西林、哌拉西林/他唑巴坦、氨曲南、头孢唑林、头孢吡肟、头孢噻肟、头孢他啶、环丙沙星、左氧氟沙星、莫西沙星、阿米卡星、庆大霉素、亚胺培南、美罗培南、黏菌素、四环素、复方新诺明等。质控菌株使用大肠埃希菌 ATCC25922、铜绿假单胞菌 ATCC27853、金黄色葡萄球菌 ATCC25923、粪肠球菌 ATCC29212、肺炎链球菌 ATCC49619。
1.3 统计学处理
统计分析采用 WHONET 5.6 软件。
2 结果
2.1 临床分离株构成
共分离痰标本来源细菌 1268 株,其中革兰氏阴性菌株 1160 株(91.5%),革兰氏阳性菌株108 株(8.5%)。检出率最高的是肺炎克雷伯菌,其次是铜绿假单胞菌、产酸克雷伯菌、鲍曼不动杆菌、阴沟肠杆菌。革兰氏阳性菌株中主要是金黄色葡萄球菌共 41 株(3.2%)(表 1)。不同年份分离的临床菌株,其种类分布及构成存在差异,2014 年共分离细菌 248 株,革兰氏阴性菌为 236 株(95.2%),主要是肺炎克雷伯菌、铜绿假单胞菌、阴沟肠杆菌;2015 年共分离细菌 166 株,革兰阴性菌为155 株(93.4%),主要是阴沟肠杆菌、肺炎克雷伯菌和铜绿假单胞菌;2016 年共分离细菌 180 株,革兰氏阴性菌为 175 株(97.2%),主要是产酸克雷伯菌、肺炎克雷伯菌和鲍曼不动杆菌;2017 年共分离细菌 363 株,革兰氏阴性菌为 320 株(88.2%),主要是肺炎克雷伯菌、鲍曼不动杆菌和产酸肺炎克雷伯菌;2018 年共分离细菌 311 株,革兰氏阴性菌 274 株(88.1%),主要是肺炎克雷伯菌、铜绿假单胞菌和鲍曼不动杆菌(表 1)。相比于革兰氏阴性菌,革兰氏阳性菌的检出率显著降低,为 8.5%,但 2017 – 2018 年间革兰氏阳性菌的检出率比 2014 – 2016 年间显著增加。
2.2 革兰氏阴性菌对常用抗菌药物的耐药分析
去除天然耐药或未检测菌株,革兰氏阴性菌对常用抗菌药物的耐药率及趋势变化如表 2 所示。2014 – 2018 年间革兰氏阴性菌对氨苄西林、头孢唑林、氨苄西林/舒巴坦、阿莫西林/克拉维酸的耐药率较高,分别为 72.2%(255/353)、55.6%(293/527)、47.8%(367/767)、46.8%(252/538),对黏菌素、阿米卡星、美罗培南、亚胺培南的耐药率较低,分别为 3.5%(39/1101)、5.6%(61/1082)、6.4%(68/1065)、7.7%(83/1081)。具体到每一年份,革兰氏阴性菌对氨苄西林、哌拉西林、哌拉西林/他唑巴坦、氨曲南、头孢吡肟、头孢他啶、莫西沙星、庆大霉素、复方新诺明的耐药率变化趋势为 2015 年较 2014 年有所降低,在 2016 年呈现出上升的趋势;对氨苄西林/舒巴坦、头孢唑林、环丙沙星、左氧氟沙星的耐药率在 2016 年降到最低,然而在 2017 – 2018 年间呈现上升的趋势;对头孢噻肟的耐药率呈现出稳定的趋势。总的来说,革兰氏阴性菌对抗生素的耐药率呈现出在 2015 – 2016 年间下降,此后又开始上升的趋势。
2.2.1 肠杆菌科细菌 2014 – 2018 年间大肠埃希菌对氨苄西林/舒巴坦、阿莫西林/克拉维酸、氨苄西林、哌拉西林的耐药率较高,均超过了 80%,分别为 89.5%(68/76)、89.0%(65/73)、88.2%(67/76)、81.6%(62/76),对黏菌素、亚胺培南、美罗培南的耐药率较低,分别为 0.0%(0/76)、1.3%(1/76)、1.3%(1/76)。具体到每一年份,五年间大肠埃希菌对阿莫西林/克拉维酸、氨苄西林、氨苄西林/舒巴坦、哌拉西林、环丙沙星、左氧氟沙星、莫西沙星、庆大霉素、四环素、复方新诺明呈现出“W”型耐药趋势,即耐药率在 2015 年、2017 年下降,而在 2016、2018 年呈现上升趋势;大肠埃希菌对氨曲南、头孢唑林、头孢吡肟、头孢噻肟、头孢他啶的耐药率呈现出在 2015 – 2016 年间下降,此后又开始上升的趋势;对哌拉西林/他唑巴坦、阿米卡星、亚胺培南、美罗培南、黏菌素的耐药率稳定且处于较低水平(表 3)。
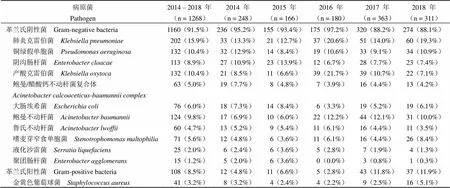
表 1 主要病原菌种类分布及构成
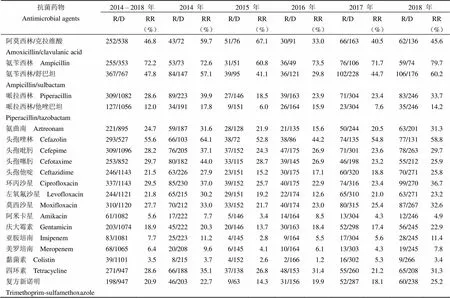
表 2 革兰氏阴性菌对抗菌药物的耐药率
注:R/D:耐药数/检测数;RR:耐药比例。
Notes: R/D: Resistant/detected strains; RR: Resistance rates.
相较于大肠埃希菌,2014 – 2018 年间肺炎克雷伯菌对抗生素的耐药率更低(表 4)。肺炎克雷伯菌对氨苄西林/舒巴坦、阿莫西林/克拉维酸、四环素、哌拉西林的耐药率最高,分别为 60.4%(119/197)、27.1%(51/188)、26.7%(54/202)、25.2%(51/202);对黏菌素、阿米卡星、美罗培南、亚胺培南的耐药率较低,分别为 0.5%(1/202)、1.5%(3/201)、2.0%(4/202)、2.5%(5/202)。
2014 – 2018 年肺炎克雷伯菌对阿莫西林/克拉维酸、氨苄西林/舒巴坦、哌拉西林、哌拉西林/他唑巴坦、氨曲南、头孢唑林、头孢吡肟、头孢噻肟、头孢他啶、左氧氟沙星、莫西沙星、庆大霉素的耐药率呈现出在 2015 – 2016 年间下降,此后又开始上升的趋势,尤其是肺炎克雷伯菌对氨苄西林/舒巴坦的耐药率在 2014 – 2016 年间从 69.7%(23/33)降至 18.9%(7/37),然而在 2018 年又逐渐升高至 87.3%(48/55)(表 4)。
阴沟肠杆菌对抗生素的耐药率较低,耐药率大部分在 10.6% ~ 24.2%,对美罗培南、亚胺培南、阿米卡星、黏菌素、哌拉西林/他唑巴坦的耐药率分别为 0.9%(1/113)、0.9% (1/113)、1.8%(2/113)、2.7%(3/113)、3.9%(4/103)(表 5)。
2.2.2 非发酵革兰氏阴性菌 2014 – 2018 年间铜绿假单胞菌耐药率最高的抗生素是莫西沙星、氨曲南、头孢吡肟、左氧氟沙星和环丙沙星,耐药率分别为 50.4%(58/115)、38.9%(51/131)、33.1%(40/121)、31.7%(38/120)及 30.5%(40/131);对黏菌素、阿米卡星、美罗培南的耐药率最低,分别为 1.7%(2/119)、6.1%(8/132)、10.8%(13/120)。具体到每一年份,2015 – 2018 年间铜绿假单胞菌对哌拉西林、哌拉西林/他唑巴坦、头孢他啶、环丙沙星、阿米卡星、庆大霉素、亚胺培南、美罗培南的耐药率呈现出下降趋势或维持在较低水平;对氨曲南、左氧氟沙星的耐药率呈现出先下降后上升的趋势;2014 – 2016 年间未检出黏菌素耐药铜绿假单胞菌,但在 2017、2018 年各检出 1 例(表 6)。
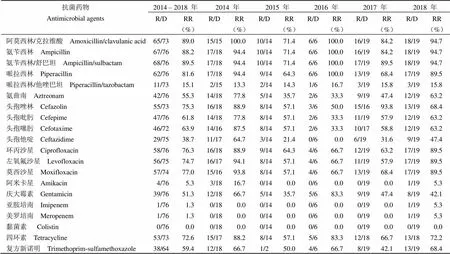
表 3 大肠埃希菌的耐药率及变化趋势
注:R/D:耐药数/检测数;RR:耐药比例。
Notes: R/D: Resistant/detected strains; RR: Resistance rates.
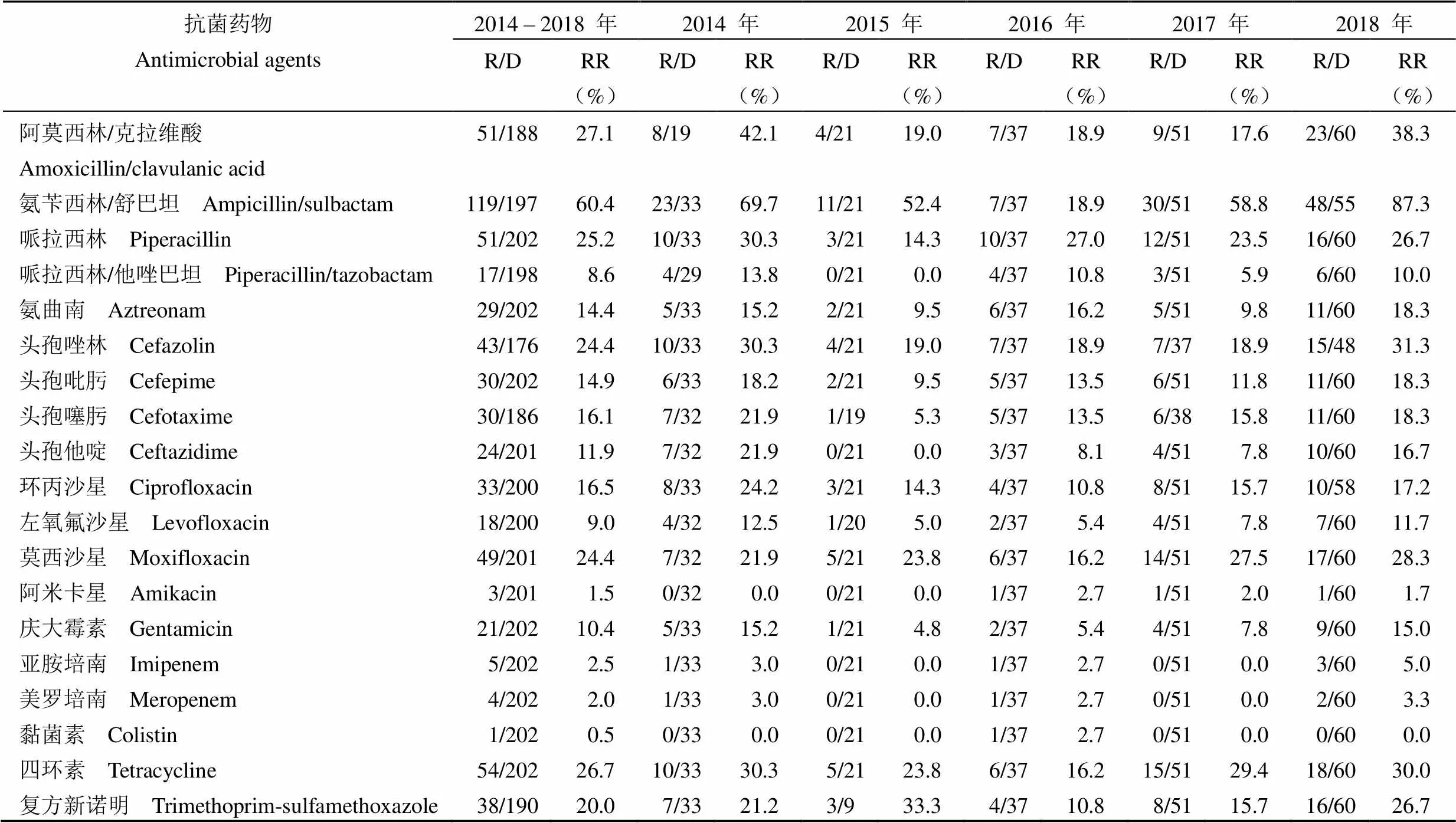
表 4 肺炎克雷伯菌的耐药率及变化趋势
注:R/D:耐药数/检测数;RR:耐药比例。
Notes: R/D: Resistant/detected strains; RR: Resistance rates.
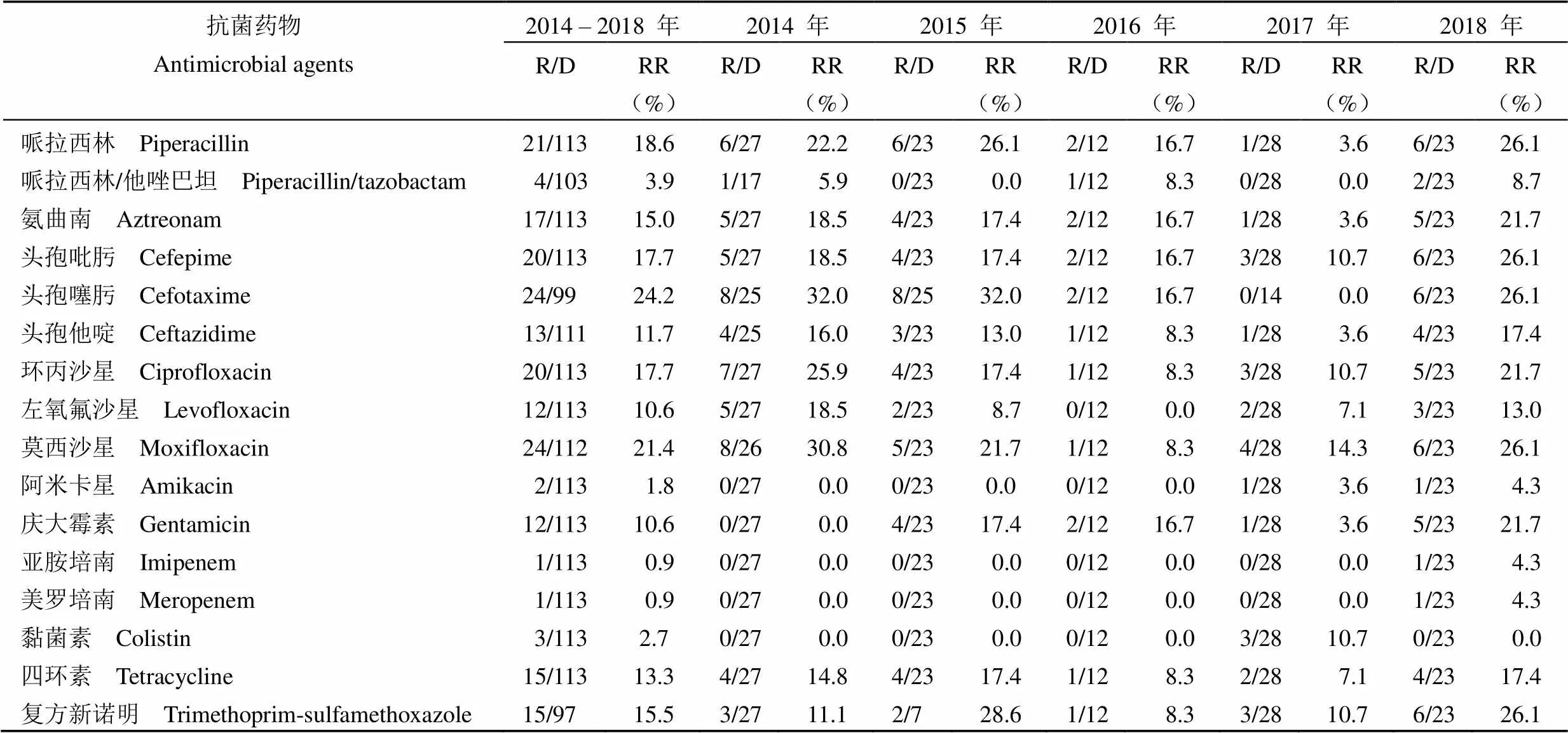
表 5 阴沟肠杆菌的耐药率及变化趋势
注:R/D:耐药数/检测数;RR:耐药比例。
Notes: R/D: Resistant/detected strains; RR: Resistance rates.
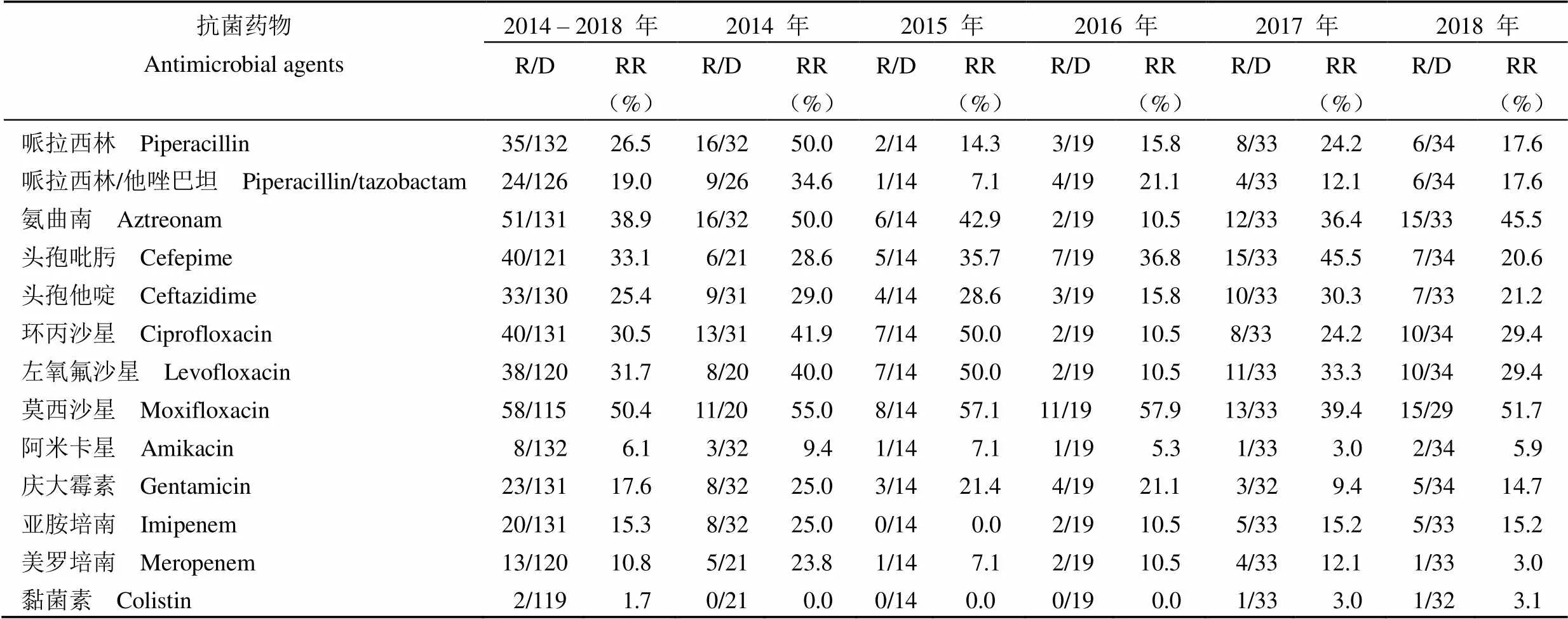
表 6 铜绿假单胞菌的耐药率及变化趋势
注:R/D:耐药数/检测数;RR:耐药比例。
Notes: R/D: Resistant/detected strains; RR: Resistance rates.
2014 – 2018 年间鲍曼不动杆菌耐药率最高的抗生素是头孢噻肟、哌拉西林、庆大霉素、头孢吡肟及四环素,耐药率分别为 47.2%(50/106)、30.6%(38/124)、30.6%(38/124)、25.0%(31/124)及 25.0%(31/124);对黏菌素敏感,耐药率为 0.0%(0/124)。整体来看,五年间鲍曼不动杆菌对抗生素的耐药性维持在较低水平,但对庆大霉素的耐药率呈现出先下降后上升的趋势(表 7)。
2.3 耐甲氧西林葡萄球菌耐药率分析
该院呼吸科痰细菌革兰氏阳性菌的检出率较低,其中以葡萄球菌属占比最高。2014 – 2015 年耐甲氧西林葡萄球菌(MRS)的检出率较低,虽然2016 年 MRS 检出率很高,但葡萄球菌检出率很低,因此不足以说明其耐药性高低,而 2017 – 2018 年 MRS 检出率分别为 64.7%、51.7%,整体来看 MRS 检出率有不断增加的趋势(表 8)。
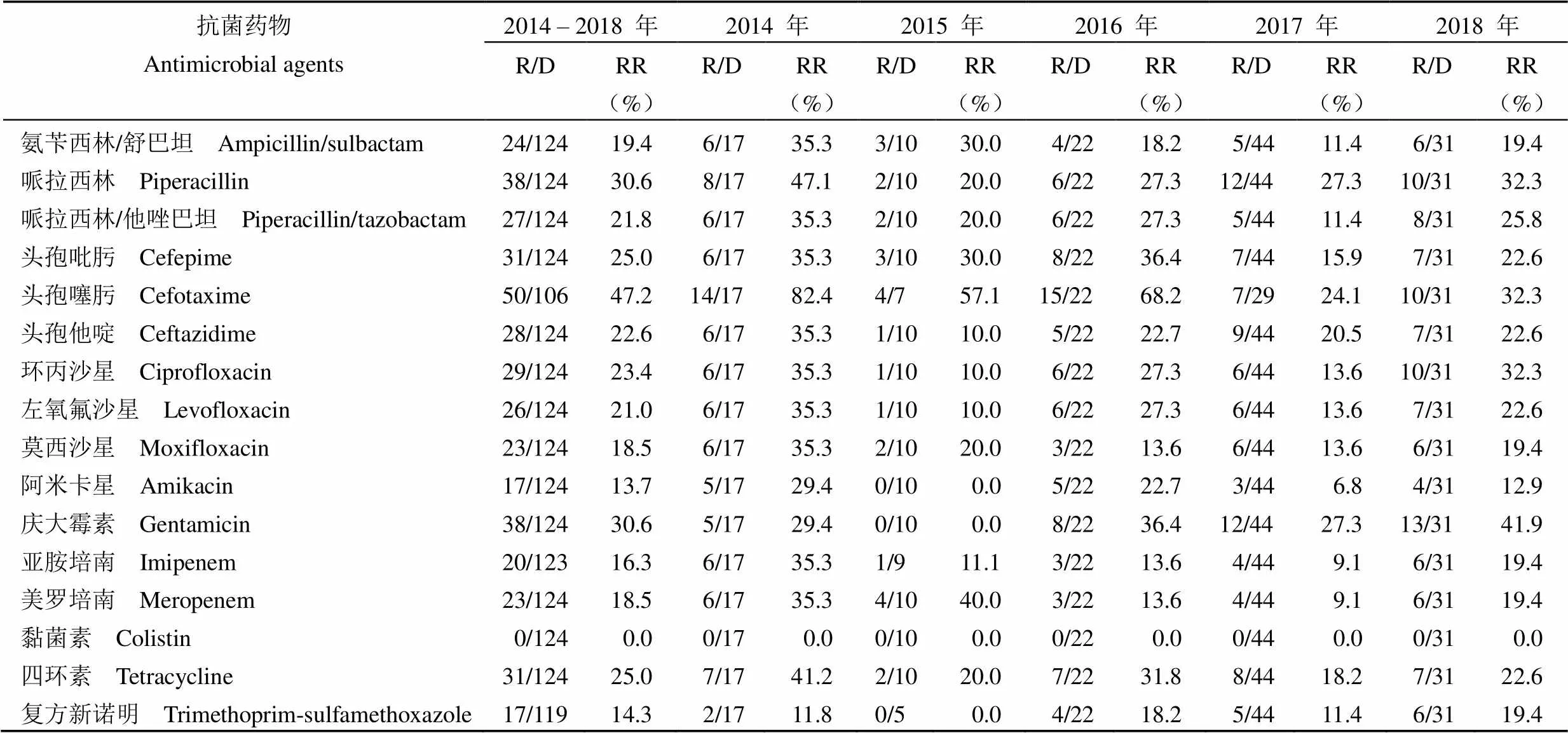
表 7 鲍曼不动杆菌的耐药率及变化趋势
注:R/D:耐药数/检测数;RR:耐药比例。
Notes: R/D: Resistant/detected strains; RR: Resistance rates.
3 讨论
呼吸道与外界环境直接联系,呼吸科患者尤其是重症患者频繁接受侵入性操作,如插管、呼吸机,以及大量广谱抗生素的使用等,发生感染的几率比其他科室患者要大,而痰标本是呼吸科主要的病原菌分离来源,因此本研究对 2014 – 2018 年河北北方学院第一附属医院呼吸科痰培养细菌的分布及耐药性进行分析,有利于为临床医师合理选用抗菌药物提供依据。
分离出的 1268 株痰标本来源细菌中,革兰氏阴性菌 1160 株(91.5%),革兰氏阳性菌 108 株(8.5%)。2018 年中国 CHINET 耐药监测数据显示,革兰氏阴性菌占比为 71.8%,革兰氏阳性菌占比为 28.2%[2],相比之下本次监测中革兰氏阴性菌比例偏高,为 91.5%,可能与呼吸科以革兰氏阴性菌感染为主有关。本次监测分离率最高的前几位是肺炎克雷伯菌、铜绿假单胞菌、产酸克雷伯菌、鲍曼不动杆菌、阴沟肠杆菌、大肠埃希菌。而 2018 年中国 CHINET 耐药监测显示革兰阴性菌检出排序是大肠埃希菌、肺炎克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌、阴沟肠杆菌及嗜麦芽窄食假单胞菌[3]。2005 – 2014 年 CHINET 细菌耐药性监测显示,全国呼吸道标本检出率排序是鲍曼不动杆菌、铜绿假单胞菌、金黄色葡萄菌、大肠埃希菌、嗜麦芽窄食单胞菌[4]。凌宙贵等[5]报道呼吸科革兰氏阴性菌检出排序为大肠埃希菌、铜绿假单胞菌、肺炎克雷伯菌、葡萄球菌属、鲍曼不动杆菌。这提示不同研究范围的病原菌分布可能会有差异。以往的研究也发现,同一单位不同时间段、不同科室、不同标本类型来源分离的菌株对临床常用抗菌药物的耐药率存在差异[6-7]。因此,对于感染几率较大的科室有必要进行针对性的细菌耐药监测,这样有利于特定科室抗菌药物的精准使用。

表 8 耐甲氧西林葡萄球菌的检出率及变化趋势
大肠埃希菌对青霉素类药物耐药率较高,对大部分药物(氨苄西林/舒巴坦、阿莫西林/克拉维酸、氨苄西林、哌拉西林)的耐药率均超过了 80%,然而对哌拉西林/他唑巴坦的耐药性较低,五年耐药率为 15.1%,各年耐药率也稳定在 13.3% ~ 16.7%;大肠埃希菌对喹诺酮类药物、四环素、头孢类药物(除头孢他啶)、复方新诺明的耐药率在 60% ~ 70% 之间,头孢他啶的耐药率为 38.7%;大肠埃希菌对氨基糖苷类抗生素如庆大霉素、阿米卡星耐药率分别为 55.3% 和5.3%,对阿米卡星敏感性较高。因此,建议临床可选用哌拉西林/他唑巴坦、头孢他啶、阿米卡星等药物治疗大肠埃希菌感染。
肺炎克雷伯菌虽然检出率最高,但耐药率比大肠埃希菌低,整体上也低于全国监测水平,尤其是在全国肺炎克雷伯菌对碳青霉烯类抗生素耐药率逐年增加的形势下[3],这可能与该院对特殊抗生素的管控有关。但 2014 – 2018 年间,该院呼吸科肺炎克雷伯菌对氨苄西林/舒巴坦耐药率最高,为 60.4%,高于全国的监测水平(49%),其耐药率随年份呈现出先降低后增加的趋势,需要警惕其进一步增加的可能[2]。肺炎克雷伯菌是呼吸科感染常见的条件致病菌,易在免疫力降低时引发肺炎、败血症、尿路感染和软组织感染等。然而近年来一种新的变体——高毒力肺炎克雷伯菌(hypervirulent,hvKp)的报道不断增加。相较于肺炎克雷伯菌,高毒力肺炎克雷伯菌的药物敏感性更高,但其易导致患者甚至是健康成年人发生严重的转移性和侵袭性感染,如肝脓肿、眼内炎、脑膜炎[8-9]。由于高毒力肺炎克雷伯菌的超高毒力以及缺乏检测的“金标准”,临床科室应注意高毒力肺炎克雷伯菌的检测及其感染的确诊,在治疗高毒力肺炎克雷伯菌感染尤其是转移性感染时,如选择无法透过血脑屏障的抗生素可能会严重影响治疗效果。
对多种抗菌药物天然耐药是非发酵革兰氏阴性菌的重要特点。铜绿假单胞菌是这类菌的代表菌株。在本次监测中,铜绿假单胞菌位于本次监测检出率第二位,对莫西沙星的耐药率最高,为 50.4%,其次是氨曲南(38.9%)、头孢吡肟(33.1%)、左氧氟沙星(31.7%)、环丙沙星(30.5%),对其他所监测药物如哌拉西林、头孢他啶、哌拉西林/他唑巴坦、庆大霉素、亚胺培南、美罗培南、阿米卡星、黏菌素的耐药率均低于 30%,建议临床可选用此类药物治疗铜绿假单胞菌感染。鲍曼不动杆菌对头孢噻肟的耐药率最高,为 47.2%,对哌拉西林、庆大霉素的耐药率均为 30.6%,对其他所监测药物耐药率均低于 30%。然而相比于肠杆菌科革兰氏阴性菌,非发酵革兰氏阴性菌对培南类药物耐药率更高,例如大肠埃希菌、肺炎克雷伯菌、阴沟肠杆菌对亚胺培南的耐药率分别为 1.3%、2.5%、0.9%,对美罗培南的耐药率分别为 1.3%、2.0%、0.9%,而铜绿假单胞菌、鲍曼不动杆菌对亚胺培南的耐药率为 15.3%、16.3%,对美罗培南的耐药率为 10.9%、18.5%,这提示临床呼吸科需要注意非发酵革兰氏阴性菌的碳青霉烯类药物耐药监测。但该院检出率低于 2018 年中国 CHINET 耐药监测数据(77.1%、78.1%)[3],也低于陆小琴和牛司强[10]的报道,他们发现 2015 – 2017 年某三级医院呼吸内科铜绿假单胞菌、鲍曼不动杆菌对亚胺培南的耐药率分别为 25.7%、73.0%,对美罗培南的耐药率分别为 14.0%、73.0%。
总的来说,该院呼吸科革兰氏阴性菌对氨苄西林、氨苄西林/舒巴坦、哌拉西林、哌拉西林/他唑巴坦、氨曲南、头孢唑林、头孢吡肟、头孢他啶、环丙沙星、左氧氟沙星、莫西沙星、庆大霉素、复方新诺明的耐药率在 2015 – 2016 年间呈现出下降趋势,在 2017 后又开始呈现增加的趋势;对黏菌素、阿米卡星、美罗培南、亚胺培南的耐药率较稳定且处于较低水平,这是因为从 2015 年开始该院加强了手卫生和接触隔离等院感防控措施,同时在应用碳青霉烯类药物前需要有会诊和特殊使用抗菌药物申请,经会诊专家研究后再考虑是否应用,这可能是细菌耐药率在 2015 – 2016 年间下降的主要原因。然而在 2017 年以后,耐药率有上升的趋势,提示对抗菌药物的管控措施在一定时间范围内是有效的,但需要一直坚持并不断改进。
虽然该院呼吸科主要以革兰氏阴性菌为主(91.5%),革兰氏阳性菌亦不容忽视。近年来,革兰氏阳性菌的检出率逐渐增加,其中以葡萄球菌属占比最高,药敏试验显示 MRS 具有不断增加的趋势,医务人员应重视葡萄球菌的感染控制工作。
[1] Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. 29th ed. CLSI supplement M100. Wayne, PA: Clinical and Laboratory Standards Institute, 2019:32-54. https://clsi.org/media/2663/m100ed29_sample.pdf.
[2] Hu FP, Guo Y, Zhu DM, et al. CHINET surveillance of bacterial resistance in China: 2018 report. Chin J Infection Chemotherapy, 2020, 20(1):1-10. (in Chinese)
胡付品, 郭燕, 朱德妹, 等. 2018年CHINET中国细菌耐药性监测. 中国感染与化疗杂志, 2020, 20(1):1-10.
[3] Hu F, Guo Y, Yang Y, et al. Resistance reported from China antimicrobial surveillance network (CHINET) in 2018. Eur J Clin Microbiol Infect Dis, 2019, 38(12):2275-2281.
[4] Yang Q, Yu YS, Lin J, et al. Distribution and antimicrobial resistance profile of common pathogens isolated from respiratory secretion in CHINET Antimicrobial Resistance Surveillance Program, 2005-2014. J Infect Chemother, 2016, 16(5):541-550. (in Chinese)
杨青, 俞云松, 林洁, 等. 2005-2014年CHINET呼吸道分离菌耐药性监测. 中国感染与化疗杂志, 2016, 16(5):541-550.
[5] Ling ZG, Liu B, Liu W, et al. Distribution and drug resistance of pathogens causing lower respiratory tract infections in ICU and respiratory department: a comparative study. Chin J Nosocomiol, 2014, 24(1):50-52. (in Chinese)
凌宙贵, 刘滨, 刘卫, 等. ICU与呼吸科下呼吸道感染病原菌分布及耐药率比较分析. 中华医院感染学杂志, 2014, 24(1):50-52.
[6] Zhao SP, Jiang MJ, Chen X. Drug resistance analysis of Escherichia coli isolated from different specimens in 2017. Chin J Clin Lab Manag (Electronic Ed), 2019, 7(4):226-229. (in Chinese)
赵书平, 姜梅杰, 陈霞. 2017年院内不同标本来源的大肠埃希菌耐药性分析. 中华临床实验室管理电子杂志, 2019, 7(4):226-229.
[7] Yan L, Wang SL, Xu LL, et al. Clinical distribution and heterogeneity of antimicrobial resistance of Pseudomonas aeruginosa. Chin J Infect Control, 2018, 17(3):230-234. (in Chinese)
颜令, 王淑玲, 徐兰兰, 等. 铜绿假单胞菌临床分布及耐药性的不均一性. 中国感染控制杂志, 2018, 17(3):230-234.
[8] Liu YC, Cheng DL, Lin CL. Klebsiella pneumoniae liver abscess associated with septic endophthalmitis. Arch Intern Med, 1986, 146(10):1913-1916.
[9] Russo TA, Marr CM. Hypervirulent Klebsiella pneumoniae. Clin Microbiol Rev, 2019, 32(3):e00001-19.
[10] Lu XQ, Niu SQ. Surveillance of bacterial resistance in respiratory department of a grade three hospital from 2015 to 2017. World Notes Antibiot, 2018, 39(6):540-543. (in Chinese)
陆小琴, 牛司强. 2015 - 2017年某三级医院呼吸内科细菌耐药性监测. 国外医药(抗生素分册), 2018, 39(6):540-543.
Clinical distribution and drug resistance profile of sputum cultured bacteria in the respiratory department of the First Affiliated Hospital of Hebei North University from 2014 to 2018
YANG Yan,LIU Jian-hua, LI Cong-ran, YOU Xue-fu
Beijing Key Laboratory of Antimicrobial Agents, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China (YANG Yan, LI Cong-ran, YOU Xue-fu); Department of Respiratory Medicine, The First Affiliated Hospital of Hebei North University, Zhangjiakou 075000, China (LIU Jian-hua)
We aim to analyze the distribution and drug resistance profile of sputum cultured bacteria in the respiratory department of the First Affiliated Hospital of Hebei North University, and provide reference for clinical empirical treatment and rational use of antibiotics.
Sputum culture positive strains from January 1, 2014 to December 31, 2018 in the respiratory department of the First Affiliated Hospital of Hebei North University were collected, and drug susceptibility assay was detected by BD Phoenix™-100 Automated Microbiology System. The data were analyzed using WHONET 5.6 software.
A total of 1268 strains were isolated, of which 91.5% were gram-negative strains, and 8.5% were gram-positive strains. The top five bacteria were(15.9%),(10.4%),(10.4%),(9.8%) and(8.9%). Gram-negative bacteria have high resistance rate to ampicillin, cefazolin, ampicillin/sulbactam, amoxicillin/clavulanic acid, being 72.2% (255/353), 55.6% (293/527), 47.8% (367/767) and 46.8% (252/538), respectively. And the resistance rate to colistin, amikacin, meropenem, and imipenem was as low as 3.5% (39/1101), 5.6% (61/1082), 6.4% (68/1065) and 7.7% (83/1081), respectively. The detection rate of gram-positive bacteria was low, withof the highest proportion (38%, 41/108), but the detection rate of methicillin-resistant staphylococcus (MRS) was increasing.
The sputum cultured bacteria in the respiratory department of the First Affiliated Hospital of Hebei North University from 2014 to 2018 are mainly gram-negative bacteria. The resistance of gram-negative bacteria to antibiotics decreases first, then increases, with the detection rate of MRS being increasing.
Respiratory department; Sputum culture; Pathogen; Drug resistance
LIU Jian-hua, Email: l_jianhua1979@126.com; LI Cong-ran, Email: cong5885@aliyun.com
“重大新药创制”国家科技重大专项(2019ZX09721-001);河北省科技计划项目(162777297)
刘建华,Email:l_jianhua1979@126.com;李聪然,Email:cong5885@aliyun.com
10.3969/j.issn.1673-713X.2020.04.008
2020-02-21
