高效抗肿瘤药物烟曲霉素的分离纯化及杂质分析
2020-08-14李建宋李亚王继栋郝之奎薛长艳
李建宋,李亚,王继栋,郝之奎,薛长艳
·论著·
高效抗肿瘤药物烟曲霉素的分离纯化及杂质分析
李建宋,李亚,王继栋,郝之奎,薛长艳
318000 浙江,台州职业技术学院应用生物技术研究所(李建宋、郝之奎、薛长艳);318000 台州,浙江海正药业股份有限公司(李亚);313000 浙江,湖州师范学院生命科学学院(王继栋)
开发一种高纯度烟曲霉素的分离纯化工艺,并对烟曲霉素中的主要杂质进行分离纯化、结构鉴定。
发酵液采用全料液萃取,以烟曲霉素收率为指标筛选最佳萃取溶剂,优化萃取条件,以甲醇和二氯甲烷混合溶液进行结晶,通过 HPLC 对烟曲霉素晶体中的主要杂质进行分离纯化,并采用核磁共振和质谱分析鉴定杂质结构。
以甲基叔丁基醚为萃取溶剂得到的烟曲霉素收率最高,当甲基叔丁基醚:发酵液体积比为 2:1 时,萃取收率大于 85%,再经过两次结晶可以得到纯度 95% 以上的烟曲霉素晶体,分离并鉴定了烟曲霉素晶体中的两个主要杂质。
通过对烟曲霉素提取工艺研究,确定了较优的工艺条件,该方法具有易操作、纯度高、收率高、成本低的特点,适合工业化生产,烟曲霉素中两个主要杂质是烟曲霉素类似物,通过杂质鉴定为烟曲霉素质量控制和安全性评价提供支持。
烟曲霉素; 分离纯化; 杂质; 结构鉴定
烟曲霉素(fumagillin)是从烟曲霉菌的发酵培养液中首次分离得到的具有多种生物活性的代谢产物[1-2]。最初用于治疗蜜蜂和鱼类的微孢子虫病,这也是当前治疗蜜蜂微孢子虫病的唯一有效药[3-4]。1990 年,Ingber等[5]发现烟曲霉素能抑制肿瘤血管再生,从而阻断肿瘤周围血液供给,达到治疗癌症的作用,其作用机制是在体内共价修饰甲硫氨酸氨肽酶-2(MetAP-2)活性位点中的 His-231,使酶失活,进而特异性地抑制血管内皮细胞的生长和增殖,且作用方式是不可逆的。近几年来研究发现,烟曲霉素及其半合成衍生物 TNP-470 和 CKD-732 能减少食物吸收、体重、脂肪量和脂肪细胞的大小,是治疗肥胖症的潜在药物[6];烟曲霉素的半合成衍生物 TNP-470、PPI-2458 和 CKD-732 已用于治疗人类癌症的临床试验,通过以 MetAP-2 为作用靶标破坏肿瘤血管[7-8]。
目前,关于烟曲霉菌产生次级代谢产物烟曲霉素及其衍生物的优化培养方法,仅有很少的报道,并且烟曲霉素效价低,很难用于工业化生产或应用[9-10]。国内外对产烟曲霉素菌株研究较多的为。2003 年,Yang 等[11]针对NRRL 2436 菌株,对其培养基进行了碳氮源的优化,优化后的培养基较初始培养基产烟曲霉素能力提高了 15 倍。同年,Yang 等[12]通过在NRRL 2346 菌株的发酵培养基中添加 1.5% 的羧甲基纤维素或 0.3% 羧聚乙烯,使菌体发酵形态从单一大团变成细小颗粒状,稳定了发酵的重复性,进而使效价提高 3 ~4 倍(150 ~ 240 mg/L)。然而,是致病菌株,能够引起支气管肺曲霉菌病和侵袭性肺曲霉病等疾病,2010 年后,非致病性菌株成为产烟曲霉素的替代菌株。Barboráková 等[13]于 2012 年研究了不同葡萄糖浓度、不同培养条件对FCB353 菌株产烟曲霉素的影响,发现添加 1% 葡萄糖的矿物盐培养基,22 ℃静态培养 4 d 为最佳合成烟曲霉素条件,效价达到 82.5 mg/L。
关于高纯度烟曲霉素提取工艺的研究报道较少。薛晓峰等[14]报道了一种用大孔树脂吸附获得烟曲霉素粗提物的方法,但是该方法生产周期长,烟曲霉素易降解,并且烟曲霉素溶解性较差,大孔树脂上样困难。因此,亟需开发简单高效的烟曲霉素提取和纯化工艺,实现烟曲霉素产品的市场化。
本研究团队筛选得到一株具有自主知识产权的烟曲霉素产生菌,通过选育优化获得一株高产菌株1516,烟曲霉素效价可以稳定在 1100 mg/L,适合产业化应用,因此本研究对烟曲霉素提取工艺进一步研究开发,并对影响产品质量的主要杂质进行分析研究,为烟曲霉素质量标准的建立及安全性评价奠定基础。
1 材料和方法
1.1 材料
1.1.1 菌株 原始菌株是一株青霉(保藏号 CGMCC No.14144),由本实验室保存。原始菌株经诱变选育、配方优化得到烟曲霉素高产菌株1516。烟曲霉素标准品纯度 99.99%,由浙江海正药业股份有限公司提供。
1.1.2 试剂及仪器 核磁共振仪 Bruker Avance III 400 MHz 购自德国 Bruker 公司;旋转蒸发仪 REC-2000 购自上海亚荣生化仪器厂;高效液相色谱 Agilent 1260 购自美国 Agilent 公司;色谱柱为 HALO C18,规格 4.6 mm × 150 mm,粒径为2.7 μm;液质联用(LC-MS):Agilent1260 液相系统与 Agilent-6540 QTOF 质谱系统联用;色谱级甲醇、乙腈等试剂购于美国 Merck 公司;分析级正庚烷、正己烷、乙酸乙酯、丙酮、甲醇、二氯甲烷等试剂购于杭州化学试剂公司。
1.2 方法
1.2.1 培养基及培养方法 斜面培养基配方(g/L):马铃薯 200,葡萄糖 20,琼脂 20,pH(6.0 ± 0.1)。高压蒸汽121 ℃灭菌20 min,待培养基冷却至 50 ~ 60 ℃摆放斜面,在超净工作台使用无菌接种环接种一环孢子,涂布均匀后置于 25 ℃避光培养 3 ~ 5 d。
种子培养基配方(g/L):葡萄糖 10,淀粉 10,黄豆饼粉 10,酵母抽提粉 5,碳酸钙 15,硫酸镁 1.5,硫酸二氢钾 1,pH(6.0 ± 0.1)。摇瓶装液量为 30 ml/瓶,高压蒸汽 121 ℃灭菌20 min。孢子接种量为 105~ 106CFU/ml,培养温度为(25 ± 1)℃,250 r/min,摇床振荡培养 24 h。
发酵培养基配方(g/L):蔗糖 80,糊精 20,甘油 40,酵母抽提粉 5,酵母粉 10,酵母膏 10,硫酸镁 1.5,硫酸二氢钾 1,碳酸钙 30,pH(6.0 ± 0.1),在 50 L 发酵罐中投入 30 L 的发酵培养基,并添加 0.05%(体积百分比)泡敌作为消泡剂,121 ℃蒸汽灭菌20 min,待冷却至 25 ℃后,移入 3 L种子液,培养温度为(25 ± 1)℃,搅拌转速 200 r/min,通氧量 1.0 vvm(每分钟通气量与罐体实际料液体积的比值),培养 120 h 后得烟曲霉素发酵液。
1.2.2 烟曲霉素提取纯化
1.2.2.1 烟曲霉素分析方法 标准品配制:精确称取 20 mg 纯度 99.99% 的烟曲霉素标准品溶解于 20 ml 乙腈,超声 10 min 使其完全溶解;色谱条件:紫外检测波长 340 nm;流速 0.8 ml/min;进样量 5 μl;柱温 25 ℃;时间 40 min;流动相 A:0.1% 的甲酸水溶液(V/V),流动相 B:乙腈与 0.1% 的甲酸(V/V),梯度条件如表 1。
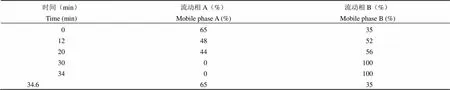
表 1 梯度洗脱条件
烟曲霉素标准曲线绘制:以烟曲霉素标准品 1000 mg/L 为母液,色谱乙腈为溶剂,稀释成不同浓度(100、200、300、400、500、600、700、800、900 mg/L)的标准溶液,每个梯度做 5 个平行。在色谱条件下进行 HPLC 分析,以各标准品的峰面积 y 对其浓度 x(mg/L)进行线性回归分析,得到标准曲线回归方程为 y = 210047x ‒ 13265,相关系数2= 0.9998。以峰面积为横坐标,根据回归方程计算烟曲霉素浓度。
1.2.2.2 烟曲霉素萃取工艺优化 选用乙酸乙酯、甲基叔丁基醚、正庚烷和正己烷作为萃取溶剂,分别按萃取溶剂:发酵液体积比 = 1:1、2:1、3:1、4:1 进行全料液萃取实验,搅拌速率 150 r/min,搅拌2 h 后静置分层,待分层后取上层有机相通过 HPLC 分析测定烟曲霉素浓度,与标准品比对计算浸提收率,每个实验做 3 个平行,结果取平均值。
1.2.2.3 烟曲霉素结晶条件优化 烟曲霉素在甲醇、乙醇、丙酮、乙腈中的溶解度很低,仅有 6 ~10 g/L,在二氯甲烷、三氯甲烷中的溶解度很高,可以达到 500 g/L,因此烟曲霉素的结晶原理是用二氯甲烷和甲醇的混合溶液溶解烟曲霉素粗品,然后在减压搅拌的过程中将二氯甲烷抽离,从而使烟曲霉素慢慢结晶析出。具体方法如下:烟曲霉素经全料液萃取,分液收集有机相,有机相减压浓缩得到烟曲霉素粗提物,烟曲霉素粗提物用二氯甲烷与甲醇的混合溶剂(二氯甲烷与甲醇的体积比为 1:1)等体积溶解,搅拌至完全溶解后用滤纸过滤,滤液在温度–10 ℃,压力–0.08 MPa,搅拌速率 150 r/min 条件下结晶,1 h 后向结晶溶液中加入 0.1 倍体积的甲醇,之后每 1 小时加入 0.1 倍体积的甲醇,8 h 后过滤得到烟曲霉素晶体,按同样的方法进行二次结晶。每个实验做 3 个平行,结果取平均值。
1.2.3 烟曲霉素杂质分析
1.2.3.1 杂质制备 利用 HPLC 对烟曲霉素主要杂质进行制备,制备方法沿用烟曲霉素分析方法,通过连续进样收集累积单个杂质峰,然后经过浓缩、干燥后,置于–20 ℃避光保存。
1.2.3.2 核磁共振分析条件 将约 10 mg 纯样品用氘代甲醇(CD3OD)装入专用核磁管(0.5 cm × 20 cm)中进行核磁共振扫描。采用 Bruker Avance III400 MHz 配 5 mm BBOF 探头,观察频率 100 MHz,扫描范围–20 ~ 220 ppm,30° 脉冲角,采样时间 0.68 s,延迟时间 2 s,扫描次数5120 次,测定温度 300 K。
1.2.3.3 液质联用分析条件 液相分析条件同 1.2.2.1,质谱分析条件:电喷雾电离源(ESI),雾化器温度 325 ℃,雾化器干气流速 8 L/min,喷雾器压力 35 psig,喷雾电压 +3500 V。取适量样品于进样瓶中,用乙腈溶解,摇匀,作为样品检测溶液进行质谱分析。
2 结果
2.1 烟曲霉素全料液萃取实验
以乙酸乙酯、甲基叔丁基醚、正庚烷和正己烷四种有机溶剂为萃取剂,有机溶剂与发酵液体积比分别为 1:1、2:1、3:1、4:1,搅拌 2 h,静置分层,待分层后取有机相通过 HPLC 测定有机相中烟曲霉素的含量,其结果见图 1。
由图 2 可知,随着有机溶剂与发酵液体积比增大,烟曲霉素萃取收率增高,在相同条件下,甲基叔丁基醚和乙酸乙酯萃取收率远远高于正庚烷和正己烷。当有机溶剂:发酵液体积比 = 1:1 时,甲基叔丁基醚萃取收率是 70%,乙酸乙酯萃取收率是 67%。当有机溶剂:发酵液体积比 = 2:1 时,甲基叔丁基醚萃取收率是 89%,乙酸乙酯萃取收率是85%。此时再增大有机溶剂与发酵液体积比,其萃取收率增加不明显。因此,综合考虑生产成本和生产周期,选择甲基叔丁基醚作为最佳萃取溶剂,其与发酵液体积比为 2:1 进行全料液萃取。
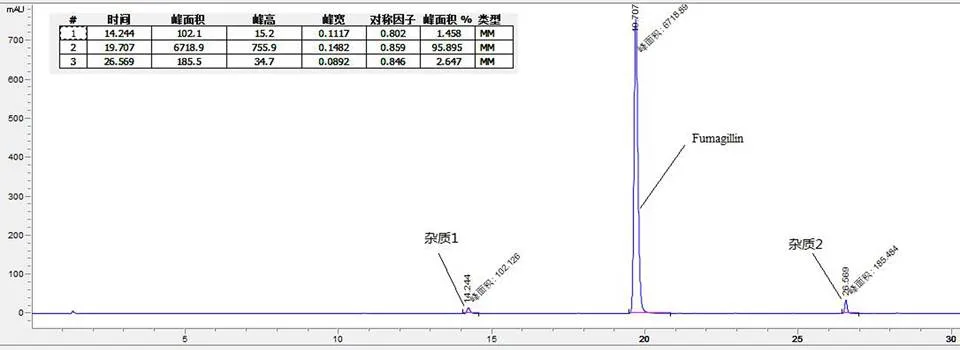
图 1 烟曲霉素液相色谱图
Figure 1 HPLC chromatogram of fumagillin
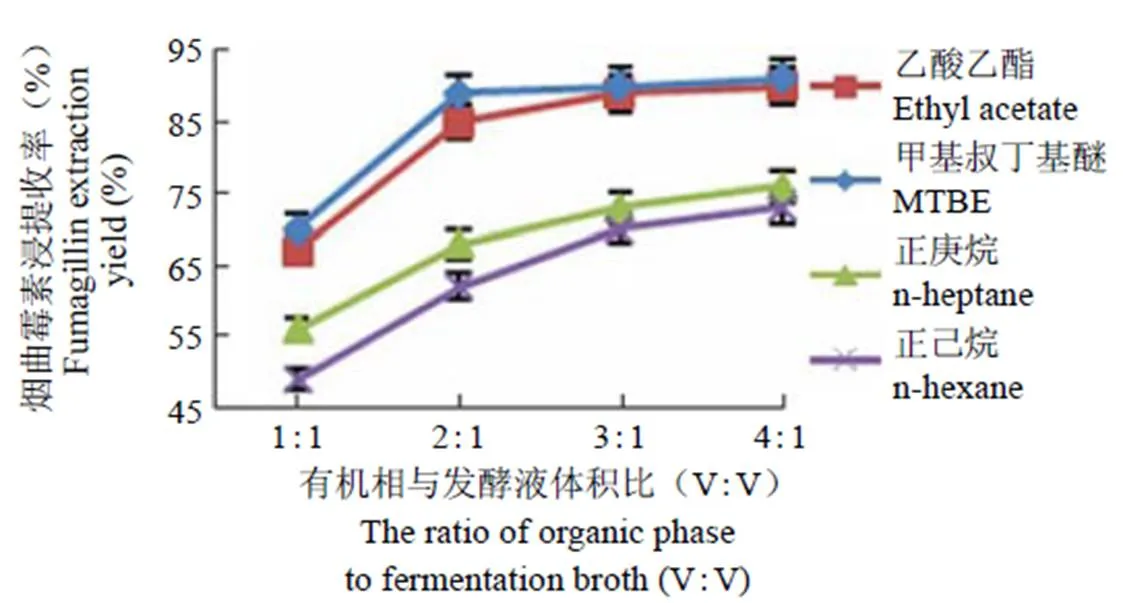
图 2 四种不同溶剂对烟曲霉素的萃取效果
Figure 2 Effects of four different dissolvent on the yield of fumagillin
2.2 烟曲霉素结晶实验
烟曲霉素粗提物经过一次结晶,其 HPLC 纯度达到 92.4%,二次结晶后,烟曲霉素HPLC 纯度 95.8%(图 1),经干燥后通过外标法测定烟曲霉素含量为 96.5%,每次结晶收率 91.2%,说明通过结晶方式得到的烟曲霉素纯度高,收率高。
烟曲霉素晶体经 NMR 和 ESI-MS 进一步确认了其结构,其结构式如图 3。烟曲霉素为白色至淡黄色无定型粉末;易溶于二氯甲烷、三氯甲烷、二甲基亚砜等有机溶剂,可溶于甲醇、乙醇、丙酮、乙酸乙酯、甲基叔丁基醚等有机溶剂,难溶于水;电喷雾质谱(ESI-MS)457 [M-H]-,分子量为458(图 4),与其分子式 C26H34O7相吻合。以氘代甲醇(CD3OD)作溶剂进行核磁共振1H-NMR(400 MHz, CD3OD,图 5)分析,四甲基硅烷(TMS)做内标(H0.00)。烟曲霉素1H-NMR(400 MHz,CD3OD):H1.15(br d,= 13.4 Hz),1.29(s),1.72(s),1.81(s),1.93(m),2.06(br d,= 13.4 Hz),2.13(d,= 11.2 Hz),2.23(m),2.31(m),2.45(m),2.62(d,= 4.0 Hz),2.73(t,= 6.1 Hz),3.06(d,= 4.0 Hz),3.51(s),3.75(br d,= 11.2 Hz),5.27(m),5.78(s),6.00(d,= 15.3 Hz),6.05(d,= 15.3 Hz),6.52(m),6.53(m),6.66(m),6.67(m),7.33(dd,= 11.2,11.0 Hz),7.42(dd,= 11.2,11.3 Hz)。
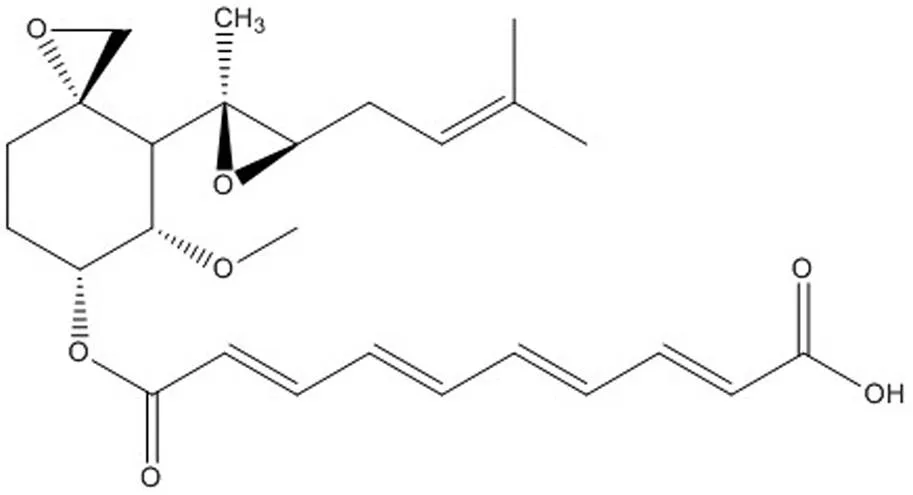
图 3 烟曲霉素结构式
Figure 3 Structure of fumagillin
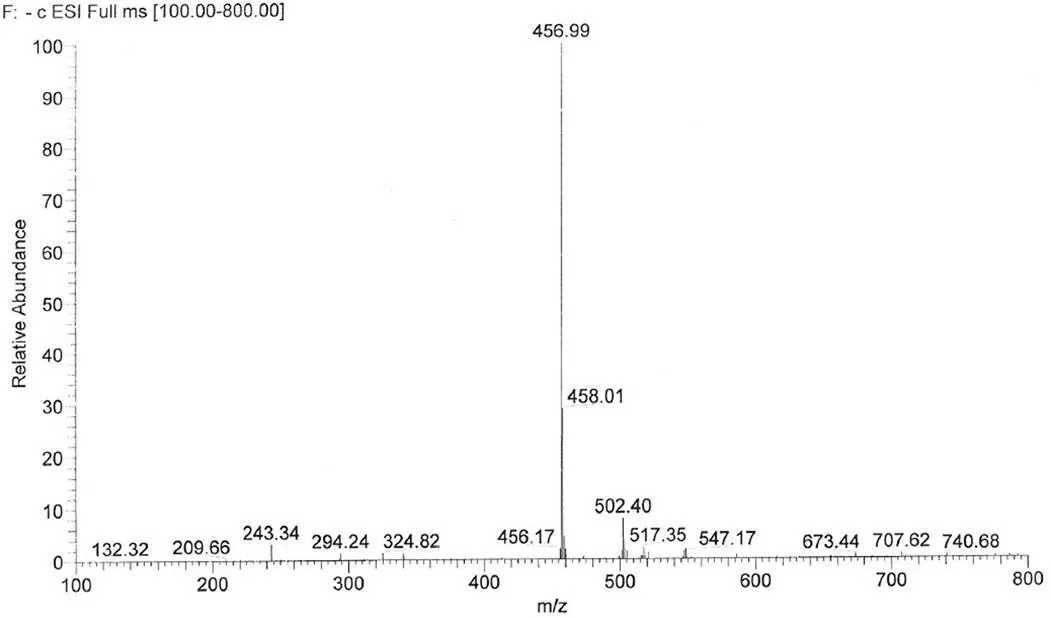
图 4 烟曲霉素的负离子质谱图
Figure 4 Negative ESI-MS of fumagillin
2.3 烟曲霉素杂质分析
通过对烟曲霉素杂质制备、分析,鉴定了两个主要杂质的结构,分别为杂质 1 和杂质 2,其结构式如图 6,HPLC 图谱见图 1。杂质 1 保留时间 Rt = 14.2 min,HPLC 含量 1.5%,在1H-NMR 图中明显看出其比烟曲霉素少了一个 -OCH3(H3.51)特征信号,说明杂质 1 比烟曲霉素少了一个连氧甲基基团,与其质谱数据 ESI-MS443 [M-H]-,分子量 444 相吻合,杂质 1 的1H-NMR 和 ESI-MS 图谱分别见图 7 和图 8。杂质 2 保留时间 Rt = 26.5 min,HPLC 含量 2.6%,在1H-NMR图中明显看出其比杂质 1 少了一个连氧次甲基(H4.14)特征信号,说明杂质 2 比杂质 1 少了一个羟基基团,与其质谱数据 ESI-MS427 [M-H]-,分子量 428 相吻合,杂质 2 的1H-NMR 和 ESI-MS 图谱分别见图 9 和图 10。
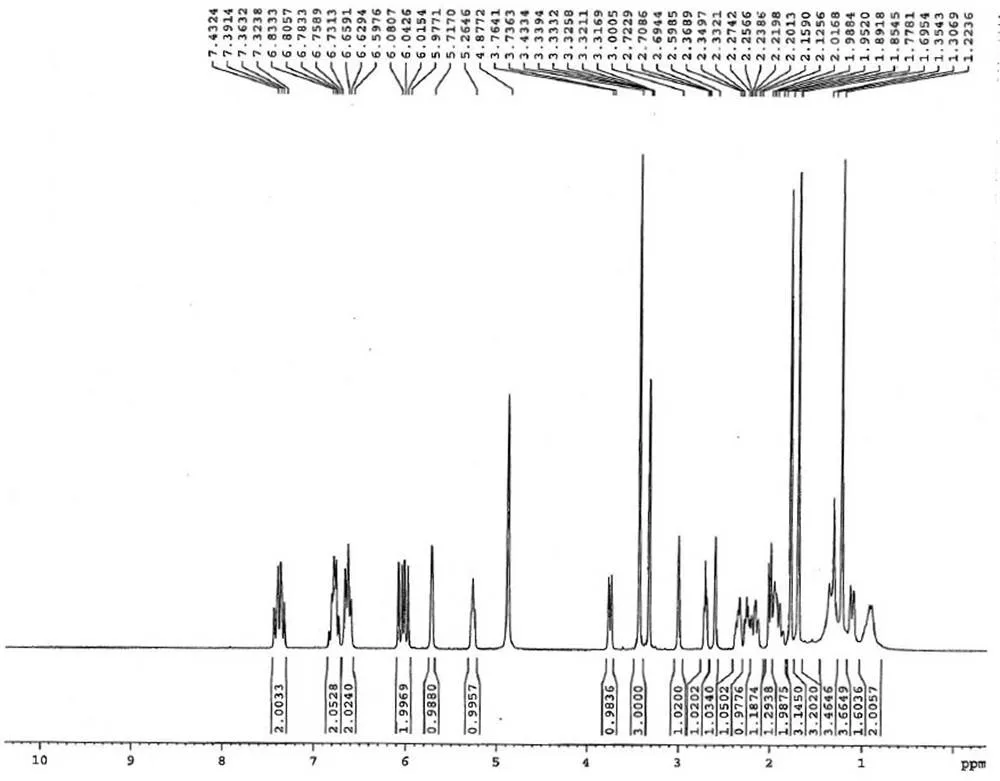
图 5 烟曲霉素的核磁共振氢谱
Figure 51H-NMR spectrum of fumagillin
杂质 1 ESI-MS443 [M-H]-,分子量为 444(图 8),分子式为 C25H32O7。1H-NMR (400 MHz,CD3OD):H1.12(br d,= 13.2 Hz),1.29(s),1.78(s),1.82(s),1.95(m),2.05(br d,=13.2 Hz),1.99(d,= 11.2 Hz),2.21(m),2.32(m),2.65(d,= 4.0 Hz),2.72(t,= 6.1 Hz),3.00(d,= 4.0 Hz),4.14(br d,= 11.2 Hz),5.26(m),5.30(s),6.00(d,= 15.3 Hz),6.03(d,= 15.3 Hz),6.62(m),6.63(m),6.74(m),6.77(m),7.35(dd,= 11.2,11.0 Hz),7.42(dd,= 11.2,11.0 Hz)。
杂质 2 ESI-MS427 [M-H]-,分子量为 428(图 10),分子式为 C25H32O6。1H-NMR(400 MHz,CD3OD):H1.16(s),1.18(m),1.29(s),1.77(s),1.82(s),1.84(m),1.95(m),2.05(br d,= 13.4 Hz),2.15(m),2.23(m),2.35(m),2.60(d,= 4.0 Hz),2.79(t,= 6.1 Hz),2.95(d,= 4.0 Hz),5.27(t,= 6.8),5.30(s),6.00(d,= 15.2 Hz),6.52(m),6.53(m),6.66(m),6.67(m),7.34(dd,= 11.2,11.0 Hz),7.39(dd,= 11.2,11.3 Hz)。
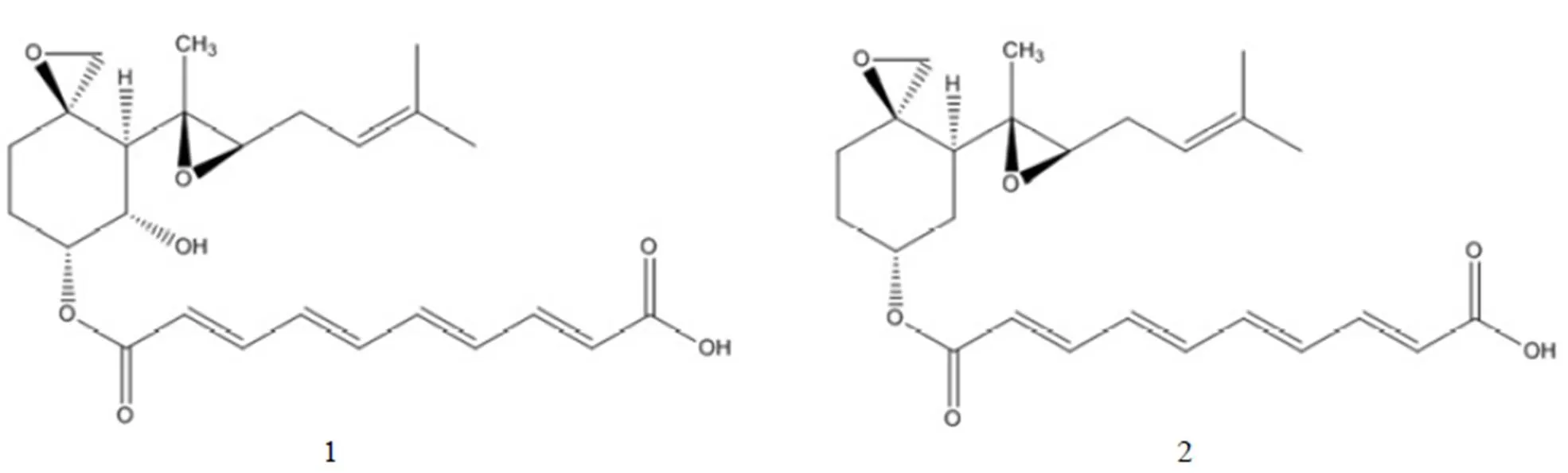
图 6 杂质 1 和 2 的结构式
Figure6 Structures of impurities 1 and 2
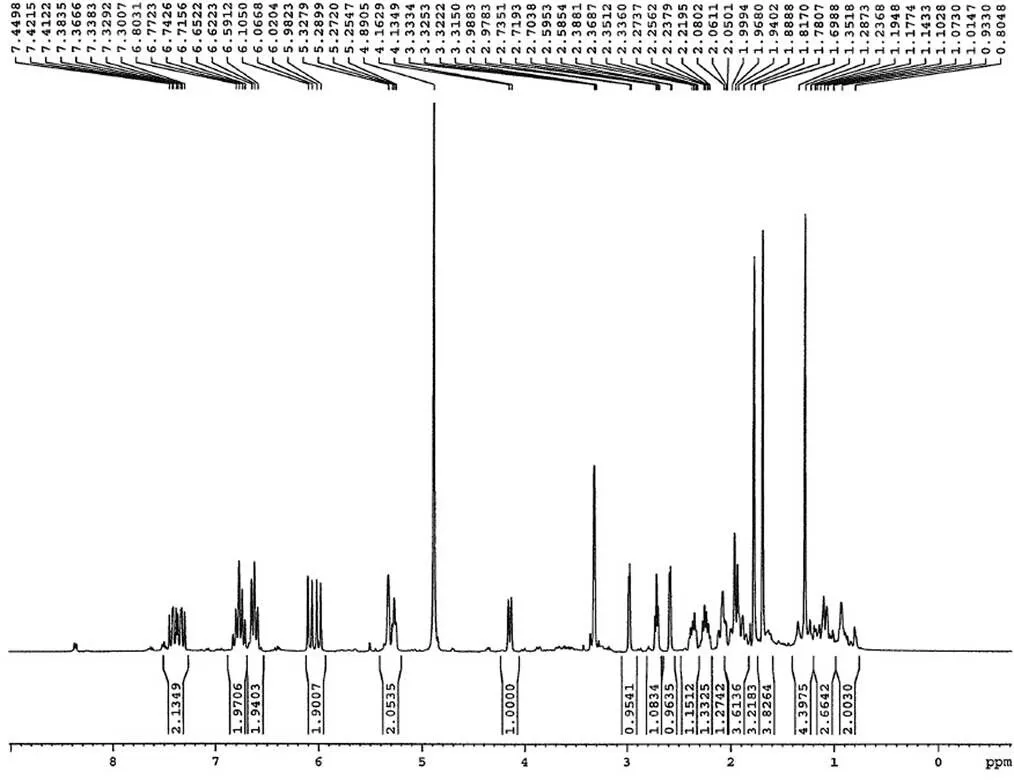
图 7 杂质 1 的核磁共振氢谱
Figure 71H-NMR spectrum of impurity 1
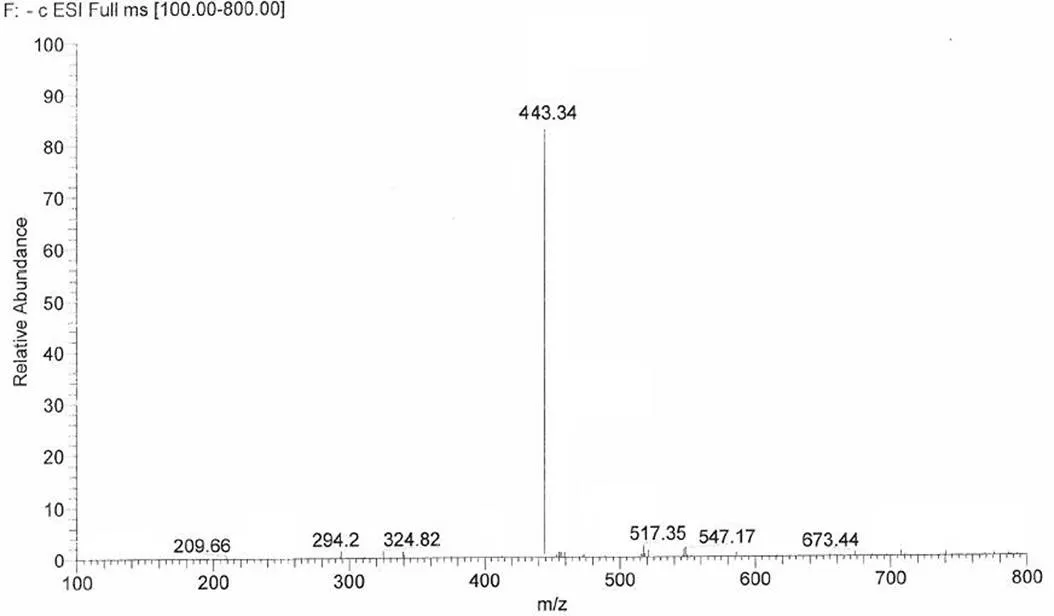
图 8 杂质 1 的负离子质谱图
Figure 8 Negative ESI-MS of impurity 1
3 讨论
烟曲霉素具有多种生物活性,不仅可以治疗蜜蜂、鱼等动物的微孢子虫病,而且对人血管瘤具有显著的抑制活性,其衍生物还可以用于治疗肥胖症和代谢系统疾病,因此,烟曲霉素在未来的应用会更加广泛,所以开发适合产业化的烟曲霉素提取工艺具有显著的社会价值和经济效益。目前,烟曲霉素产生菌效价普遍较低,并且关于烟曲霉素提取工艺的报道不适合产业化应用,本实验室在前期工作中选育到一株高产菌株,效价稳定在 1100 mg/L,通过提取工艺优化获得高纯度烟曲霉素产品,为烟曲霉素及其衍生物药物的后续开发应用奠定基础。由于烟曲霉素稳定性较差,在储存和运输过程中应避光避热,以免降解引入新的杂质,在–80 ℃可保存 180 d 不变质。
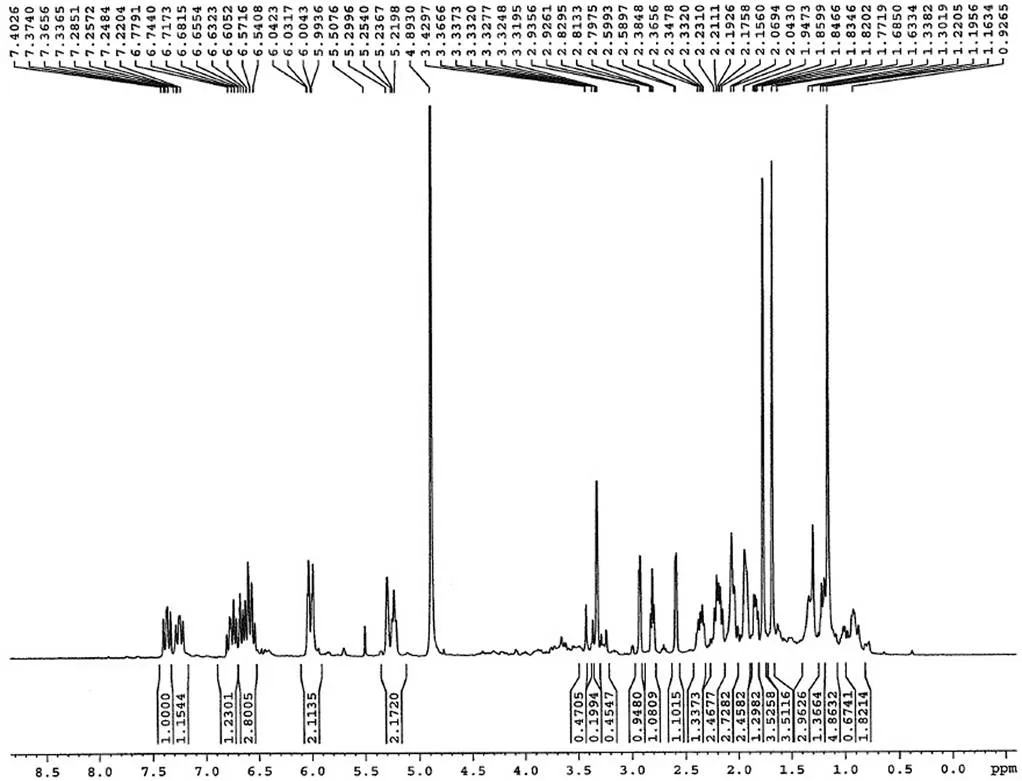
图 9 杂质 2 的核磁共振氢谱
Figure 91H-NMR spectrum of impurity 2
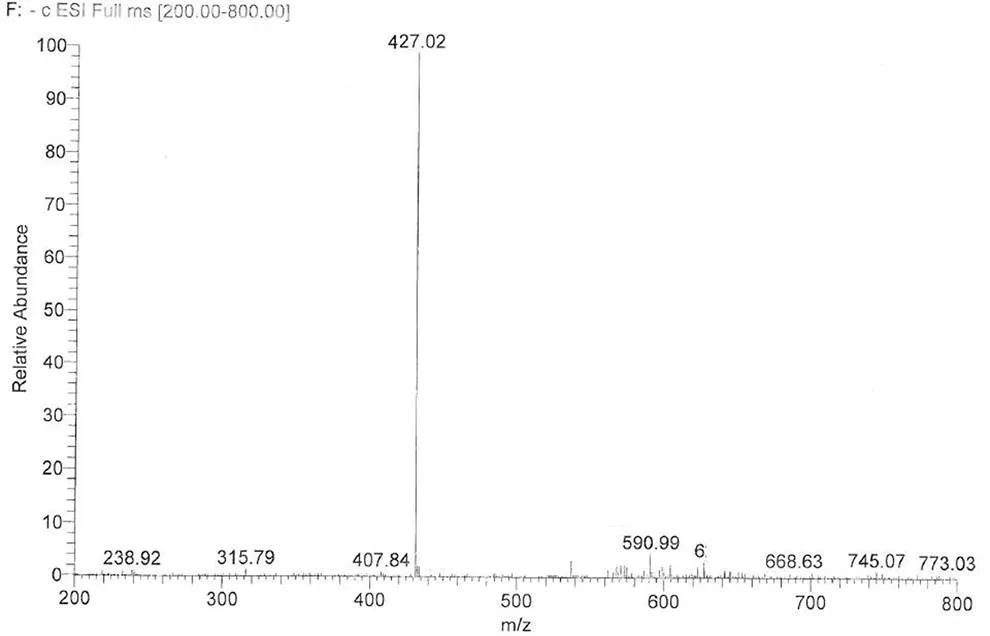
图 10 杂质 2 的负离子质谱图
Figure 10 Negative ESI-MS of impurity 2
杂质对烟曲霉素药效和药代动力会有一定的影响,杂质含量越高,影响也就越显著,由于个体差异,不同个体对杂质敏感度又不同,因此,了解杂质的结构和性质,控制产品杂质含量对药物的研发具有重要的意义。通过对影响烟曲霉素质量的主要杂质进行分析,鉴定了两个主要杂质结构,为烟曲霉素质量控制和安全性评价提供支持。同时,烟曲霉素两个主要杂质是烟曲霉素类似物,由菌株1516 发酵过程代谢产生,为烟曲霉素生物合成的分子机制及定向改造提供依据。
[1] Guruceaga X, Perez-Cuesta U, Abad-Diaz de Cerio A, et al. Fumagillin, a mycotoxin of Aspergillus fumigatus: biosynthesis, biological activities, detection, and applications. Toxins (Basel), 2019, 12(1):7.
[2] Guruceaga X, Ezpeleta G, Mayayo E, et al. A possible role for fumagillin in cellular damage during host infection by Aspergillus fumigatus. Virulence, 2018, 9(1):1548-1561.
[3] Wang Y, Xiong L, Peng QC, et al. Review on the control methods of microsporidiosis in honeybee colony. J Bee, 2019, 39(5):8-11. (in Chinese)
汪燕, 熊亮, 彭青春, 等. 综述蜜蜂孢子虫病的防治方法. 蜜蜂杂志, 2019, 39(5):8-11.
[4] van den Heever JP, Thompson TS, Curtis JM, et al. Fumagillin: an overview of recent scientific advances and their significance for apiculture. J Agric Food Chem, 2014, 62(13):2728-2737.
[5] Ingber D, Fujita T, Kishimoto S, et al. Synthetic analogues of fumagillin that inhibit angiogenesis and suppress tumor growth. Nature, 1990, 348(6301):555-557.
[6] Chang BY, Wang JM, Wang M, et al. Progress on the bioactivity of fumagillin and its derivatives. Curr Biotechnol, 2017, 7(6):580-586. (in Chinese)
常白杨, 汪建明, 王敏, 等. 烟曲霉素及其衍生物生物活性研究进展. 生物技术进展, 2017, 7(6):580-586.
[7] Kanno T, Uehara T, Osawa M, et al. Fumagillin, a potent angiogenesis inhibitor, induces Kaposi sarcoma-associated herpesvirus replication in primary effusion lymphoma cells. Biochem Biophys Res Commun, 2015, 463(4):1267-1272.
[8] Alvarado JJ, Nemkal A, Sauder JM, et al. Structure of a microsporidian methionine aminopeptidase type 2 complexed with fumagillin and TNP-470. Mol Biochem Parasit, 2009, 168(2):158-167.
[9] Wang HP, Yang M, Wu LM, et al. Optimization of fumagillin fermentation conditions in 5 L fermenter and scale-up experiment. China Brewing, 2019, 38(2):98-103. (in Chinese)
王昊鹏, 杨萌, 吴黎明, 等. 烟曲霉素5 L罐发酵条件优化及中试. 中国酿造, 2019, 38(2):98-103.
[10] Wang HP, Wu LM, Zhao LW, et al. Preliminary optimization of fermentation conditions of fumagillin and expanding cultivation. Sichuan Food Fermentation, 2018, 54(3):13-20. (in Chinese)
王昊鹏, 吴黎明, 赵柳微, 等. 烟曲霉素发酵条件的初步优化及其扩大培养. 食品与发酵科技, 2018, 54(3):13-20.
[11] Yang W, Kim WS, Fang A, et al. Carbon and nitrogen source nutrition of fumagillin biosynthesis by Aspergillus fumigatu. Curr Microbiol, 2003, 46(4):275-279.
[12] Yang W, Hartwieg EA, Fang A, et al. Effects of carboxymethylcellulose and carboxypolymethylene on morphology of Aspergillus fumigatus NRRL 2346 and Fumagillin production. Curr Microbiol, 2003, 46(1): 24-27.
[13] Barboráková Z, Labuda R, Häubl G, et al. Effect of glucose concentration and growth conditions on the fungal biomass, pH of media and production os fumagillin by a non-pathogenic strain Penicillium scabrosum. J Microbiol Biotechnol Food Sci, 2012, 1(4):466-477.
[14] Xue XF, Wu LM, Ni H, et al. Extraction method of fumagillin: China, CN201610104785.6. 2016-02-25. (in Chinese)
薛晓峰, 吴黎明, 倪辉, 等. 一种烟曲霉素的提取方法: 中国, CN201610104785.6. 2016-02-25.
Purification and impurity analysis of the highly-efficient antitumor drug fumagillin
LI Jian-song, LI Ya, WANG Ji-dong, HAO Zhi-kui, XUE Chang-yan
Taizhou Vocational & Technical College, Zhejiang 318000, China (LI Jian-song, HAO Zhi-kui, XUE Chang-yan); Zhejiang Hisun Pharmaceutical Co., Ltd, Taizhou 318000, China (LI Ya); School of Life Sciences, Huzhou University, Zhejiang 313000, China (WANG Ji-dong)
To develop a separation and purification process of high purity fumagillin, and to isolate and purify the main impurities in fumagillin and identify their structures.
In order to screen and optimize the extraction solvent, the fermentation broth was extracted with whole broth solvent extraction (WBE), and the yield of fumagillin was used as the index. The crystallization was carried out in a mixture of methanol and dichloromethane. The main impurities in fumagillin crystals were separated and purified by HPLC, and the structures of impurities were identified by NMR and mass spectrometry.
The extraction solvent was methyl tert-butyl ether (MTBE), and the extraction yield was higher than 85% when the volume ratio of MTBE:fermentation broth was 2:1. After two crystallization, the crystals with purity above 95% could be obtained. The two main impurities in the fumagillin crystals were separated and identified.
Through the study on the extraction technology of fumagillin, the optimum technological conditions are determined. The method has the characteristics of easy operation, high purity, high yield and low cost, which is suitable for industrial production. The two main impurities are the analogues of fumagillin. The impurity identification provides support for quality control and safety evaluation of fumagillin.
Fumagillin; Separation and purification; Impurities; Structure identification
LI Jian-song, Email: Lijstz1987@163.com
李建宋,Email:lijstz1987@163.com
10.3969/j.issn.1673-713X.2020.04.011
2020-01-09
