抗肿瘤核酸药物阳离子纳米载体的研究进展
2020-08-14孟月王丹王雪蕾罗芳郭晓茹夏桂民
孟月,王丹,王雪蕾,罗芳,郭晓茹,夏桂民
·综述·
抗肿瘤核酸药物阳离子纳米载体的研究进展
孟月,王丹,王雪蕾,罗芳,郭晓茹,夏桂民
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所制剂室
肿瘤的本质是一种“基因病”,其发生、发展和复发与基因密切相关。随着科学技术的进步与发展,基因治疗时代悄然而至,越来越多的研究工作者选择具有抗肿瘤活性的核酸药物,将其导入靶细胞,通过调节相关基因的表达实现抗肿瘤效果[1]。核酸药物主要包括小干扰 RNA(small interfering RNA,siRNA)、微小 RNA(microRNA,miRNA)、反义核酸及质粒DNA(plasmid DNA,pDNA)等。该类药物在体内外均不稳定,易被核酸酶降解,因此需要适宜的载体完成体内递送。
核酸药物的递送载体主要包括病毒载体和非病毒载体。病毒具有感染细胞的天性,可携带遗传物质进入细胞,其作为核酸药物递送载体,具有转染效率高、作用迅速、起效快等优势。目前,约 70%用于临床试验的核酸药物均以修饰过的病毒作为载体,其中部分已获批上市[2]。但病毒载体制备困难,生产成本高,装载 DNA 大小受限,又存在细胞毒性、免疫原性和致癌性等安全性问题,限制了其在临床上的广泛应用[3]。随着药用高分子材料和纳米医学等相关学科的快速发展,涌现了许多非病毒载体,例如脂质体、纳米粒、胶束等,它们通常含有阳离子组分(阳离子磷脂或阳离子聚合物等),所以常称之为阳离子纳米载体。阳离子纳米载体通过静电作用与荷负电的核酸药物经物理结合形成纳米粒,可保护核酸药物免遭核酸酶的降解,实现核酸药物在体内的稳定递送。与病毒载体相比,阳离子纳米载体具有制备简单、安全性高、包裹的核酸大小不易受限、易于改性修饰、又可实现核酸与小分子化疗药物共递送等诸多优势,因而备受关注。目前,虽然已有一些抗肿瘤核酸药物的阳离子纳米制剂进入了临床研究阶段(表 1),但多数因疗效不佳或严重的毒副作用而终止了临床试验。综上,构建高效、低毒、智能的纳米载体是实现抗肿瘤核酸药物在体内稳定递送的关键。本文主要介绍近几年抗肿瘤核酸药物阳离子纳米载体的研究进展,为新型抗肿瘤核酸药物纳米制剂的研发提供参考。
1 基于阳离子脂质的核酸药物纳米载体
阳离子脂质因具有良好的生物相容性和理化性质而被用作核酸药物的递送载体材料。常见的阳离子脂质有1,2-二油酰氧丙基-N,N,N-三甲基溴化铵(DOTAP)、N-[1-(2,3-二油酰氧基)丙基]-N,N,N-三甲基氯化铵(DOTMA)、2,3-二油酰氧-N-[2-(精胺羧基酰胺)乙基]-N,N-二甲基-1-丙基-三氯乙酸盐(DOSPA)、二甲基双十八烷基溴化胺(DDAB)、3β-[N-(N',N'-二甲基二甲基胺乙基)胺基甲酰基)胆固醇(DC-Chol)及其他新型阳离子脂质等。
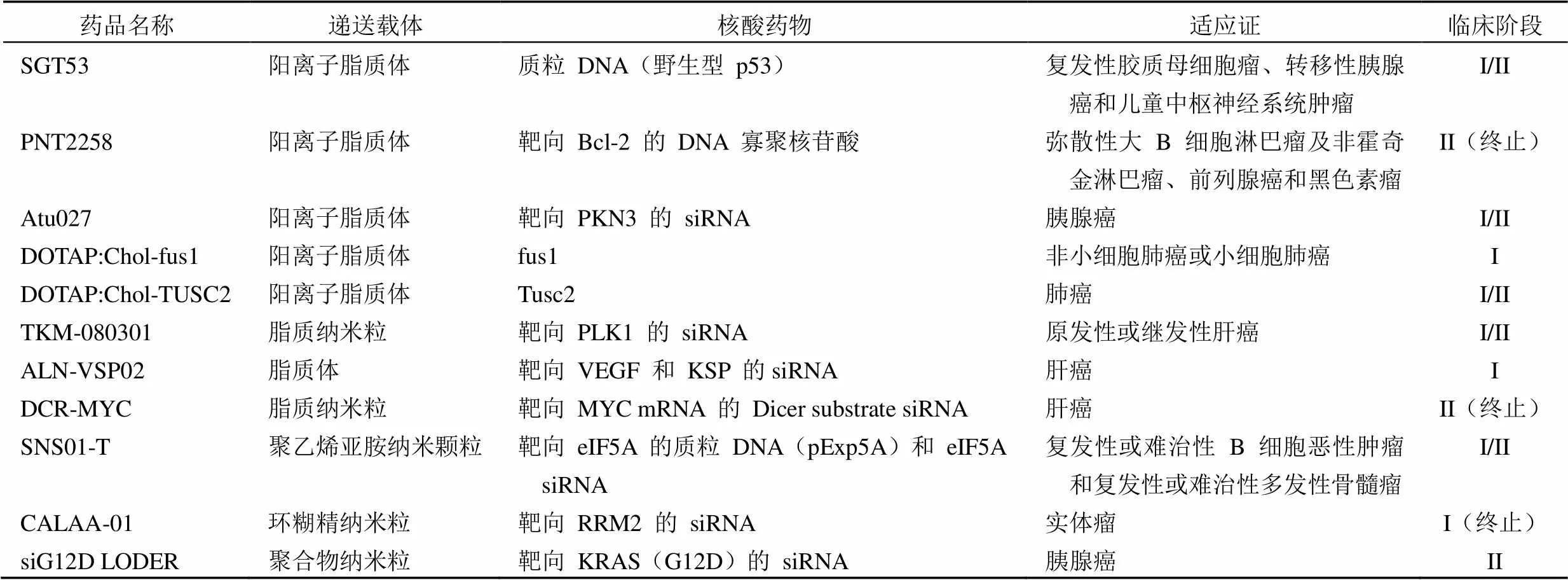
表 1 抗肿瘤核酸药物阳离子纳米制剂临床研究现状
1.1 基于阳离子脂质的经典纳米载体
1.1.1 阳离子脂质体 由阳离子脂质和中性磷脂构建的阳离子脂质体是最常见的核酸药物递送载体,它们通常具有稳定性好、体内可生物降解及保护核酸免遭酶解等优势。中性磷脂的加入,既可辅助阳离子脂质体形成,也可降低细胞毒性,提高转染效率。常用的中性磷脂包括磷脂酰乙醇胺(PE)及其衍生物、磷脂酰胆碱(PC)及其衍生物、胆固醇(Chol)等。研究表明,二油酰磷脂酰乙醇胺(DOPE)具有 pH 敏感性,在包涵体酸性环境中能够诱导脂质体膜与包涵体膜融合,促进核酸释放。因此,以 DOPE 为辅助磷脂的阳离子脂质体通常具有较高的转染效率[4-5]。为延长阳离子脂质体体内循环时间,避免其与血浆蛋白相互作用而产生调理作用,可采用聚乙二醇(PEG)修饰阳离子脂质体,遮蔽或部分遮蔽其表面的正电荷,降低细胞毒性和血浆清除率。研究表明,在阳离子脂质体中加入 3% DSPE-mPEG2000,与未经 PEG 修饰的阳离子脂质体相比,PEG 化脂质体粒径、电位均降低,稳定性提高,在 4 ℃条件下至少保存 6 个月[6]。Bathula 等[7]筛选出一种具有人 DNA 连接酶(hLig)Ι抑制作用的新型阳离子脂质(C12M)(图 1),它可以与hLig Ι 结合,干扰 DNA 的复制和修复,从而导致 DNA 片段在细胞中积累,高浓度下可导致细胞凋亡;采用注入法将 C12M 与等摩尔的胆固醇混合可制得粒径为 106 nm、zeta 电位为 40 mV 的阳离子脂质体,该载体能够将 survivin siRNA 有效递送至人前列腺癌细胞 PC-3,显著抑制 survivin 蛋白的表达;此外,采用 B16F10 黑素瘤模型小鼠开展体内药效学评价,在治疗 21 d 后(0.5 mg/kg,IV,Q3D × 7),与游离 survivin siRNA 相比,survivin siRNA/C12M 能够显著抑制瘤体积增长。
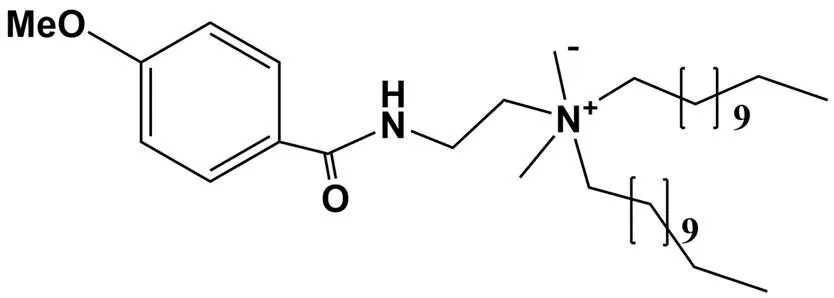
图 1 阳离子脂质 C12M 的化学结构
1.1.2 阳离子固体脂质纳米粒 由阳离子脂质与天然的固态脂质(如单硬脂酸甘油酯、脂肪酸、卵磷脂等)混合而制备的阳离子固体脂质纳米粒(cationic solid lipid nanoparticles,CSLNs)也被用作核酸药物递送载体[8]。Akbaba 等[9]采用乳化分散法将阳离子脂质 DDAB 与固态脂质山嵛酸甘油酯混合制备成 CSLNs,并将能够抑制 5-α 还原酶表达的 shRNA 编码质粒(p5α-Red)负载到 CSLNs,形成 SLN:p5α-Red 纳米粒(粒径 62.65 nm、zeta 电位12.9 mV),将其与前列腺癌细胞 DU-145 共孵育 48 h 后可使胞内5-α 还原酶表达水平降低 65.1%。
1.2 基于阳离子脂质的智能型纳米载体
1.2.1 靶向修饰型 采用一些可与靶细胞特异性或非特异性结合的分子,如抗体、蛋白、多肽及小分子等,对基于脂质的阳离子纳米载体进行修饰,赋予载体靶向功能,使其能够主动识别靶组织或靶细胞,并在此聚集,提高核酸药物治疗效果。
⑴抗体修饰:Anti-EphA10 抗体(Eph)可与乳腺癌细胞表面高表达的 Eph 受体 A10 结合,从而抑制肿瘤的生长和转移。Zang 等[10]采用 Eph 对 pH 敏感型阳离子脂质体(PSL)进行修饰,得靶向脂质体(EPSL),将EPSL 和 PSL分别与多药耐药基因 MDR1-siRNA 共孵育(N/P = 9)得到 EPSLR纳米粒(粒径 143 nm、zeta 电位 22.7 mV)和 PSLR纳米粒;研究表明 MCF-7/ADR 细胞对 EPSLR 的摄取比 PSLR 高 4.42 倍,使得 MDR1 蛋白表达显著下调;采用 DIR 对纳米粒进行标记,尾静脉注射至 MCF-7/ADR 荷瘤小鼠体内,24 h 后 EPSLR 组肿瘤部位的荧光信号强度比 PSLR 组高 1.2 倍,表明靶向修饰后可以增加纳米粒在肿瘤部位聚集。
⑵转铁蛋白修饰:转铁蛋白(transferrin,Tf)可与细胞表面的转铁蛋白受体结合,协助血浆糖蛋白运载铁离子至细胞中。由于肿瘤细胞对铁离子的需求急剧增加,使得肿瘤细胞表面的转铁蛋白受体明显增加,依据这一特性,Saavedra-Alonso 等[11]采用 Tf 修饰的 PEG 化阳离子脂质体(Lip)介导1shRNA 用于黑色素瘤动物模型的靶向递送,结果表明,Lip-shRNA-Tf 的抑瘤效果(抑瘤率24%)显著优于 Lip-shRNA,Lip-shRNA-Tf 组1 基因沉默效率(1 基因相对表达量 0.21)显著高于 Lip-shRNA(1 基因相对表达量 1.34),且荷瘤小鼠的生存率提高 37%。
⑶叶酸修饰:肿瘤细胞表面高表达叶酸受体。Kabilova 等[12]合成 1,2-di-O-ditetradecyl-rac-glycerol 与叶酸的共轭物(Fc),该共轭物可与阳离子脂质和胆固醇等制备成粒径为(60 ± 22)nm 的叶酸靶向阳离子脂质体,该脂质体能够介导 siRNA 有效递送至叶酸高表达的人口腔表皮样癌细胞 KB-3-1 中,其转染效率比未修饰脂质体高 3 ~ 4 倍;在多药耐药细胞 KB-8-5 荷瘤 SCID 小鼠模型中,此脂质体改变了 Cy7-labeled-siRNA 的体内分布,显著增加 siRNA 在肿瘤部位的聚集,且尾静脉注射 siMDR/F,3 d 后,肿瘤组织中 P-糖蛋白表达下降 40%,表明该脂质体可靶向至肿瘤部位并发挥效果。
⑷半乳糖修饰:半乳糖(galactose,GAL)能够与肝癌细胞表面特异性表达的去唾液酸蛋白受体结合。Oh等[13]构建了半乳糖基化阳离子脂质体用于 vimentin siRNA 和阿霉素(DOX)共递送,该共载脂质体与人肝癌细胞 Huh7 具有更强的亲和力,使 Huh7 细胞中 vimentin 蛋白表达下调 77%,转染 48 h 后,细胞活力下降 49%;在 Huh7 细胞荷瘤裸鼠模型中,半乳糖基化共载脂质体在肿瘤部位的累积比未修饰的共载脂质体(DOX/siRNA-L)高 2.3 倍,且给药 28 d 后,半乳糖基化共载脂质体组瘤体积为(286 ± 45)mm³,显著低于 DOX/siRNA-L 的(709 ± 103)mm³。
1.2.2 环境敏感型 核酸类药物在体内有效释放是提高转染效率的关键。近年来,基于脂质的环境敏感型纳米载体备受研究者关注,例如 pH 敏感型、温度敏感型、氧化还原敏感型、酶敏感型等,这类纳米载体只有到达肿瘤部位时,才能将包载的抗肿瘤核酸药物释放出来,起到靶向递送和控制释放的作用。
⑴pH 敏感型:针对肿瘤组织(pH 6.5 ~ 7.2)和内涵体(pH 4 ~ 5)等弱酸性环境可以构建 pH 敏感型阳离子脂质体或脂质纳米粒,因其能够在靶部位控制释放,通常具有较好的转染效果。YSK05 是一种 pH 敏感的阳离子脂质(图 2)。研究报道,YSK05 可以与其他磷脂材料混合制得 pH 敏感脂质体,可以将 siRNA、anti-miRNA oligonucleotide 和 pDNA 有效递送至肝癌细胞[14-16]。YSK05 分子结构中含有 pH 敏感基团 N-甲基哌啶,其在酸性条件下荷正电(pKa = 6.6),能够固缩核酸;其在中性环境下失去正电荷,通过 Apo-E 介导的内吞作用进入细胞,在内涵体酸性环境下,YSK05 转变为六角晶相,脂质体变为非稳定结构,与内涵体膜融合,使得核酸从内涵体释放至胞浆中[14]。与传统的阳离子脂质 DOTAP、DOSPA 相比,采用 YSK05 制备的阳离子脂质体虽然细胞摄取率较低,但却显示出较强的基因沉默效率和较低的细胞毒性[14-15]。
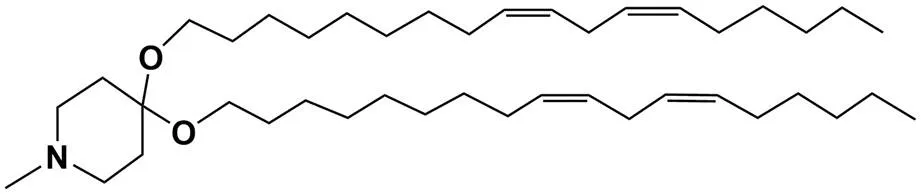
图 2 阳离子脂质 YSK05 的化学结构
⑵氧化还原敏感型:细胞质中存在大量谷胱甘肽(glutathione,GSH),其浓度比细胞外或者血液中高100 ~ 1000 倍[17],致使细胞内呈现还原性环境。依据这一特性,Candiani等[18]采用二硫键将两分子三嗪类阳离子脂质连接在一起形成具有氧化还原敏感特性的阳离子脂质 SS14(图 3),采用薄膜法将 DOPC、DOPE 和 SS14 按摩尔比为 16.7:33.3:50 制备阳离子脂质体,用该载体负载 pEGFP-N1,转染人恶性脑胶质瘤细胞 U87-MG,其转染效率比 Lipofectamine 2000 高 2.7 倍;GSH 耗竭/饱满实验研究结果表明,GSH 可特异性地诱导 pEGFP-N1 体外释放,细胞内 GSH 水平与转染效率成正相关。
⑶温度敏感型:Wang 等[19]合成温度敏感型聚合物P(NIPAAm-co-DMAPAAm)-DOPE,将其与 DOTAP 和 DOPE 混合,采用薄膜法制备得到温敏阳离子脂质体,将该脂质体与 Luc siRNA 共孵育后得到脂质复合物,当温度由 30 ℃上升到 40 ℃时,该脂质复合物的粒径由 106 nm 增加到 149 nm(PDI 0.14 → 0.32),表明其具有温敏特性,用该脂质体介导 GFP pDNA 转染能够瞬时表达 GFP 的 HeLa 细胞,其转染效率与市售转染试剂 Lipofectamine 2000 相当。然而,合成的温度敏感聚合物不可降解,限制了其在体内的应用。天然来源的热敏性弹性蛋白多肽(ELP)在体内可生物降解为无毒的氨基酸,安全性较高,可用来修饰阳离子脂质体,提高基因转染效率[20]。
⑷酶敏感型:肿瘤组织中具有丰富多样的酶,如磷脂酶 A2(sPLA2)、基质金属蛋白水解酶(MMPs)、尿激酶型纤溶酶原激活剂(uPA)、弹性蛋白酶(elastase)、前列腺特异性抗原(PSA)、组织蛋白酶B(cathepsin B)等[21]。酶敏感型载体通常含有可被酶降解的组分,Song 等[22]合成了脂质 mPEG-GLFG-K-(C16)2,其中 GLFG 可被细胞溶酶体中的酶降解,采用薄膜法将其与 DOTAP、DOPE 混合,制备酶敏感阳离子脂质体(eSPLPs),它能够成功包裹 pDNA(包封率> 80%);eSPLPs 与组织蛋白酶 B 混合后,mPEG-GLFG-K-(C16)2被酶降解,脂质体粒径由 200 nm 增长到 20 μm,说明脂质体质膜疏松,而不含酶敏感键的脂质体(SPLPs)粒径没有变化;eSPLPs 的转染效率较 SPLPs 高 10 ~ 100 倍,表明 eSPLPs 具有酶敏感性。
2 基于阳离子聚合物的核酸药物纳米载体
阳离子聚合物作为核酸药物递送载体,具有安全性高、免疫原性低、结构易于修饰等优势,其种类繁多,通常分为人工合成阳离子聚合物(聚乙烯亚胺、聚酰胺-胺型树枝状聚合物、聚甲基丙烯酸二甲氨基乙酯、阳离子型聚酯和多聚赖氨酸等)和天然来源阳离子聚合物(壳聚糖及其衍生物、环糊精等)。其中,多聚赖氨酸(PLL)固缩核酸能力与其分子量密切相关,分子量的增大有助于增加 PLL 对核酸的负载,但毒副作用也随之增加;此外,以 PLL 为骨架的递送载体进入体内后,易被网状内皮系统摄取,从而快速从体内清除,加之部分到达靶细胞的 PLL 在溶酶体中被降解失活,使得 PLL 的转染效率极低,目前,有研究人员通过结构改造提高 PLL 的转染效率[23-24]、赋予载体靶向性[25]。环糊精衍生物可直接作为核酸药物载体,也可作为连接臂或是修饰物用于核酸药物载体的构建[26-27],还可通过准聚轮烷或聚轮烷的形式用于核酸药物递送[28-29],但存在体内稳定性差、内涵体逃逸能力弱、转染效率低等不利因素,制约其广泛应用。在此我们着重介绍聚乙烯亚胺、聚酰胺-胺型树枝状聚合物、聚甲基丙烯酸二甲氨基乙酯、阳离子型聚酯和壳聚糖及其衍生物的应用。
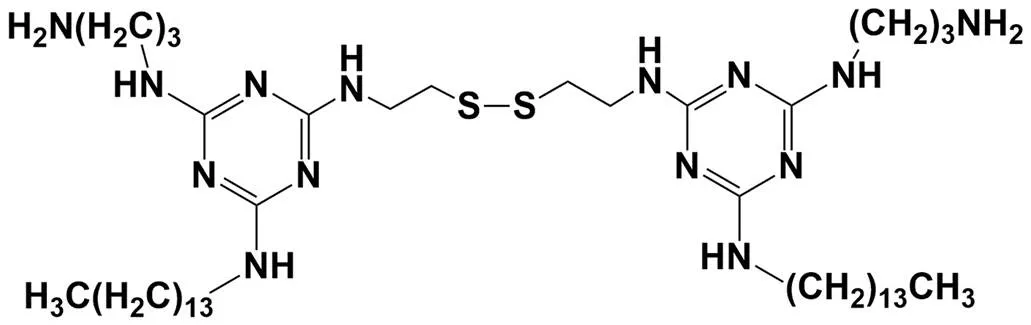
图 3 阳离子脂质SS14 的化学结构
2.1 聚乙烯亚胺
聚乙烯亚胺(PEI)的正电荷密度较高,能够有效地固缩核酸药物,并将其递送至肿瘤细胞,其独特的“质子海绵”效应,能够促使核酸药物从内涵体中逃逸出来,因而被广泛用于抗肿瘤核酸药物的体内外递送。PEI 的转染效率与其本身的结构和分子量有关,线性 PEI(22 kD)和支链 PEI(25 kD)具有较高的转染效率,均被认为是核酸类药物阳离子聚合物载体领域里的“金标准”。
2.1.1 聚乙烯亚胺衍生物纳米载体 由 PEI 高密度正电荷引起的细胞毒性问题限制了其广泛应用。近年来研究人员采用氨基酸[30]、脂肪酸[31]、透明质酸和壳聚糖[32]等对低分子量的 PEI 进行结构修饰,开发了多种高效、低毒的 PEI 衍生物。Ewe 等[30]采用酪氨酸对低分子量支链 PEI(10 kD)进行修饰,得到 PEI 衍生物 P10Y,与 siRNA 共孵育得 P10Y/siRNA 纳米粒(粒径 300 nm、zeta 电位 20 mV);与 PEI/siRNA 相比,P10Y/siRNA 在卵巢癌细胞株SKOV-3-LUC、SKOV-3-eGFP 及前列腺癌细胞株PC-3-eGFP中均显示出较高的基因敲除率(大于 70%);将 P10Y/siSurv 纳米粒静脉注射到荷瘤鼠的体内,与对照组(P10Y/siCtrl)相比,P10Y/siSurv 能够显著抑制肿瘤的生长,且给药16 天内小鼠体重无明显变化。
2.1.2 脂质体 PEI 纳米粒组装体 采用脂质囊泡对 PEI 纳米粒进行包裹可形成脂质体 PEI 纳米粒组装体。Pinnapireddy 等[33]采用薄膜分散法将 DOPE:DPPC: Cholesterol 按摩尔比 70:15:15 混合制备脂质体,用其包裹 PEI/pDNA 或 PEI/siRNA polyplex 得到 lipopolyplex,其粒径为 211.4 nm,PDI为 0.19,zeta 电位为 3.9 mV。研究表明,当 liposome/PEI 质量比为 0.39 时,lipopolyplex 转染效率增加了 10 倍,且使稳定表达荧光素酶的人卵巢腺癌细胞 SK-OV-3 中荧光素酶的表达下调 80%,细胞毒性显著降低。
2.1.3 智能化 PEI 纳米载体 Liu 等[34]采用叶酸对三嵌段共聚物 PEI-PCL-PEG 进行靶向修饰得到PEI-PCL-PEG-Fol,该共聚物可以有效固缩 siRNA,形成粒径约 100 nm、zeta 电位为 7 ~ 9 mV 的胶束。用该载体递送 GAPDH-siRNA 至 SK-OV-3 细胞,使细胞内 GAPDH 表达下调 60%。Fan等[35]设计了环境敏感型 PEI 纳米载体,采用邻苯二酚基团修饰的聚乙二醇(PEG-Cat)对苯硼酸修饰的聚乙烯亚胺(PEI-PBA)进行修饰,二者通过 PBA 与 Cat 之间形成的硼酸酯偶联形成 pH 敏感聚合物 PCPP,该聚合物载体负载 siRNA 到达肿瘤酸性环境时,硼酸酯键断裂,使 PEG 从载体上脱落,暴露出 PBA,PBA 可与肿瘤细胞表面高表达的唾液酸受体结合,介导载体高效入胞。在小鼠乳腺癌细胞 4T1 原位肿瘤模型中,PCPP/cy5-siRNA 组肿瘤部位的荧光强度显著高于游离 cy5-siRNA 和 PEI/Cy5-siRNA,表明 PCPP/cy5-siRNA 能有效在肿瘤部位聚集。体内药效学实验表明,PCPP/siSur 能够显著抑制肿瘤生长(抑瘤率 61.6%)和转移。
2.2 聚酰胺-胺型树枝状聚合物
聚酰胺-胺型树枝状聚合物(PAMAM)结构中含有大量的伯胺和仲胺,因此也具有质子海绵效应。此外,PAMAM 具有独特的球形结构和可生物降解性,已被广泛用作核酸药物载体,其中 SuperFect™作为商品化的转染试剂已被大众熟知。通过对 PAMAM 进行结构修饰,使其在保留原有结构优势的基础上,提高转染效果或赋予其靶向功能。Chang 等[36]采用同时含有苯基和胍基的化合物 GBA 对 G5-PAMAM 进行修饰得到聚合物 G5-GBA60,与 siRNA 共孵育制备 G5-GBA60/siRNA 纳米粒(粒径 200 nm、PDI < 0.3、zeta 电位 30 ~ 40 mV)。研究表明,G5-GBA60/siLuc 纳米粒在 HeLa-luc 细胞上表现出与 Lipofectamine 2000 相当的转染效果,在人骨肉瘤细胞 U2OS 上可使bcl-2 基因的表达下调约 80%,优于 Lipofectamine 2000。
2.3 聚甲基丙烯酸二甲氨基乙酯
聚甲基丙烯酸二甲氨基乙酯(PDMAEMA)也是一种较为常见的阳离子聚合物,它具有良好的亲水性和生物相容性,易于功能化,且当体系温度或 pH 发生变化时,PDMAEMA 分子结构中的叔胺基发生质子化或去质子化,引起聚合物的相态发生改变,因此可作为刺激响应性高分子材料用于核酸药物递送载体的制备。PDMAEMA 的转染效率与相对分子量密切相关,通常情况下相对分子质量大于 300 kD 的 PDMAEMA 具有较高的转染效果,但因其在体内不能被降解,容易引起严重的细胞毒性。减小 PDMAEMA 的相对分子质量可降低细胞毒性,但转染效率也随之减小。为降低 PDMAEMA 引起的细胞毒性,研究人员通过结构修饰赋予 PDMAEMA 可生物降解的特性,大大提高了转染效率,并降低了毒副作用。Wang 等[37]采用可生物降解的聚[(R)-3-羟基丁酸酯](PHB)对 PDMAEMA 进行修饰,得到聚合物 PHB-PDMAEMA,该聚合物可用于紫杉醇和 Nur77 基因的共递送,Nur77 基因可逆转耐药细胞株 HepG2/Bcl-2 中 Bcl-2 蛋白表达,与紫杉醇发挥协同抗肿瘤效果。Palanca-Wessels 等[38]采用曲妥珠单抗对 PDMAEMA 聚合物胶束进行修饰得到具有 HER 2 靶向性的纳米载体,用该载体递送 siRNA,可使靶蛋白在 96 h 内持续下调 80%;体内实验表明,曲妥珠单抗的修饰能够增加纳米载体在肿瘤部位的聚集,并使靶基因的表达下调 70%。
2.4 阳离子型聚氨酯
阳离子型聚氨酯具有良好的水溶性,其在体内可被快速降解。常见的阳离子型聚氨酯包括聚(4-羟基-L-脯氨酸甲酯)(PHP)、聚[γ-(4-氨基丁基)-L-乙醇酸](PAGA)、聚(β-氨基酯) 等,其中 PHP 为最早用于核酸类药物递送的阳离子型聚氨酯,其在生理条件下生物半衰期为 2 h,PHP 与 DNA 结合形成复合物,在 4 h 内可保护 DNA 免遭核酸酶降解。
PAGA具有与 PHP 相似的降解行为,其与 DNA 形成的复合物转染效率比 PLL/DNA 高 2 倍,且无明显细胞毒性[39]。Yu 等[40]采用 pH 敏感型聚合物聚 2-(异丙基氨基)甲基丙烯酸乙酯(PDPA)和 PEG 对 PAGA 进行修饰,制备出 pH 敏感的三嵌段共聚物 PEG-b-PAGA-b-PDPA,用该聚合物共递送 siRNA-p65 和顺铂前药,在肿瘤酸性微环境下,PDPA 核心质子化,聚合物胶束解体,释放顺铂前体药物和 siRNA-p65,协同抑制肿瘤生长,并通过下调 NF-κB 的表达,抑制癌细胞的转移,可用于转移性乳腺癌的治疗。聚(β-氨基酯) 含有质子化胺基和可降解键,在生理条件下可被快速降解,其作为核酸药物递送载体,具有较高的转染效率。Cutlar 等[41]采用“A2 + B3/B2”策略合成了高分支状聚(β-氨基酯)(HPAEs),与线性聚(β-氨基酯)和市售转染试剂 SuperFect™相比,HPAEs 具有较低的细胞毒性,并对 HeLa 细胞有较高的转染效率。
2.5 壳聚糖及其衍生物
壳聚糖(CS)因具有制备简单、成本低廉、良好的生物相容性和生物可降解性等独特优势,而成为体内核酸递送的良好载体材料。壳聚糖为甲壳素脱乙酰基后的水解产物,它的分子中含有游离氨基,在弱酸性环境下可与带负电的核酸药物自发形成聚合物纳米粒。壳聚糖纳米粒的转染效果与壳聚糖脱乙酰化程度、相对分子质量、环境 pH、有无血清、壳聚糖/DNA 的电荷比及细胞类型等相关[42]。对壳聚糖纳米粒进行适当的改性修饰,可增加其转染效率。
Arami 等[43]制备了一种具有生物相容性和可降解性的纳米递送载体 Fe3O4-PEG-LAC-chitosan-PEI,该载体能够有效递送 survivin siRNA 至人乳腺癌细胞 MCF-7(48 h 细胞摄取率 64.70%),显著降低 survivin 蛋白的表达水平,联合使用米托蒽醌,可增加细胞对米托蒽醌的敏感性。He 等[44]采用叶酸修饰的壳聚糖纳米粒(FA-CS)介导 mIP-10 基因的体内靶向递送,在 B16 细胞(小鼠黑色素瘤细胞)皮下荷瘤小鼠模型中,FA-CS-mIP-10 能够增强肿瘤微环境中 IP-10 基因的表达,促使黑色素瘤特异性细胞毒性 CD8+CD28+T 淋巴细胞向肿瘤部位转移,有效抑制肿瘤细胞的增殖,联合肿瘤免疫疗法可提高黑色素瘤的治疗效果。
3 基于阳离子肽的核酸药物纳米载体
阳离子肽即细胞穿膜肽(CPPs)是一类富含碱性氨基酸的短肽序列,荷正电,其作为核酸药物递送载体,既可提高核酸药物的入胞效率,也可赋予递送载体靶向功能,因此备受关注。常见的阳离子肽包括 TAT、R15、R9、鱼精蛋白等。
3.1 TAT
单独使用 TAT 作为核酸药物载体通常具有较低的转染效率。Saleh 等[45]采用膜活性肽 LK15 对 TAT进行修饰得到 Tat-LK15,采用 Tat-LK15/DNA 复合物转染人纤维肉瘤细胞 HT1080 或人结肠癌细胞 HT29,可使 TAT 的转染效率分别提高10 倍和 100 倍。此外,采用 TAT 对纳米载体进行修饰,不仅可以提高细胞摄取效率,也可以提高载体的入核效率。Malhotra 等[46]将 TAT 与壳聚糖通过 PEG 共价缀合并制备形成 CS-PEG-TAT 纳米粒,在 pH 6 的条件下,该载体能够介导 siGLO-绿色转染指示剂高效入胞,荧光强度显著高于对照组。Wang 等[47]证实了 TAT 修饰的壳聚糖阳离子胶束能够实现阿霉素和 p53 基因核靶向递送。
3.2 R15
Zhang 等[48]将富含精氨酸阳离子肽 R15 通过可还原的二硫键缀合在聚乙二醇-丙交酯(PEG-b-PLA)上得到氧化还原敏感型嵌段聚合物 PEG-PLA-SS-R15,其在水溶液中形成具有壳-核结构的胶束(micelles),与 miR-21 共孵育得 micelleplexes,粒径(19.9 ± 3.0)nm、zeta 电位(4.95 ±0.43)mV。研究表明,micelleplexes 在脑脊液中比在人血浆中具有更高的稳定性,有利于中枢神经系统肿瘤疾病的治疗。
3.3 R9
Yoo 等[49]将改性的九聚精氨酸(mR9)通过二硫键聚合成具有氧化还原敏感型的分支状高聚物 B-mR9。研究表明,当 N/P = 15 时,B-mR9/pDNA 对 HEK293 细胞、HeLa 细胞和 SKOV3 细胞的转染效率分别为 37.57%、50.05% 和 31.30%,显著高于 R9/pDNA 和 mR9/pDNA;当 N/P = 10 时,B-mR9/siVEGF 能使 HeLa 细胞、SKOV3 细胞和 NCI-H460 细胞中 VEGF 蛋白表达下调 33.10%、55.20% 和 80.29%;在人肺癌细胞株 NCI-H460 荷瘤小鼠模型中,B-mR9/siVEGF 能够靶向至肿瘤部位,显著抑制瘤体积的增长。
3.4 鱼精蛋白
Yu 等[50]将低分子量的鱼精蛋白(LMWP)与 siRNA以 PEG 作为交联剂通过二硫键连接起来形成LMWP-PEG-S-S-siRNA 共价缀合物,与 LMWP/siRNA 络合物相比,该共价缀合物不易产生聚集现象;研究表明,LMWP-PEG-S-S-siRNA 可介导 siRNA 高效进入人乳腺癌细胞(绿色荧光蛋白标记)MDA-MB-231-EGFP,诱导 EGFP 表达下调至 21.21%,转染效果显著优于 LMWP/siRNA(41.32%)。
4 基于阳离子的无机纳米粒核酸药物纳米载体
无机纳米粒作为药物递送载体具有良好的生物相容性,其制备简单、粒径和表面性质可控、易于修饰、载药量大。部分无机纳米粒经过阳离子材料修饰后用于核酸类药物的体内递送,如金纳米粒(AuNPs)、氧化铁纳米粒、碳纳米管(CNTs)、二氧化硅纳米粒(SiNPs)及上转换纳米粒(UCNPs)等。
4.1 金纳米粒
AuNPs 的直径为 10 ~ 20 nm,是一种具有多种生物学功能的新型材料。Lee等[51]采用具有还原性的邻苯二酚与支链 PEI(25 kD)形成的共价缀合物 PEI-g-catechol(PEI-C)对 AuNPs 进行修饰得到 PEI-C-AuNPs,通过控制 PEI-C 中邻苯二酚的取代度可调控 PEI-C-AuNPs的粒径和表面性质;研究结果表明,采用 PEI-C-AuNPs-5 将 GFP siRNA 递送至人乳腺癌高转移细胞 MDA-MB-435,可诱导 GFP 表达下调至(27.8 ± 4.3)%,与 bPEI/siRNA 具有相当的基因沉默效率(21.0 ± 3.7)%。
4.2 氧化铁纳米粒
氧化铁纳米粒作为核酸药物递送载体具有尺寸小、比表面积大、无免疫原性等优势,其在体内不易降解成有毒物质,多以原型排出。氧化铁纳米粒具有超顺磁性,在外加磁场的作用下,可定向移动,实现药物的靶向递送。Lee等[52]将超小型超顺磁性氧化铁纳米粒子(USPIO)包裹于 PDMA-b-PCL 阳离子胶束的疏水核心,用该载体共递送7-乙基-10-羟基喜树碱(SN-38)和 VEGF siRNA,制备形成 SN-38/USPIO-loaded siRNA-PEG 胶束(粒径 237.7 nm、PDI 0.106、Zeta 电位为 34.2 mV);在人结直肠癌细胞 LS174T 荷瘤小鼠模型中,USPIO 的加入,能够显著增加 SN-38 和 VEGF siRNA 的抑瘤效果。此外,USPIO 纳米粒可用于磁共振成像,实时监测治疗效果。Shi 等[53]通过微乳液法制备了具有壳核结构的四氧化三铁磁性二氧化硅纳米粒 Fe3O4@SiO2,并采用聚丙烯胺盐酸盐(PAH)对其进行修饰,得到表面电位为正的磁性纳米粒 Fe3O4@SiO2/PAH;在外加磁场的作用下,该磁性纳米粒可介导 pDNA 有效递送至 HeLa 细胞,实现 pDNA 在 HeLa 细胞中高表达。
4.3 碳纳米管
碳纳米管(CNTs)是一种惰性载体,须经过功能化修饰才可用于核酸药物体内递送。CNTs 包括单壁碳纳米管(SWNT)和多壁碳纳米管(MWNT)两种结构,通常SWNT 转染效率优于 MWNT[54]。Ohta 等[55]采用PEG 和阳离子肽(KWKG)7对 SWNT 进行修饰,得到 SWCNT-(KWKG)7-(PEG)12,将其与 pDNA 共孵育形成的纳米复合物 SWCNT-(KWKG)7-(PEG)12/pDNA,该纳米复合物具有良好的稳定性,即使在细胞培养基中也能稳定存在24 h;该载体能够将编码 mKO2 的 pDNA 有效递送至人非小细胞肺癌细胞 A549,使得细胞中 mKO2 荧光蛋白的表达显著增强(相对荧光强度 25 ~ 60)。
4.4 二氧化硅纳米粒
Rejeeth 和 Salem[56]制备了一种新型阳离子荧光硅纳米颗粒(LSNs),用其递送 p53 基因用于乳腺癌的治疗。研究表明,p53-EGFP/LSNs 纳米粒具有良好的血清稳定性,可实现 p53-EGFP 在体内外高效递送,使得 p53 和 EGFP mRNA 在较长时间内持续表达,细胞凋亡率为32.09%,优于市售转染试剂 Lipofectin(28.00%)。Zarei 等[57]采用 PEI对磷酸盐修饰的介孔二氧化硅纳米粒(PMSNs)进一步修饰得到表面荷正电的纳米载体 PMSNs-PEI,该载体能够有效负载绿色荧光蛋白质粒(pGFP),与 PEI/pGFP 相比,PMSNs-PEI/pGFP 可显著增强小鼠神经母细胞瘤细胞Neuro-2 A 中绿色荧光蛋白的表达。
4.5 上转化纳米粒
Song 等[58]采用溶剂热法合成了上转化纳米粒(UCNPs),并采用薄膜分散法在 UCNPs 表面包裹一层阳离子磷脂 CDO14,形成粒径为 45 ~ 50 nm、zeta 电位约 54.4 mV 的固体脂质纳米粒(CSLNs),该载体同时具有核酸递送和生物成像的功能。凝胶电泳实验表明,CSLNs/siRNA 质量比大于 4 时,能够实现 siRNA 的全部包载;将 CSLNs与人肺癌细胞 A549 共孵育 4 h,采用 980 nm 的激发光源,结果表明CSLNs均匀地分布在细胞质中,且具有较低的细胞毒性,可将稳定表达荧光素酶的 siRNA 递送至 A549 细胞,基因沉默效率为 70%。
5 小结
肿瘤的发生、发展和复发与基因异常密切相关,核酸药物在肿瘤治疗中具有独特优势。核酸药物易被核酸酶降解,因此需要借助适宜载体才能实现核酸药物体内高效递送。根据核酸药物荷负电的理化特性,近年来,科学家探索了诸多阳离子纳米载体作为核酸药物的递送工具。除了 2018 年8 月美国 FDA 批准首个 siRNA 药物(OnpattoTM,patisiran,用于遗传性甲状腺素转运蛋白淀粉样变性引起的周围多发性神经疾病,将 siRNA 包裹在脂质纳米颗粒中经静脉输注给药)以外,时至今日,仍未见全身给药的抗肿瘤核酸药物纳米制剂应用于临床。之所以如此,不仅是因为核酸药物易被核酸酶降解失活,还因为核酸药物体内递送载体及载核酸纳米粒的稳定性、安全性、有效性和质量可控性等一系列的关键性问题均未得以解决,限制了核酸药物向临床转化的进程。
目前,已有许多研究表明阳离子纳米递送载体在体内外均展现了良好的基因转染效果,也有通过构建靶向和(或)环境敏感的智能型纳米载体,实现抗肿瘤核酸药物的靶向递送和控制释放,部分载体介导的抗肿瘤核酸药物已经进入临床研究阶段,但距离核酸药物广泛上市还存在差距。随着科学家的探究和积累,抗肿瘤核酸药物体内高效、安全、稳定的递送一定会实现。
[1] Naldini L. Gene therapy returns to centre stage. Nature, 2016, 526(7573):351-360.
[2] Lundstrom K. Viral vectors in gene therapy. Diseases, 2018, 6(2):42.
[3] Choi JW, Lee JS, Kim SW, et al. Evolution of oncolytic adenovirus for cancer treatment. Adv Drug Deliv Rev, 2012, 64(8):720-729.
[4] Mochizuki S, Kanegae N, Nishina K, et al. The role of the helper lipid dioleoylphosphatidylethanolamine (DOPE) for DNA transfection cooperating with a cationic lipid bearing ethylenediamine. Biochim Biophys Acta, 2012, 1828(2):412-418.
[5] Giselbrecht J, Janich C, Pinnapireddy SR, et al. Overcoming the polycation dilemma-explorative studies to characterise the efficiency and biocompatibility of newly designed lipofection reagents. Int J Pharma, 2018, 541(1-2):81-92.
[6] Haghiralsadat F, Amoabediny G, Naderinezhad S, et al. Preparation of PEGylated cationic nanoliposome-siRNA complexes for cancer therapy. Artif Cells Nanomed Biotechnol, 2018, 64(1):684-692.
[7] Bathula SR, Sharma K, Singh DK, et al. siRNA delivery using a cationic-lipid-based highly selective human DNA ligase I inhibitor. ACS Appl Mater Interfaces, 2018, 10(2):1616-1622.
[8] Dolatabadi JEN, Omidi Y. Solid lipid-based nanocarriers as efficient targeted drug and gene delivery systems. Trac-trend Anal Chem, 2016, 77:100-108.
[9] Akbaba H, Akbaba GE, Kantarci AG. Development and evaluation of antisense shRNA-encoding plasmid loaded solid lipid nanoparticles against 5-α reductase activity. J Drug Deliv Sci Technol, 2018, 44:270-277.
[10] Zang X, Ding H, Zhao X, et al. Anti-EphA10 antibody-conjugated pH-sensitive liposomes for specific intracellular delivery of siRNA. Int J Nanomedicine, 2016, 11:3951-3967.
[11] Saavedra-Alonso S, Zapata-Benavides P, Chavez-Escamilla AK, et al. WT1 shRNA delivery using transferrin-conjugated PEG liposomes in an in vivo model of melanoma. Exp Ther Med, 2016, 12(6):3778- 3784.
[12] Kabilova TO, Shmendel EV, Gladkikh DV, et al. Targeted delivery of nucleic acids into xenograft tumors mediated by novel folate-equipped liposomes. Eur J Pharm Biopharm, 2018, 123:59-70.
[13] Oh HR, Jo HY, Park JS, et al. Galactosylated liposomes for targeted co-delivery of doxorubicin/vimentin siRNA to hepatocellular carcinoma. Nanomaterials, 2016, 6(8):141.
[14] Sato Y, Hatakeyama H, Sakurai Y, et al. A pH-sensitive cationic lipid facilitates the delivery of liposomal siRNA and gene silencing activity in vitro and in vivo. J Control Release, 2012, 163(3):267-276.
[15] Hatakeyama H, Murata M, Sato Y, et al. The systemic administration of an anti-miRNA oligonucleotide encapsulated pH-sensitive liposome results in reduced level of hepatic microRNA-122 in mice. J Control Release, 2014, 173(2):43-50.
[16] Khalil IA, Kimura S, Sato Y, et al. Synergism between a cell penetrating peptide and a pH-sensitive cationic lipid in efficient gene delivery based on double-coated nanoparticles. J Control Release, 2018, 275:107-116.
[17] Cheng R, Feng F, Meng F, et al. Glutathione-responsive nano-vehicles as a promising platform for targeted intracellular drug and gene delivery. J Control Release, 2011, 152(1):2-12.
[18] Candiani G, Pezzoli D, Ciani L, et al. Bioreducible liposomes for gene delivery: from the formulation to the mechanism of action. PLoS One, 2010, 5(10):e13430.
[19] Wang J, Ayano E, Maitani Y, et al. Enhanced cellular uptake and gene silencing activity of siRNA using temperature-responsive polymer-modified liposome. Int J Pharm, 2017, 523(1):217-228.
[20] Na K, Lee SA, Jung SH, et al. Elastin-like polypeptide modified liposomes for enhancing cellular uptake into tumor cells. Colloids Surf B Biointerfaces, 2012, 91:130-136.
[21] Fouladi F, Steffen KJ, Mallik S. Enzyme-responsive liposomes for the delivery of anticancer drugs. Bioconj Chem, 2017, 28(4):857-868.
[22] Song SJ, Lee S, Lee Y, et al. Enzyme-responsive destabilization of stabilized plasmid-lipid nanoparticles as an efficient gene delivery. Eur J Pharm Sci, 2016, 91:20-30.
[23] Liu P, Yu H, Sun Y, et al. A mPEG-PLGA-b-PLL copolymer carrier for adriamycin and siRNA delivery. Biomaterials, 2012, 33(17):4403- 4412.
[24] Kodama Y, Kuramoto H, Mieda Y, et al. Application of biodegradable dendrigraft poly-L-lysine to a small interfering RNA delivery system. J Drug Target, 2017, 25(1):49-57.
[25] Kamaruzaman KA, Moyle PM, Toth I. Peptide-based multicomponent oligonucleotide delivery systems: optimisation of poly-l-lysine dendrons for plasmid DNA delivery. Int J Pept Res Ther, 2017, 23(1):119-134.
[26] Guo J, Ogier JR, Desgranges S, et al. Anisamide-targeted cyclodextrin nanoparticles for siRNA delivery to prostate tumours in mice. Biomaterials, 2012, 33(31):7775-7784.
[27] Evans JC, Malhotra M, Guo J, et al. Folate-targeted amphiphilic cyclodextrin.siRNA nanoparticles for prostate cancer therapy exhibit PSMA mediated uptake, therapeutic gene silencing in vitro and prolonged circulation in vivo. Nanomedicine, 2016, 12(8):2341-2351.
[28] Jiang Q, Zhang Y, Zhuo R, et al. Supramolecular host-guest polycationic gene delivery system based on poly(cyclodextrin) and azobenzene-terminated polycations. Colloids Surf B Biointerfaces, 2016, 147:25-35.
[29] Wen C, Hu Y, Xu C, et al. Reducible polyrotaxane-based pseudo-comb polycations via consecutive ATRP processes for gene delivery. Acta Biomaterialia, 2016, 32:110-119.
[30] Ewe A, Przybylski S, Burkhardt J, et al. A novel tyrosine-modified low molecular weight polyethylenimine (P10Y) for efficient siRNA delivery in vitro and in vivo. J Control Release, 2016, 230:13-25.
[31] Parmar MB, Meenakshi Sundaram DN, Remant-Bahadur KC, et al. Combinational siRNA delivery using hyaluronic acid modified amphiphilic polyplexes against cell cycle and phosphatase proteins to inhibit growth and migration of triple-negative breast cancer cells. Acta Biomater, 2017, 66:294-309.
[32] Hong WG, Jeong GW, Nah JW. Evaluation of hyaluronic acid-combined ternary complexes for serum-resistant and targeted gene delivery system. Int J Biol Macromol, 2018, 115:459-468.
[33] Pinnapireddy SR, Duse L, Strehlow B, et al. Composite liposome-PEI/nucleic acid lipopolyplexes for safe and efficient gene delivery and gene knockdown. Colloids Surf B Biointerfaces, 2017, 158:93-101.
[34] Liu L, Zheng MY, Librizzi D, et al. Efficient and tumor targeted siRNA delivery by polyethyleniminegraft-polycaprolactone-block- poly (ethylene glycol)-folate (PEI-PCL-PEG-Fol). Mol Pharm, 2016, 13(1):134-143.
[35] Fan B, Kang L, Chen L, et al. Systemic siRNA delivery with a dual pH-responsive and tumor-targeted nanovector for inhibiting tumor growth and spontaneous metastasis in orthotopic murine model of breast carcinoma. Theranostics, 2017, 7(2):357-376.
[36] Chang H, Zhang J, Wang H, et al. A Combination of guanidyl and phenyl groups on a dendrimer enables efficient siRNA and DNA delivery. Biomacromolecules, 2017, 18(8):2371-2378.
[37] Wang X, Liow SS, Wu Q, et al. Codelivery for paclitaxel and Bcl-2 conversion gene by PHB-PDMAEMA amphiphilic cationic copolymer for effective drug resistant cancer therapy. Macromol Biosci, 2017, 17(11).
[38] Palanca-Wessels MC, Booth GC, Convertine AJ, et al. Antibody targeting facilitates effective intratumoral siRNA nanoparticle delivery to HER2-overexpressing cancer cells. Oncotarget, 2016, 7(8):9561- 9575.
[39] Lim YB, Han SO, Kong HU, et al. Biodegradable polyester, poly[α-(4-aminobutyl)-l-glycolic acid], as a non-toxic gene carrier. Pharm Res, 2000, 17(7):811-816.
[40] Yu H, Guo C, Feng B, et al. Triple-layered pH-responsive micelleplexes loaded with siRNA and cisplatin prodrug for NF-Kappa B targeted treatment of metastatic breast cancer. Theranostics, 2016, 6(1):14-27.
[41] Cutlar L, Zhou D, Gao Y, et al. Highly branched poly (β-amino esters): synthesis and application in gene delivery. Biomacromolecules, 2015, 16(9):2609-2617.
[42] Kim TH, Jiang HL, Jere D, et al. Chemical modification of chitosan as a gene carrier in vitro and in vivo. Prog Polymer Sci, 2007, 32(7):726- 753.
[43] Arami S, Mahdavi M, Rashidi MR, et al. Apoptosis induction activity and molecular docking studies of survivin siRNA carried by Fe3O4-PEG-LAC-chitosan-PEI nanoparticles in MCF-7 human breast cancer cells. J Pharm Biomed Anal, 2017, 142:145-154.
[44] He J, Duan S, Yu X, et al. Folate-modified chitosan nanoparticles containing the IP-10 gene enhance melanoma-specific cytotoxic CD8(+)CD28(+) T lymphocyte responses. Theranostics, 2016, 6(5): 752-761.
[45] Saleh AF, Aojula H, Arthanari Y, et al. Improved Tat-mediated plasmid DNA transfer by fusion to LK15 peptide. J Control Release, 2010, 143(2):233-242.
[46] Malhotra M, Tomaro-Duchesneau C, Saha S, et al. Development and characterization of chitosan-PEG-TAT nanoparticles for the intracellular delivery of siRNA. Int J Nanomed, 2013, 8:2041-2052.
[47] Wang GH, Cai YY, Du JK, et al. TAT-conjugated chitosan cationic micelle for nuclear-targeted drug and gene co-delivery. Colloids Surf B Biointerfaces, 2018, 162:326-334.
[48] Zhang Y, Buhrman JS, Liu Y, et al. Reducible micelleplexes are stable systems for anti-miRNA delivery in cerebrospinal fluid. Mol Pharm, 2016, 13(6):1791-1799.
[49] Yoo J, Lee DY, Gujrati V, et al. Bioreducible branched poly (modified nona-arginine) cell-penetrating peptide as a novel gene delivery platform. J Control Release, 2017, 246:142-154.
[50] Yu Z, Ye J, Pei X, et al. Improved method for synthesis of low molecular weight protamine-siRNA conjugate. Acta Pharm Sin B, 2018, 8(1):116-126.
[51] Lee Y, Lee SH, Kim JS, et al. Controlled synthesis of PEI-coated gold nanoparticles using reductive catechol chemistry for siRNA delivery.J Control Release, 2011, 155(1):3-10.
[52] Lee SY, Yang CY, Peng CL, et al. A theranostic micelleplex co-delivering SN-38 and VEGF siRNA for colorectal cancer therapy. Biomaterials, 2016, 86:92-105.
[53] Shi M, Liu Y, Xu M, et al. Core/Shell Fe3O4 @SiO2 nanoparticles modified with PAH as a vector for EGFP plasmid DNA delivery into HeLa cells. Macromol Biosci, 2011, 11(11):1563-1569.
[54] Richard C, Mignet N, Largeau C, et al. Functionalization of single- and multi-walled carbon nanotubes with cationic amphiphiles for plasmid DNA complexation and transfection. Nano Res, 2009, 2(8): 638-647.
[55] Ohta T, Hashida Y, Higuchi Y, et al. In vitro cellular gene delivery employing a novel composite material of single-walled carbon nanotubes associated with designed peptides with PEGylation. J Pharm Sci, 2017, 106(3):792-802.
[56] Rejeeth C, Salem A. Novel luminescent silica nanoparticles (LSN): p53 gene delivery system in breast cancer in vitro and in vivo.J Pharm Pharmacol, 2016, 68(3):305-315.
[57] Zarei H, Kazemi Oskuee R, Hanafi-Bojd MY, et al. Enhanced gene delivery by polyethyleneimine coated mesoporous silica nanoparticles. Pharm Dev Technol, 2019, 24(1):127-132.
[58] Song C, Zhang S, Zhou Q, et al. Bifunctional cationic solid lipid nanoparticles of β-NaYF4:Yb,Er upconversion nanoparticles coated with a lipid for bioimaging and gene delivery. RSC Advances, 2017, 7(43):26633-26639.
国家自然科学基金(81673383、81603063、81803479)
夏桂民,Email:xiaguimin@126.com
2019-11-08
10.3969/j.issn.1673-713X.2020.04.014
