昆虫病原真菌长孢蜡蚧菌TF-2菌株对豌豆蚜的侵染过程和致病力
2020-08-06张挺峰刘长仲
张挺峰, 王 睿, 刘长仲,*
(1.甘肃农业大学植物保护学院, 甘肃省农作物病虫害生物防治工程实验室, 兰州 730070; 2. 河西学院农业与生物技术学院, 甘肃张掖 734000)
豌豆蚜Acyrthosiphonpisum,又称豆蚜、豆无网长管蚜,隶属于昆虫纲(Insecta)半翅目(Hemiptera)蚜科(Aphididae)无网蚜属Acyrthosiphon,广泛地分布于世界各地,是重要的农业害虫之一(贺春贵, 2004),主要为害豌豆Pisumsativum、蚕豆Viciafaba、紫花苜蓿Medicagosativa和扁豆Lablabpurpureus等多种豆科作物和牧草(Caillaudetal., 2002; Andarge and Van Der Westhuizen, 2004; Edwards and Singh, 2006; Gaoetal., 2008; 吕宁和刘长仲, 2014; Soleimani and Madadi, 2015)。豌豆蚜以成蚜和若蚜群集于叶片背面、嫩茎、嫩梢上吸食汁液,致使叶片卷缩、变黄,植物营养损失、发育受阻甚至全株枯死(杨彩霞等, 2005; Goggin, 2007)。除直接取食为害外,豌豆蚜取食时分泌大量蜜露影响植物的光合作用和呼吸作用,其唾液还可传播30余种病毒,造成的经济损失远远超过其直接为害的损失。
目前,蚜虫最主要的防治方法是化学防治,长期化学杀虫剂的使用导致害虫产生抗药性、再猖獗、次要害虫上升、农药残留等影响人畜健康、食品安全和环境质量的一系列问题(Carrow,1986; Scottetal., 1998; Bielza, 2008; Gaoetal., 2012)。在过去的几十年里,利用昆虫病原真菌控制害虫被视为化学措施的替代或补充,昆虫病原真菌流行病的发生,可自然制约害虫的种群数量,维持生态平衡,减少化学农药的用量,降低防治成本,减少环境污染。Hajek和St Leger (1994)研究了蜡蚧轮枝菌Verticilliumlecanii对蚜虫的侵染过程,将其概括为6个阶段:分生孢子附着落于虫体表面、孢子萌发、表面菌丝铺展、侵入表皮、侵害发展和次生分生孢子的形成。而由于不同寄主体壁形态结构不同,导致孢子在体壁上萌发、侵入等的方式和速度不同,进而产生对不同昆虫致病性的差异。长孢蜡蚧菌Lecanicilliumlongisporum是一种高致病性的昆虫病原真菌,其宿主范围广泛,包括昆虫、螨虫、蜘蛛、线虫和植物病原真菌等,已被列为多种害虫的实用性生物防治剂(Kimetal., 2007),但其侵染豌豆蚜的过程和杀虫机理未见报道。为了揭示长孢蜡蚧菌侵染豌豆蚜的特点及其致病机理,本研究以前期分离鉴定的豌豆蚜致病真菌长孢蜡蚧菌TF-2菌株(张挺峰等, 2020)为材料,通过不同浓度分生孢子浸染豌豆蚜,分析其致病力,并在显微及超微状态下揭示长孢蜡蚧菌TF-2菌株对豌豆蚜的侵染特征,为开发和利用该菌株在田间或温室防治豌豆蚜奠定相应的理论基础。
1 材料与方法
1.1 供试菌株
豌豆蚜僵蚜采自甘肃农业大学苜蓿试验基地(兰州安宁区),先用75%乙醇消毒3 s,再用灭菌蒸馏水洗涤3次,放入1.5 mL离心管,加入0.5 mL灭菌蒸馏水,用组织匀浆器匀浆虫体并稀释10倍。取20 μL在PDA培养基上用涂布棒涂抹均匀,于恒温培养箱中(SPX-250-GB,上海跃进医疗器械有限公司)在25±1℃, 75%±5% RH, 光周期16L∶8D条件下培养5 d,用接种针挑取不同菌落的少量菌丝,转接到新的PDA培养基上继续培养,待各菌落生长10 d后,用2 mL 0.01% Tween-80无菌水冲洗各菌落获得分生孢子悬浮液,浸染豌豆蚜进行回接试验。回接试验获得一株具有高致死率菌株,经形态学和ITS序列测定并构建系统发育树对致病菌株进行分子鉴定,确定该菌株为长孢蜡蚧菌L.longisporumTF-2 菌株(GenBank登录号: MG834532) (张挺峰等, 2020),保存至4℃冰箱备用。
1.2 供试蚜虫
供试豌豆蚜于2017年5月采自甘肃农业大学苜蓿试验基地(兰州安宁区),将无翅胎生雌蚜单头饲养在盆栽蚕豆V.faba‘Lincan 2’(临蚕2号,购于甘肃省农业科学院)植株上,进行单克隆系培养,作为供试虫源。 在温度25±1℃、相对湿度50%±10%、光周期16L∶8D的条件下饲养,挑选个体大小一致的无翅成蚜供试。
1.3 分生孢子悬浮液制备
将保存于4℃冰箱TF-2菌株接种在PDA培养基,25℃下培养10 d,收集分生孢子。分生孢子液用2 mL 0.01% Tween-80无菌水冲洗菌落,在显微镜下配制分生孢子5个处理浓度梯度分别为: 1.0×103~1.0×107孢子/mL。
1.4 长孢蜡蚧菌TF-2菌株致病力测定
采用浸渍法(Yu, 2016)和改进的离体叶片培养法(Feng and Johnson, 1991)测定致病力。用毛笔挑选个体大小基本一致的无翅成蚜,分别浸入不同浓度TF-2菌株孢子悬浮液(1.0×103, 1.0×104, 1.0×105, 1.0×106和1.0×107孢子/mL)中,3~5 s后挑出,自然晾干。
选择浸渍处理后活动自如无残缺个体接入新鲜洁净蚕豆叶片上,用浸湿的棉团包裹叶柄,置于底铺滤纸的培养皿(直径为9 cm)内,在滤纸上滴无菌水保湿,每叶接虫5头,各浓度处理样本30头蚜虫,设置3个重复。用0.01% Tween-80无菌水处理作对照(CK)。
接入蚜虫后将培养皿放入温度25±1℃,相对湿度75%±5%,光周期16L∶8D的恒温培养箱中饲养蚜虫,每隔12 h观察1次,观察蚜虫发病症状,用体视显微镜(SteREO Discovery.V12, Carl Zeiss, 德国)拍照,统计死亡率,并将死蚜和若蚜及时清除。蚕豆叶柄棉花团适时补水,每隔3 d更换一次叶片。
1.5 扫描电镜观察
用1.3节制备好的TF-2菌株孢子悬浮液(1.0×107孢子/mL)浸渍豌豆蚜成虫后在离体叶片上饲养(方法同1.4节),分别于接种后12, 24, 48, 72和96 h取样,然后用2.5%戊二醛溶液固定2-3 h以上,保存于70%乙醇中。从70%乙醇中取出样品,放入浓度为80%, 85%, 90%, 95%和100%的乙醇中逐级脱水,每级脱水10 min,然后自然干燥(郭素枝和季清娥, 2001),喷金,置于扫描电镜(JSM-5600LV, 日本电子光学公司)下观察,拍照。
1.6 数据分析
数据采用SPSS19.0软件对不同浓度分生孢子处理豌豆蚜累计死亡率进行统计分析,半致死浓度(LC50)和半致死时间(LT50)进行回归分析。
2 结果
2.1 长孢蜡蚧菌TF-2菌株对豌豆蚜成虫致病力
长孢蜡蚧菌TF-2菌株不同浓度分生孢子浸染豌豆蚜成虫,随着孢子浓度加大,死亡时间缩短,死亡率相应增大。接种3 d后,豌豆蚜死亡率开始显著升高,浸染6 d内最低浓度(1.0×103孢子/mL)孢子悬浮液处理豌豆蚜成虫引起的累计死亡率为45.6%,而最高浓度(1.0×107孢子/mL)孢子悬浮液引起的累计死亡率达到100%(图1)。 不同浓度分生孢子悬浮液浸染豌豆蚜成虫6 d后,LC50的回归方程为y=0.51(±0.05)x-2.32(±0.25),LC50=3.26×104孢子/mL。TF-2菌株对豌豆蚜成虫的LT50随分生孢子浓度增大而逐渐变短,最低浓度(1.0×103孢子/mL)分生孢子处理豌豆蚜成虫时,LT50为7.29 d,最高浓度(1.0×107孢子/mL)处理时LT50为2.92 d(表1)。
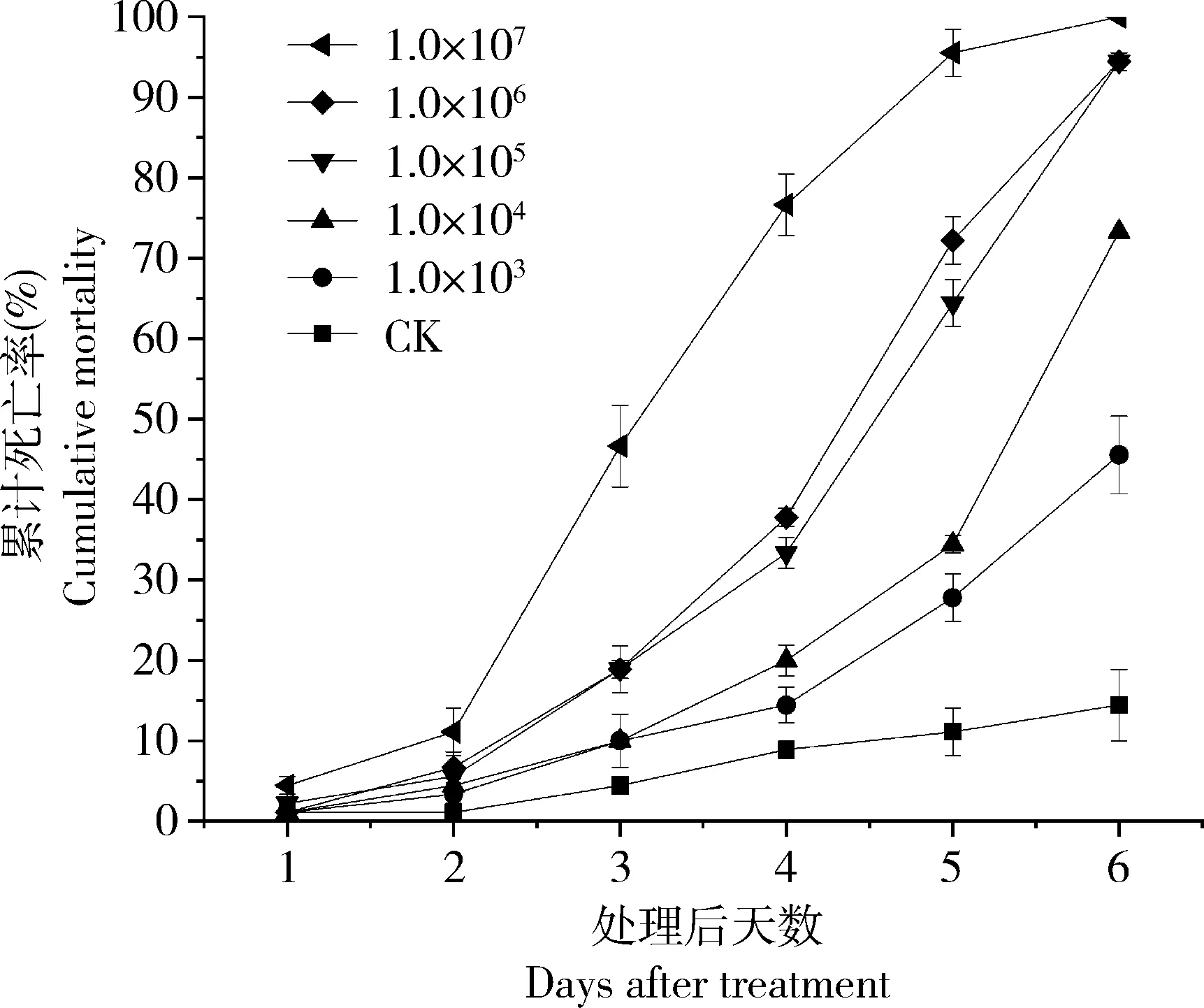
图1 长孢蜡蚧菌TF-2菌株不同浓度分生孢子 处理的豌豆蚜成虫6 d累计死亡率Fig. 1 Cumulative mortality of Acyrthosiphon pisum adults treated by Lecanicillium longisporum strain TF-2 at different conidial concentrations in 6 d CK: 0.01% Tween-80无菌水Sterilized water containing 0.01% Tween-80.
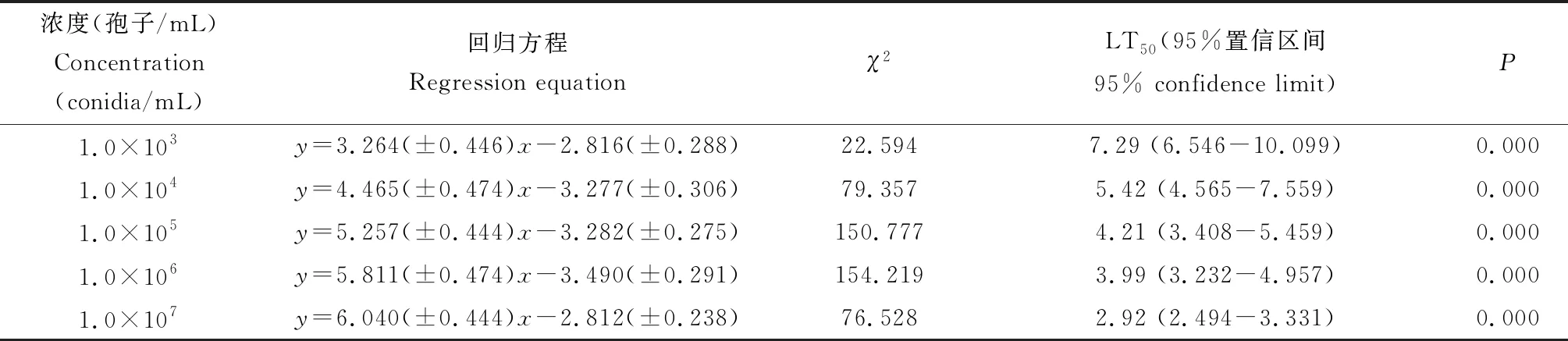
表1 长孢蜡蚧菌TF-2菌株不同浓度分生孢子对豌豆蚜成虫的半致死时间(LT50)Table 1 Median lethal time (LT50) of Lecanicillium longisporum strain TF-2 at different conidial concentrations to Acyrthosiphon pisum adults
2.2 长孢蜡蚧菌TF-2菌株侵染豌豆蚜的侵染症状
体视显微镜观察发现,1.0×107孢子/mL的长孢蜡蚧菌TF-2菌株孢子悬浮液接种2 d后,豌豆蚜成虫活动能力下降,行动迟缓,虫体颜色由红色逐渐变浅,在足关节、触角、腹管末端等有白色菌丝生长(图2: B, C),3 d后体色转暗身体开始僵硬(图2: D),4 d后虫体布满白色菌丝(图2: E),5 d后虫体干瘪菌丝体发达(图2: F)。而对照组豌豆蚜成虫体色保持红色不变(图2: A),行动自如。

图2 体视显微镜观察的长孢蜡蚧菌TF-2菌株对豌豆蚜成虫的侵染症状Fig. 2 Symptoms of Acyrthosiphon pisum adults infected by Lecanicillium longisporum strain TF-2 observed under stereoscopic microscopeA: 对照组虫体颜色保持红色不变Body color of the control group remained red; B: 接种2 d后腹管变暗并着生菌丝Cornicle turned dark and hyphae grew at 2 d post inoculation; C: 接种2 d天后,虫体颜色变浅Body colour became lighter and hyphae grew on the leg joints at 2 d post inoculation; D: 接种3 d后虫体僵硬颜色发暗Body was stiff and dark at 3 d post inoculation; E: 侵染4 d后虫体布满菌丝Body was covered with mycelium at 4 d post infection; F: 侵染5 d后虫体干瘪布满菌丝Body was wizened and covered with mycelium at 5 d post infection. 处理组中成虫用1.0×107孢子/mL孢子悬浮液浸渍,对照组则用0.01% Tween-80无菌水浸渍,后在离体叶片上饲养;图3同。Adults were immersed in conidial suspension at the concentration of 1.0×107 conidia/mL in the treatment group and in sterilized water containing 0.01% Tween-80 in the control group, and then reared on leaves in vitro. The same forFig. 3.
2.3 长孢蜡蚧菌TF-2菌株对豌豆蚜的侵染过程
豌豆蚜成虫在1.0×107孢子/mL的长孢蜡蚧菌TF-2菌株孢子悬浮液中浸渍后分别于12, 24, 48, 72和96 h取样固定,进行扫描电镜观察。电镜观察结果显示,接种后12 h,分生孢子附着在虫体表皮上(图3: A);接种后24 h,分生孢子萌发形成芽管和附着胞(图3: B, C);接种后48 h,芽管伸长形成菌丝在表皮上继续伸长(图3: D),并在蚜虫复眼、触角基部、足基节、腹末生殖节等部位形成网络结构(图3: D, E, F);接种后96 h,菌丝布满虫体全身,新的分生孢子产生(图3: G, H)。

图3 扫描电镜观察的长孢蜡蚧菌TF-2菌株分生孢子对豌豆蚜成虫侵染过程Fig. 3 Infection process of the conidia of Lecanicillium longisporum strain TF-2 to Acyrthosiphon pisum adults observed under scanning electron microscopeA: 接种后12 h, 分生孢子附着在表皮上Conidia attached to the epidermis at 12 h post inoculation; B, C: 接种后24 h, 分生孢子萌发形成芽管和附着胞Conidia germinated to form a bud tube and appressorium at 24 h post inoculation; D, E, F: 接种后48 h, 菌丝生长形成网络Hypha grew to form a network at 48 h post inoculation; G, H: 接种后96 h,产生分生孢子Conidia formed at 96 h post inoculation. Ap: 附着胞Appressorium; Co: 分生孢子Conidia; Hp: 菌丝Hyphae.
3 讨论
昆虫病原真菌作为生物防治的一个重要组成部分,在持续控制虫害、保护生态平衡方面具有不可替代的作用(Shah and Pell, 2003)。本研究利用前期分离鉴定的豌豆蚜致病真菌长孢蜡蚧菌TF-2菌株进行致病力和侵染方式研究,结果表明,长孢蜡蚧菌TF-2菌株对豌豆蚜成虫具有较强的致病力,其分生孢子侵染方式为先附着,然后萌发形成芽管和附着胞,芽管延长形成菌丝在虫体表面交织成网络状,最后覆盖整个虫体并产生新的分生孢子。本研究中,长孢蜡蚧菌TF-2菌株不同分生孢子浓度处理豌豆蚜6 d后,LC50为3.26×104孢子/mL,最高浓度(1.0×107孢子/mL)侵染成虫,LT50为2.92 d,致病力随分生孢子浓度梯度升高而逐渐增强(图1; 表1)。这一结果与德黑兰大学Safavi室内测试蜡蚧轮枝菌V.lecanii商品制剂Vealrtec®对豌豆蚜毒力结果基本一致,随分生孢子浓度增加豌豆蚜致死率升高,LC50为5.14×104孢子/mL(Safavi Etal, 2002)。同样在室内条件下,L.attenuatumYZU 151121菌株侵染豌豆蚜6 d,LC50为3.12×106孢子/mL(Wangetal., 2017),L.longisporumLRC190侵染欧洲赤松蚜Cinarapini成虫9 d, LC50为1.2×106孢子/mL (Nazemietal., 2014)。L.longisporumLRC190分生孢子最高浓度(1×108孢子/mL)侵染牧草蚜Siphamaydis和麦无网产管蚜Metopolophiumdirhodum, LT50分别为2.9 d和4.4 d (Fadayivataetal., 2014)。以上室内毒力试验结果均表明,蜡蚧轮枝菌商品制剂Vealrtec®,L.attenuatumYZU 151121和L.longisporumLRC190相比,长孢蜡蚧菌TF-2菌株具有较强的致病力,是一种具有生物防治应用潜力的寄生真菌。同时也表明病原微生物毒力的强弱与不同地理位置筛选的菌株、不同寄主的抗病能力以及实验条件的差异等具有非常密切的关系(Vuetal., 2007; Mohammedetal., 2018)。
本研究扫描电镜和体视显微镜观察显示长孢蜡蚧菌TF-2菌株分生孢子成功侵染豌豆蚜。接种12 h后,附着在豌豆蚜体表上的TF-2菌株孢子全部萌发(图3: A),与之相对应接种48 h后豌豆蚜表现出行动迟缓,体色先变浅后发暗,最后变瘪全身布满白色菌丝形成僵蚜(图2: C, D, E, F),说明TF-2菌株对豌豆蚜具有较好的侵染能力。通过扫描电镜观察发现,TF-2菌株分生孢子附着在虫体表皮形成芽管和附着胞(图3: A, B, C),在附着部位呈现凹陷状,附着胞产生粘液层,粘液层可能是附着胞分泌产生一些分解表皮的水解酶类所致,如蛋白酶、几丁质酶、脂酶、酯酶和淀粉酶等胞外酶(Bidochka and Khachatourians, 1988; St Legeretal., 1989),这些酶分解寄主表皮蛋白质和几丁质,为虫生真菌生长提供营养物质,说明粘液层中的酶类在表皮营养的获取中发挥重要作用。扫描电镜图片亦显示,孢子萌发形成芽管,但未侵入表皮,而是芽管延长在虫体复眼、触角窝、足基节、腹生殖节等薄弱部位表面形成菌丝网络结构,这一侵染方式与文献报道(Ghaffarietal., 2017)一致。网络状的菌丝利用虫体表皮水解产物获取营养生长,致使寄主死亡变僵,覆盖在虫体上的菌丝体产生新的分生孢子(图3: G, H)。 而菌丝在虫体表面生长过程中是否产生有毒代谢物质诱发寄主死亡,仍有待进一步研究。
本研究结果均为在室内可控条件下获得,由毒力实验结果证实了长孢蜡蚧菌TF-2菌株对豌豆蚜成虫的高致病性,基本阐明了设置条件下侵染豌豆蚜成虫的形态学特征和表观过程,为新分离得到的昆虫病原真菌——长孢蜡蚧菌TF-2菌株的后续开发利用奠定了必要的理论基础。但是,在生产实际中,由于生防真菌的田间应用会受到温度和湿度等环境因素的干扰,使其利用受到一定限制。因此,还需深入剖析其致病机制,为进一步开发利用本菌种进行生物防治提供科学依据。
