家蚕微孢子虫海藻糖酶3的表达、定位及功能
2020-08-10张轶岭李俊昊宁嘉兴BismarkKYEI沈中元
张轶岭, 李俊昊, 宁嘉兴, Bismark KYEI, 沈中元
(江苏科技大学生物技术学院, 江苏镇江 212018)
微孢子虫(microsporidia)是一类专性细胞内寄生的单细胞真核生物(Becneletal., 2005; 刘吉平和曾玲, 2006),寄主范围非常广泛,可感染从无脊椎动物到脊椎动物的几乎所有动物类群(Mathis, 2000)。目前已经发现超过1 500种,归属187个属的微孢子虫(Vávra and Lukeš, 2013)。家蚕微孢子虫Nosemabombycis是Carl Naggli在1857年鉴定的第一种微孢子虫(Becneletal., 2005)。家蚕微孢子虫感染家蚕引起的蚕病在蚕业上称为家蚕微粒子病(pebrine),是对养蚕业最具威胁性的一种毁灭性的病害,常对蚕业生产造成严重的经济损失(Bhatetal., 2009)。
海藻糖为二糖类碳水化合物,广泛存在于各种生物包括细菌、真菌、昆虫、无脊椎动物以及低等和高等植物中(Elbein, 1974; Wingler, 2002; Elbeinetal., 2003; Frisonetal., 2007)。海藻糖首先是被作为能量储存分子提出的。在许多昆虫中,海藻糖提供了一种易于移动的能量储备,在飞行过程中被利用(Beckeretal., 1996)。另外,在真菌孢子中海藻糖作为能量储备,孢子发芽时伴有海藻糖的水解(Rousseauetal., 1972; Theveleinetal., 1982)。在分枝杆菌和棒状杆菌中,海藻糖作为许多细胞壁糖脂的结构组成部分发挥作用。在结核分枝杆菌Mycobacteriumtuberculosis中,细胞壁“脐带因子”6,6-二霉菌酸海藻糖(trehalose 6,6-dimycolate) 对药物和多肽都具有不渗透性。通过在这些分子周围形成类似玻璃的结构,它们可以防止脱水和氧化造成的损伤(Elbeinetal., 2003; Tournuetal., 2013)。海藻糖酶(trehalase)是一种糖苷酶,可催化一分子海藻糖水解为两分子葡萄糖。家蚕微孢子虫具有完整的海藻糖代谢和糖酵解途径。家蚕微孢子虫海藻糖酶(Nosemabombycistrehalase, NbTre)基因包括4个拷贝,即NbTre1,NbTre2,NbTre3和NbTre4(李孝良等, 2016)。目前对于家蚕微孢子虫海藻糖酶不同拷贝的功能仍不清楚。本研究对其中的NbTre3基因进行克隆并表达,通过免疫荧光、qRT-PCR及RNAi技术对NbTre3的功能进行了初步的分析,旨在为家蚕微孢子虫发芽的分子机制及能量代谢研究提供理论依据,为家蚕微粒子病的防治提供线索。
1 材料与方法
1.1 生物材料及试剂
家蚕Bombyxmori品系p50和家蚕微孢子虫由本实验室培养繁殖并保存;原核表达菌及分子克隆感受态细胞菌株BL21购自北京全式金生物技术有限公司;PCR、限制性核酸内切酶、RNA 提取试剂盒、反转录试剂盒、真菌基因组DNA提取试剂盒为TaKaRa 公司产品;Percoll 试剂为GE Healthcare 公司产品;qRT-PCR所用试剂购自TaKaRa公司;其他试剂配制所需药品均为分析纯。
1.2 家蚕微孢子虫的扩增与纯化
以108个孢子/mL的成熟家蚕微孢子虫悬液浸渍新鲜桑叶(党晓群等, 2014),晾干后喂给4龄起蚕,8 h后换以新鲜桑叶。待家蚕出现明显的微孢子虫感染症状时,收集病蚕,解剖取其丝腺,加入磷酸缓冲液(1×PBS)研磨至匀浆,4层纱布过滤,滤液经3 000 g离心5 min,弃上清,经1×PBS漂洗3次后用1×PBS重悬,缓慢加入到非连续密度梯度(30%, 45%, 60%, 75%和90%)的Percoll溶液液面上,12 000 g离心40 min,收集底部沉淀,用PBS漂洗3次,即得纯化的家蚕微孢子虫。
1.3 家蚕微孢子虫基因组 DNA的提取
向震荡管中加入1 mL(109个孢子/mL)纯化的微孢子虫悬液和1 mL酸洗玻璃珠,利用震荡式小型珠磨式组织研磨器进行研磨,震荡速度在4 800~5 500 r/min,共震荡6次,每次持续震荡时间为60 s,每次震荡结束立刻将其放入冰中进行冷却。研磨结束后,冰上静止5 min,待玻璃珠全部沉降至液面下时,将上清转移至新的离心管中。用真菌基因组DNA快速抽提试剂盒,按照说明书操作程序提取家蚕微孢子虫的基因组。
1.4 重组原核表达载体的构建
根据SilkPathDB(https:∥silkpathdb.swu.edu.cn/)已登录的NbTre3 (NBO-2g0093)的序列设计引物(正向引物: 5′-CGCGGATCCATTCCAGTGGATCT AAATGC-3′, 下划线示BamHⅠ酶切位点;反向引物: 5′-CCCAAGCTTTTTGACCAGTACTTCTTTGC-3′, 下划线示HindⅢ酶切位点),并以1.3节提取的家蚕微孢子虫基因组DNA为模板对NbTre3基因进行PCR扩增。反应体系(50 μL):基因组DNA模板1 μL, 正反向引物(10 μmol/L)各0.5 μL, Premix TaqTM(TaKaRa TaqTMVersion 2.0) 25 μL, ddH2O补至50 μL。反应条件: 94℃预变性2 min; 98℃变性10 s, 59℃退火30 s, 72℃延伸40 s, 共30个循环;最后72℃延伸10 min。扩增产物利用1%琼脂糖凝胶电泳进行鉴定。
鉴定正确的扩增产物经DNA纯化试剂盒回收后,用BamHⅠ和HindⅢ进行双酶切,酶切产物与经同样双酶切的原核表达载体pET28a(+)在T4 DNA连接酶的作用下进行连接反应,连接产物转化大肠杆菌EscherichiacoliTop 10感受态细胞,涂布含硫酸卡那霉素的LB固体培养基,37℃培养过夜;挑取单克隆菌落并接种于含硫酸卡那霉素的LB液体培养基中,37℃过夜培养,用质粒提取试剂盒提取重组质粒,通过PCR及BamHⅠ和HindⅢ对重组质粒进行双酶切鉴定。并将阳性质粒送至上生工生物工(上海)股份有限公司进行DNA测序。
1.5 重组蛋白NbTre3的纯化
将1.4节测序正确的重组质粒pET28a-NbTre3转化至大肠杆菌BL21感受态细胞中,同时设pET28a(+)载体质粒转化菌作为阴性对照,涂布于含适量硫酸卡那霉素的LB固体培养基上,37℃培养箱培养过夜;选择PCR鉴定阳性的菌落接种至LB液体培养基中,37℃摇床培养至其OD600为 0.6~0.8时,加入IPTG(终浓度为0.6 mmol/L),37℃摇床继续培养 6 h,离心收集细菌,用1×PBS洗3次;向样品中加入40~60 μL的蛋白上样缓冲液,100℃煮沸10 min,进行SDS-PAGE及Western blot(兔抗 6×His tag 作为一抗)鉴定;鉴定正确的菌体,冰上超声破碎(功率50 W,超声6 s,间隔6 s,次数50次),12 000 g 4℃离心10 min,将上清转移至新的离心管中,沉淀用少量的1×PBS重悬后加入40 mL 20 mmol/L Binding Buffer混匀,4℃孵育过夜,次日按照Ni柱蛋白纯化说明书对重组NbTre3进行纯化,并通过SDS-PAGE对纯化的蛋白进行鉴定。
1.6 NbTre3 多克隆抗体的制备
1.5节纯化的重组蛋白NbTre3经过不同尿素含量(6, 4, 2和0 mol/L)的透析液处理后,采用BCA法对其浓度进行测定。然后委托金斯瑞生物科技有限公司利用获得的NbTre3免疫新西兰兔,进行多克隆抗体的制备。通过ELISA及Western blot对制备的多克隆抗体的效价和特异性分别进行评估。
1.7 NbTre3的免疫荧光定位
纯化的家蚕微孢子虫用4%的多聚甲醛固定15 min;PBST浸洗玻片后用Triton X-100室温通透20 min,PBST浸洗玻片后在玻片上滴加正常山羊血清,室温封闭30 min;每张玻片滴加足够量(1∶200稀释)的重组NbTre3多克隆抗体,放入湿盒,4℃孵育过夜;PBST洗玻片,滴加1∶1 000 (v/v)稀释好的Alexa Fluor 488标记的荧光二抗(生工生物工程(上海)股份有限公司),湿盒中室温孵育1 h;PBST浸洗玻片,滴加DAPI避光孵育5 min,对标本进行染核,PBST洗去多余的DAPI;用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察并采集图像。
1.8 qRT-PCR检测家蚕微孢子虫感染后家蚕5龄起蚕中肠中NbTre3的表达水平
5龄起蚕喂以涂抹108个孢子/mL的家蚕微孢子虫悬液的新鲜桑叶2 h,分别在感染(喂食微孢子虫)2, 6, 12, 24, 48, 72, 96, 120和144 h剖取家蚕中肠组织;每时间点每6头家蚕为一组,每组为一个重复,共设4个重复。 液氮研磨,加入TRIzol试剂,按照试剂盒说明书提取中肠组织总RNA,DNaseⅠ室温消化15 min 去除基因组DNA,经反转录成cDNA为模板,以家蚕微孢子虫β-tubulin为内参基因,利用qRT-PCR检测NbTre3基因的转录水平,引物如表1所示。反应体系(20 μL): TB Green Premix Ex Taq II 10 μL, 上下游引物(10 μmol/L)各 0.8 μL, ROX Reference Dye 0.4 μL, cDNA 模板 2 μL, 灭菌水补至20 μL。每个样品设置4个重复孔。反应程序: 95℃预变性 30 s; 95℃变性15 s, 60℃退火及延伸 31 s, 反应共40个循环。

表1 qRT-PCR引物Table 1 Primers for qRT-PCR
1.9 NbTre3基因的RNAi实验
根据NbTre3基因的序列设计了3条特异性的siRNA(siRNA-1, siRNA-2和siRNA-3),设绿色荧光蛋白基因gfpsiRNA作为阴性对照(NC)(表2),委托生工生物工程(上海)有限公司进行合成。5龄起蚕喂以涂有108个孢子/mL的家蚕微孢子虫悬液的桑叶,感染6 h后皮下注射siRNA(1 μg/蚕),分别在注射后24, 48和72 h剖取中肠组织,每个时间点取6头家蚕,提取总RNA,并反转录为cDNA,以家蚕微孢子虫β-tubulin为内参基因,qRT-PCR检测NbTre3基因的转录水平;同时以家蚕actin3为内参基因,利用qRT-PCR检测家蚕微孢子虫16S rRNA的转录水平,引物序列见表2。反应体系: TB Green Premix Ex Taq II 10 μL, 上下游引物(10 μmol/L)各 0.8 μL, ROX Reference Dye 0.4 μL, cDNA 模板 2 μL, 灭菌水补至20 μL。反应程序: 95℃预变性 30 s; 95℃变性15 s, 60℃退火及延伸 31 s, 反应共40个循环。独立重复实验3次,每个样品重复测定4次。另外,在siRNA干扰NbTre3基因表达后120 h,每处理取10头家蚕5龄起蚕,剖取中肠组织研磨后在显微镜下观察微孢子虫的数量。

表2 siRNA序列Table 2 Sequences of siRNA
1.10 数据分析
qRT-PCR 结果数据根据2-ΔΔCt的方法进行计算分析(Livak and Schmittgen, 2001),并用IBM SPSS Statistics 20 软件进行比较均值单因素方差分析(ANOVA)。
2 结果
2.1 重组NbTre3蛋白在大肠杆菌中的表达
为了构建NbTre3的重组原核表达载体,首先通过PCR对NbTre3基因进行扩增,结果如图1(A)所示,获得了一条长约800 bp的特异性条带,与理论长度804 bp相符。然后,PCR产物经纯化和双酶切后连接pET28a(+)载体获得重组质粒,PCR及双酶切鉴定均获得一条大小为800 bp左右的特异性条带(图1: B, C),经DNA测序验证,结果表明重组原核表达载体pET28a-NbTre3构建成功。
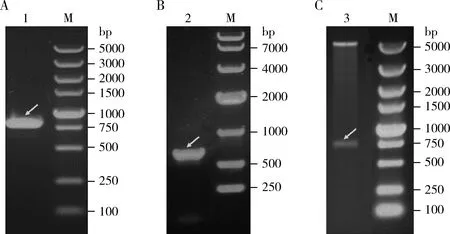
图1 原核表达载体pET28a-NbTre3的构建Fig. 1 Identification of the prokaryotic expression vector pET28a-NbTre3A: 从家蚕微孢子虫基因组中PCR扩增 NbTre3基因NbTre3 gene amplified from Nosema bombycis genome by PCR; B: pET28a-NbTre3的PCR鉴定PCR identification of pET28a-NbTre3; C: pET28a-NbTre3的酶切鉴定Digestion identification of pET28a-NbTre3; 1: NbTre3的PCR产物PCR product of NbTre3; 2: pET28a-NbTre3的PCR产物PCR product of pET28a-NbTre3; 3: pET28a-NbTre3酶切结果Restriction digestion result of pET28a-NbTre3; M: DNA分子量标准DNA molecular weight marker. 箭头指示目的基因NbTre3。Arrows show the target gene NbTre3.
将上述重组载体pET28a-NbTre3转化BL21感受态细胞,经IPTG诱导表达后,收集表达细菌,利用SDS-PAGE(图2: A)及Western blot(图2: B)检测均发现一条特异性的蛋白条带,其分子量大小约为34 kD,与NbTre3蛋白理论分子量大小接近,结果表明重组蛋白NbTre3得以成功表达。
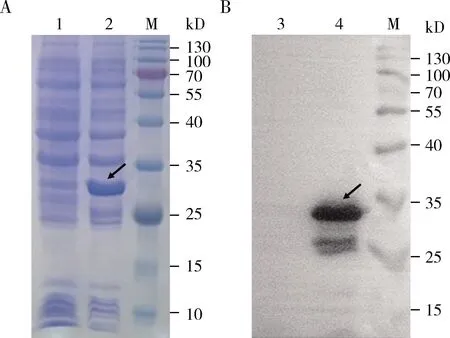
图2 重组蛋白NbTre3的SDS-PAGE(A) 及Western blot(B)鉴定Fig. 2 Identification of the recombinant protein NbTre3 by using SDS-PAGE (A) and Western blot (B) 1, 3: 转化pET28a(+)的菌液蛋白pET28a(+) transformed bacteria solution protein; 2, 4: 转化pET28a-NbTre3的菌液蛋白pET28a-NbTre3 transformed bacteria solution protein; M: 蛋白质分子量标准Protein molecular weight marker. 箭头指示目的蛋白rNbTre3。Arrows show the target protein rNbTre3.
2.2 重组蛋白 NbTre3多克隆抗体
SDS-PAGE鉴定结果如图3所示,在用尿素含量分别为150 mmol/L和200 mmol/L的洗脱液进行洗脱时,均可获得较纯的NbTre3蛋白;然后,进行透析以除去尿素等成分,通过SDS-PAGE再次检测蛋白的纯度,结果发现仍只有一条特异性蛋白条带(图4: A)。说明透析过程中没有蛋白的降解和杂蛋白的掺入。以纯化的重组蛋白NbTre3为抗原免疫新西兰兔制备抗体,Western blot检测结果如图4(B)所示,发现一条分子量大小约为34 kD的特异性条带,说明制备的多克隆抗体特异性较好,可用于后续实验。

图3 SDS-PAGE检测纯化的重组蛋白NbTre3Fig. 3 SDS-PAGE analysis of the purified recombinant protein NbTre3 M: 蛋白质分子量标准Protein molecular weight marker; 1-7: 分别为binding buffer, binding buffer以及20, 50, 100, 150和200 mmol/L不同尿素含量的蛋白洗脱液Protein elute with binding buffer, binding buffer, and 20, 50, 100, 150 and 200 mmol/L urea, respectively. 箭头指示目的蛋白。Arrows show the target protein.
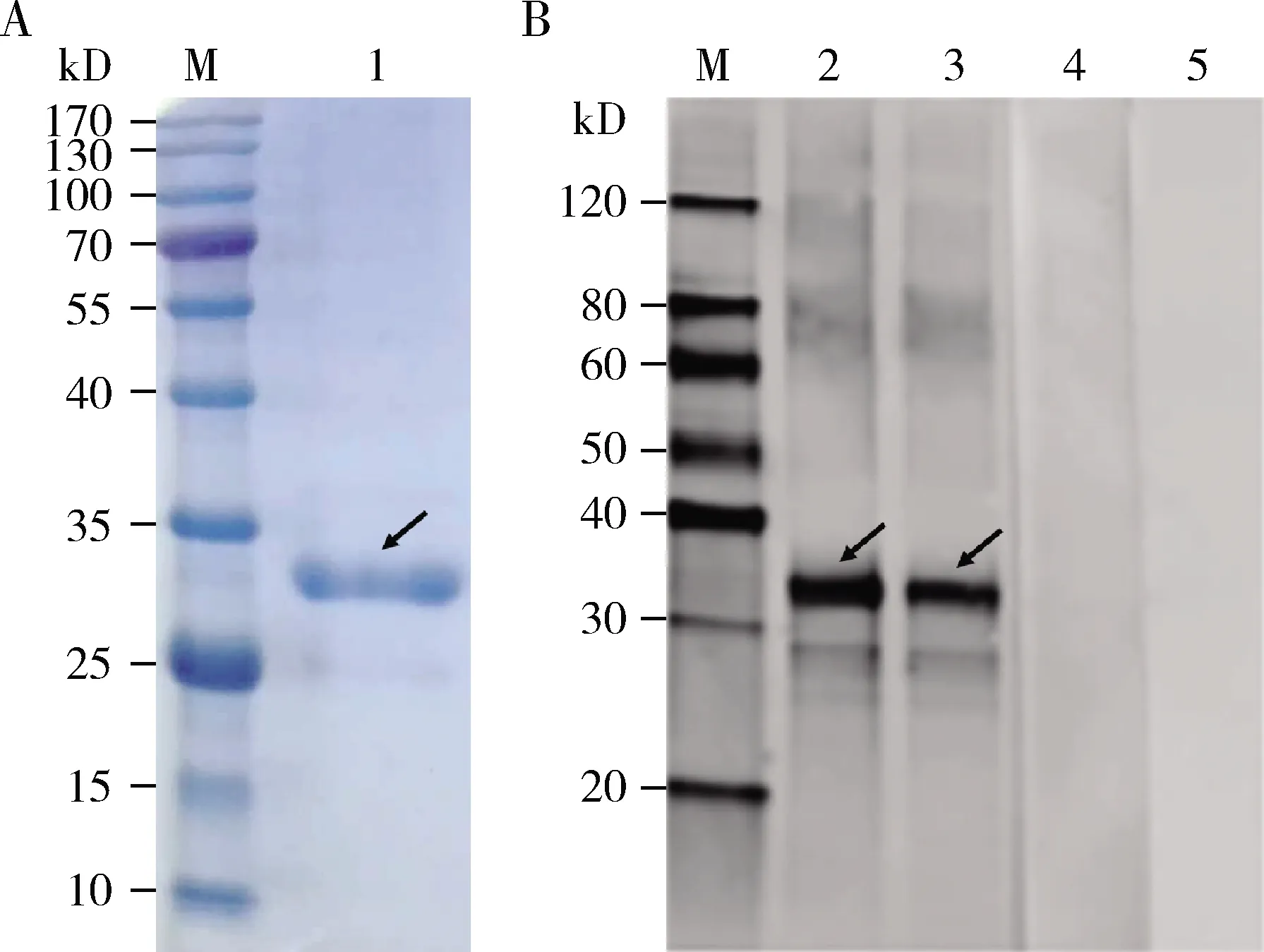
图4 透析除盐后的重组蛋白NbTre3的SDS-PAGE 分析(A)及其多克隆抗体的Western blot鉴定(B)Fig. 4 Identification of the desalinated recombinant protein NbTre3 by SDS-PAGE (A) and its polyclonal antibody by Western blotting (B) M: 蛋白质分子量标准 Protein molecular weight marker; 1: 透析除盐后的重组蛋白NbTre3 Desalinated recombinant protein NbTre3; 2, 3: NbTre3多克隆抗体Polyclonal antibody of NbTre3; 4: 免疫前血清Pre-immuned serum; 5: PBS. 箭头指示目的蛋白。Arrows show the target protein.
2.3 NbTre3在家蚕微孢子虫成熟孢子中的亚细胞定位
利用制备的抗NbTre3的多克隆抗体为一抗,Alexa Fluor 488标记的荧光二抗,通过间接免疫荧光对家蚕微孢子虫成熟孢子中NbTre3的分布进行了检测。结果如图5所示,NbTre3主要分布在孢原质中。
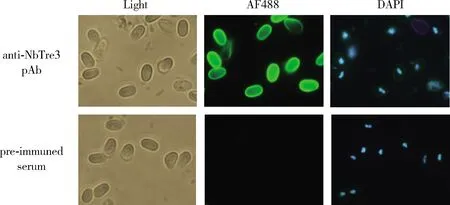
图5 间接免疫荧光检测NbTre3在家蚕微孢子虫成熟孢子中的定位Fig. 5 Localization of NbTre3 in mature spore of Nosema bombycis detected by indirect immunofluorescence assay Light: 明视野 Bright field; AF488: 显示绿色荧光抗体标记的目的蛋白分布 Showing the distribution of the target protein labeled with green fluorescent antibody; DAPI: 显示被DAP荧光I染料标记的核 Showing the nuclei labeled with DAPI fluorescent dye. 孢子经固定和透化后和NbTre3多克隆抗体(anti-NbTre3 pAb)或免疫前血清(pre-immuned serum)进行孵育,然后孢子被洗过后和AF488标记羊抗兔二抗进行孵育,最后核酸用DAPI进行标记。After fixation and permeabilization, the spores were incubated either with anti-NbTre3 pAb or pre-immuned serum. And then the spores were washed and incubated with secondary antibody AF488 labeled goat anti-rabbit IgG (H+L) antibody. Finally, the DAPI was used to label the nuclei of spores.
2.4 微孢子虫感染后不同时间NbTre3在家蚕中肠细胞中的表达谱
为了探索NbTre3在微孢子虫不同发育时期所发挥的作用,qRT-PCR检测NbTre3在家蚕5龄起蚕被微孢子虫后不同时间点中肠组织中的相对表达水平,结果如图6所示,NbTre3 在感染6 h的相对表达量最高,其余时间均保持在较低的水平。

图6 qRT-PCR检测家蚕微孢子虫感染后不同时间NbTre3在家蚕5龄起蚕中肠中的表达谱Fig. 6 Expression profiles of NbTre3 in the midgut of the 5th instar larvae of Bombyx mori at different time post infection of Nosema bombycis detected by qRT-PCR 柱上不同小写字母分别代表不同感染时间点家蚕中肠中NbTre3基因表达量的差异显著性(n=4)(P<0.05, ANOVA)。Different lowercase letters above bars represent the significant differences (n=4) in the NbTre3 gene expression level in the midgut of silkworm at different infection time points (P<0.05, ANOVA).
2.5 RNAi下调NbTre3基因的表达
与对照组(NC)相比,siRNA-2对NbTre3 基因表达的抑制效果最明显(图7: A);然而,NbTre3表达被抑制的同时,家蚕微孢子虫16S rRNA的转录水平并没有明显的变化(图7: B),此外,在siRNA干扰NbTre3基因表达后120 h我们剖取中肠组织研磨后在显微镜下观察,发现实验组和对照组微孢子虫的数量无明显差异(数据未显示),表明干扰NbTre3基因的表达对于家蚕微孢子虫的复制并没有明显的抑制作用。

图7 RNAi后家蚕5龄起蚕中肠中NbTre3(A)及16S rRNA(B)转录水平Fig. 7 Transcription levels of NbTre3 (A) and 16S rRNA (B) in the midgut of the 5th instar larvae of Bombyx mori after RNA interference NC: gfp siRNA; siRNA-1-3: NbTre3 siRNAs. 图中数据为平均值±标准误。Data in theFigure are mean±SE.
3 讨论
微孢子虫的生活史可分为3个阶段,即感染期、裂殖增殖期和孢子形成期(Vávra, 1976)。感染期即孢子发芽期,家蚕食下被微孢子虫污染的桑叶后,孢子在消化道内被活化,孢内渗透压增大,大量水分子进入细胞,随后极质体和后极泡吸水膨胀压迫极丝快速外翻弹出刺入寄主细胞,同时孢原质在极丝弹出前被吸入极丝内,最后具有感染性的孢原质通过中空的极丝注入寄主细胞(Wingler, 2002),即完成孢子发芽过程。关于孢子发芽的分子机制有两种假说,一种假设认为孢子壁上存在特殊的跨膜水通道,水通道蛋白可以特异性地使水分子快速通过孢子壁,使孢内压力增大,引发孢子发芽(Frixioneetal., 1992, 1997; Ghoshetal., 2006)。另一种假设认为,在微孢子虫发芽过程中伴随有孢内海藻糖含量降低而葡萄糖含量升高的现象,孢内海藻糖降解为葡萄糖是引起孢内压力增大的重要原因(Vandermeer and Gochnauer, 1971; Undeen,1990)。也有研究分析表明,细胞内Ca2+浓度的变化是水流入的一个原因(Huangetal., 2018)。外界刺激因素改变孢壁通透性后,使孢内膜结构上起骨架支撑作用的Ca2+与外界离子竞争结合位点并被置换下来,引起孢膜结构改变,由于间隔膜被打破,海藻糖与海藻糖酶相互接触,大量降解为葡萄糖,孢内渗透压升高,促使水分进入孢内。
本研究通过原核表达及蛋白纯化,制备了抗rNbTre3的多克隆抗体,Western blot检测结果正确(图4: B),在小于30 kD大小处有不太明显的非特异性条带出现,分析原因可能是由于抗原蛋白降解或断裂造成的。间接免疫荧光结果显示,在家蚕微孢子虫成熟孢子中,NbTre3主要分布在孢原质中(图5)。NbTre3基因表达谱分析结果表明,NbTre3在家蚕微孢子虫感染家蚕初期(6 h)相对表达水平最高(图6),推测NbTre3在家蚕微孢子虫发芽过程中发挥重要的作用(Vandermeer and Gochnauer, 1971; Undeen, 1990)。利用RNAi技术对NbTre3的表达达到了显著的抑制效果,但微孢子虫16S rRNA的转录水平并没有受到明显的抑制(图7),进一步表明NbTre3在家蚕微孢子虫侵染初期的发芽过程中发挥重要作用。
孢原质进入寄主细胞后,以二分裂或多分裂的方式发育成裂殖体,裂殖体增殖到一定阶段细胞膜变厚,形成母孢子,母孢子以二分裂的方式形成孢子母细胞,再由孢子母细胞发育成成熟孢子。微孢子虫的感染以及快速增殖是依赖于ATP的能量密集型的过程。但这些能量来源于哪里,是怎么产生的,目前尚未完全明确。Huang等(2018)利用RNAi技术下调分泌型家蚕微孢子虫己糖激酶(Nosemabombycishexokinase, NbHK)的表达,可以有效抑制家蚕微孢子虫的增殖,表达谱分析结果显示分泌型NbHK可能在家蚕微孢子虫的增殖期发挥重要作用。本研究通过qRT-PCR对微孢子虫感染不同时间的家蚕5龄起蚕中肠组织中NbTre3基因的转录水平进行分析,发现NbTre3仅在感染初期高表达(图6),在裂殖增殖期和孢子形成期相对表达量均不高,RNAi对16S rRNA的转录活性没有显著影响(图7),表明NbTre3主要与孢子发芽和侵染有关。对于其他3个拷贝的海藻糖酶NbTre1, NbTre2和NbTre4在家蚕微孢子虫的发芽或增殖期的能量供应是否发挥作用还有待于进一步的研究。
