蜂王上颚腺信息素对雄蜂候选性信息素受体基因表达的影响
2020-08-10刘俊峰王子龙何旭江曾志将
刘俊峰, 李 茫, 王子龙, 何旭江, 曾志将,*
(1. 江西农业大学蜜蜂研究所, 南昌 330045; 2. 中国热带农业科学院环境与植物保护研究所, 海口 571101)
蜜蜂是研究行为的良好模式生物,其具有丰富的行为特征和可塑性。自从2006年蜜蜂基因组成功测序后(Honey Bee Genome Sequencing Consortium, 2006),蜜蜂就被作为连接基因与复杂行为的动物模型。蜜蜂交尾行为是其复杂行为之一。雄蜂唯一的生物学职责是与处女蜂王交配(曾志将, 2017)。在空中追逐处女蜂王的飞行雄蜂与正常有王蜂群内的爬行雄蜂同样受到蜂王上颚腺信息素(queen mandibular pheromone, QMP)影响,但是它们的行为表现不同。在户外飞行的性成熟雄蜂能被处女蜂王或QMP混合物所吸引(Loperetal., 1993; Brockmannetal., 2006),而在蜂群内的性成熟雄蜂却回避处女蜂王(Ohtani and Fukuda, 1977; Graham, 2015)。目前,雄蜂识别QMP的生理调控机理尚不清晰。
雄蜂拥有高度特化和极其灵敏的嗅觉识别系统。雄蜂触角的主要嗅觉感器——板形感器约有18 000个,数量约是工蜂的7倍(Sandozetal., 2007)。嗅觉板形感器中识别气味的功能性外周蛋白主要由气味结合蛋白(odorant binding proteins, OBPs)、气味降解酶(odorant degrading enzymes, ODEs)、感觉神经元膜蛋白(sensory neuron membrane proteins, SNMPs)和气味受体(odorant receptors, ORs)等组成(Vosshalletal., 1999; Hallemetal., 2004)。其中,ORs以数量多、特异性强的特征受到了学者们广泛的关注与研究(Forêt and Maleszka, 2006; Robertson and Wanner, 2006; Li Zetal., 2012; Li Hetal., 2013; 赵慧婷等, 2015; 张中印等, 2016; 杜亚丽等, 2017; 杨乐等, 2017, 2018)。从东方蜜蜂Apiscerana和西方蜜蜂Apismellifera中已鉴定出的ORs分别为119和170个(Robertson and Wanner, 2006; Parketal., 2015),远远超过黑腹果蝇Drosophilamelanogaster的62个ORs (Clyneetal., 1999; Vosshalletal., 1999)、冈比亚按蚊Anophelesgambiae的79个ORs(Hilletal., 2002)及家蚕Bombyxmori的48个ORs(Wanneretal., 2007a),这也表明蜜蜂的嗅觉更为发达。Wanner等(2007b)研究发现候选性信息素受体(sex pheromone receptors, PRs)基因Or10,Or11,Or18和Or170在西方蜜蜂雄蜂触角中高度表达,并证实Or11为反式-9-氧代-2-癸烯酸[(E)-9-oxodec-2-enoic acid, 9-ODA]的专一性受体。但蜜蜂ORs分别发挥何种机能的研究鲜有报道。Liu等(2019)利用RT-PCR技术对东方蜜蜂AcOr11基因克隆基础上,使用qRT-PCR技术鉴定其在飞行回巢与蜂箱内爬行状态下的表达特性,提示了雄蜂大脑中Or11基因表达可能与婚飞行为有关。虽然目前Or10,Or18和Or170基因暂未鉴定出其功能,但我们推测这3个气味受体基因与性信息素受体基因Or11功能相似,并且可能在雄蜂识别QMP与婚飞过程中发挥作用。因此,以中华蜜蜂A.c.cerana(简称“中蜂”)和意大利蜜蜂A.m.ligustica(简称“意蜂”)性成熟的飞行与爬行雄蜂为研究材料,通过qRT-PCR技术检测分析QMP与9-ODA对中蜂、意蜂雄蜂候选性信息素受体基因Or10,Or11,Or18和Or170的mRNA表达量的影响,以探索雄蜂对QMP的生理调控机制,从而为揭示雄蜂婚飞行为提供理论依据。
1 材料与方法
1.1 供试蜜蜂
试验蜂群是由江西农业大学蜜蜂研究所按活框饲养技术进行饲养的中华蜜蜂、意大利蜜蜂。试验选取蜂群遗传性状、群势基本相近的4群中蜂和4群意蜂。试验时间为2019年6-8月。
培育适龄性成熟雄蜂:将4张中蜂、意蜂空雄蜂巢脾各插入4群中蜂、意蜂蜂群内,控制蜂王产卵24 h后继续留置原群培育孵化,待雄蜂出房前24 h置于恒温恒湿培养箱至羽化出房,使用4种不同颜色水性记号笔分别标记4蜂群各300头雄蜂,并放回原蜂群发育成熟。
收集适龄性成熟雄蜂:为了符合雄蜂生物学习性,行为学试验时间选在天气晴朗下午13∶00-16∶00时雄蜂飞行高峰期间,收集性成熟雄蜂(14 d)。使用50 mL离心管分别在蜂箱巢门口抓取已标记颜色、飞行回巢的性成熟雄蜂(简称“飞行雄蜂”),以及在蜂箱内壁上抓取已标记颜色、巢内爬行的性成熟雄蜂(简称“爬行雄蜂”)。
1.2 主要仪器与试剂
主要试剂: 9-ODA, 9-HDA, HOB(Contech, 加拿大);TransZol up试剂盒、GelStain 荧光核酸染色试剂和6×DNA Loading Buffer(北京全式金公司);无水乙醇、异丙醇和氯仿(西陇化工,分析纯);UltraPureTM琼脂糖、TBE Buffer及DNase/RNase-Free Distilled Water (Invitrogen); PrimeScript RT Reagent Kit反转录试剂盒、DNA Marker DL2000和荧光定量试剂盒TB GreenTMPremix Ex TaqTM(TaKaRa)。
1.3 信息素刺激雄蜂
本试验使用信息素QMP与9-ODA分别刺激中蜂和意蜂性成熟雄蜂。将收集待测1.1节中的中蜂和意蜂性成熟雄蜂置于测试室适应环境5 min左右。测试室环境为红光暗室,行为学测试时间:13∶00-16∶00时,测试室内温度25±1℃,相对湿度75%±5%。测试信息素QMP[9-ODA(7.04 μg/μL)+9-羟基-2-癸烯酸(9-hydroxydec-2-enoic acid, 9-HDA)(1.26 μg/μL)+对羟基苯甲酸甲酯(methylp-hydroxybenzoate, HOB, 0.03 μg/μL)]和9-ODA(7.04 μg/μL)气流由Y型嗅觉仪(基管长30 cm,两臂长35 cm,内径5 cm,两臂夹角75°, 南昌大学玻璃仪器厂)样品瓶流向雄蜂释放管一端,雄蜂由飞行通道逆风飞入样品瓶。在气流进入样品瓶之前,由空气泵推动空气先经过活性碳过滤和蒸馏水加湿,空气泵流速为300 mL/min。测试信息素QMP与9-ODA成分含量参考Plettner等(1997),即每头性成熟西方蜜蜂处女蜂王含约70.4 μg 9-ODA, 12.6 μg 9-HDA, 0.3 μg HOB。
处理组在Y型嗅觉仪左右2个测试室中均放入滴有5 μL信息素乙醇溶液的滤纸;空白对照组在Y型嗅觉仪左右2个测试室中均放入滴有5 μL乙醇溶液的滤纸。每次试验仅测试1头中蜂雄蜂或意蜂雄蜂,将离心管置于Y型管基臂端释放雄蜂,信息素刺激5 min后抓取雄蜂装入EP管,迅速放入液氮中速冻,转至-80℃冰箱保存,用于提取RNA。测定时每处理分4组,每组8头重复。测试完一组试验后清洗Y型管,先使用蒸馏水清洗,然后75%酒精擦拭,再使用蒸馏水冲洗,最后用电吹风吹干后进行下一组试验。
1.4 RNA提取与cDNA合成
将1.3节处理的雄蜂从液氮中取出,使用干净镊子及刀片剥离头部1对完整触角,装入1.5 mL RNase-free EP管,每组各收集8头雄蜂的8对触角为1个待测样品,迅速放入液氮中速冻,再转至-80℃冰箱保存,用于提取RNA。
将剥离触角后剩余的雄蜂头部放于置于磷酸缓冲盐溶液(phosphate buffer saline, PBS)(含137 mmol/L NaCl, 2.7 mmol/L KCl, 10 mmol/L Na2HPO4, 2 mmol/L KH2PO4, pH 7.4)中。使用干净镊子及刀片去除头部外壳和复眼组织,迅速装入1.5 mL RNase-free EP管,放入液氮中速冻,每组各收集8头雄蜂的8对脑部组织为1个待测样品,再转至-80℃冰箱保存,用于提取RNA。
将采集得到的触角及脑部待测样品,分别按照TransZol up试剂盒的操作说明提取RNA,并用分光光度计测量、琼脂糖凝胶电泳检测每个样品的RNA浓度及质量。每个RNA样品取1 μg按照反转录试剂盒说明进行反转录,将反转录的cDNA放置-20℃冰箱保存,用于qRT-PCR检测。
1.5 qRT-PCR检测基因表达
根据NCBI数据库中查询及比对出中蜂气味受体基因AcOr10(GenBank登录号: MF693365),AcOr11(GenBank登录号: MG793195),AcOr18(中蜂转录组中比对AmOr18序列),AcOr170(GenBank登录号: KX264359)和意蜂气味受体基因AmOr10 (GenBank登录号: NM_001242961.1),AmOr11 (GenBank登录号: NM_001242962.1),AmOr18 (GenBank登录号: XM_003250678.2),AmOr170 (GenBank登录号: NM_001242993.1)。分别以Ac-β-actin(GenBank登录号: HM_640276.1)和Am-β-actin(GenBank登录号: NM_001185146.1)作为中蜂、意蜂气味受体基因表达量检测的内参基因,使用Primer Premier 5.0软件设计qRT-PCR引物序列(引物由上海生工公司合成),引物序列如表1所示。

表1 qRT-PCR引物Table 1 Primers for qRT-PCR
1.6 数据分析
采用2-ΔΔCt方法统计中蜂、意蜂各基因的相对表达量,使用SPSS 17.0 软件中one-way ANOVA与t检验方法比较分析,P<0.05表示差异显著。通过GraphPad Prism 5.2软件进行作图。
2 结果
2.1 蜂王上颚腺信息素对中蜂雄蜂触角中气味受体基因mRNA表达量的影响
结果表明,QMP和9-ODA处理组的飞行(图1: A)与爬行(图1: B)中蜂雄蜂触角中4个气味受体基因的mRNA表达量均显著低于对照组的(P<0.05);9-ODA处理组中飞行中蜂雄蜂触角中AcOr18和AcOr170的mRNA表达量显著低于QMP处理组中的(P<0.05, 图1: A);9-ODA处理组爬行中蜂雄蜂触角中AcOr11与AcOr170的mRNA表达量显著低于QMP处理组的(P<0.05, 图1: B)。

图1 QMP和9-ODA处理后飞行(A)和爬行(B)中蜂雄蜂触角中AcOrs的表达量Fig. 1 Epression levels of AcOrs in the antennae of flying (A) and crawling (B) drones of Apis cerana cerana exposed to QMP and 9-ODA Blank: 空白对照(乙醇)Blank control (ethanol); QMP: 蜂王上颚腺信息素,1处女蜂王QMP当量包括反式-9-氧代-2-癸烯酸(9-ODA, 70.4 μg)+9-羟基-2-癸烯酸(9-HDA, 12.6 μg)+对羟基苯甲酸甲酯(HOB, 0.3 μg) An equivalent of virgin queen mandibular pheromone including (E)-9-oxodec-2-enoic acid (9-ODA, 70.4 μg)+9-hydroxydec-2-enoic acid (9-HDA, 12.6 μg)+methylp-hydroxybenzoate (HOB, 0.3 μg). 下图同The same for the followingFigures. 图中数据为平均值±标准误;柱上星号表示组间基因表达量差异显著(P<0.05, one-way ANOVA); 图3, 5和7同。Data in theFigure are mean±SE. Asterisk above bars indicates significant difference in the gene expression level between groups (P<0.05, one-way ANOVA). The same forFigs. 3, 5 and 7.
由图2结果可知,在QMP或9-ODA处理下,爬行中蜂雄蜂触角中4个AcOrs基因的表达量均与飞行中蜂雄蜂触角中的没有显著差异(P>0.05)。
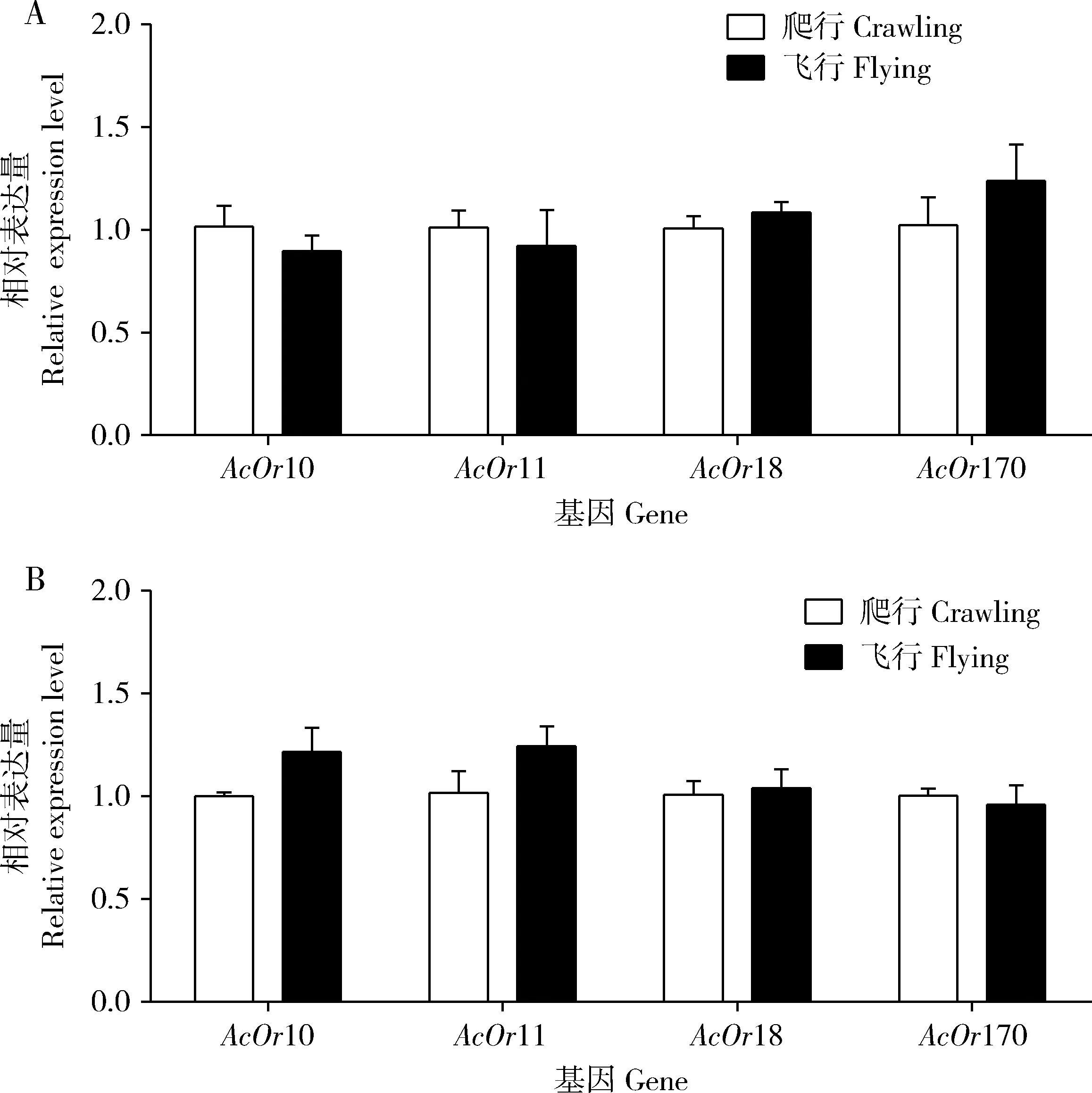
图2 QMP (A)和9-ODA (B)对飞行与爬行中蜂雄蜂触角中AcOrs表达量的影响Fig. 2 Effects of QMP (A) and 9-ODA (B) on the expression levels of AcOrs in the antennae of flying and crawling drones of Apis cerana cerana 图中数据为平均值±标准误;柱上星号表示组间基因表达量差异显著(P<0.05, t检验);图4, 6和8同。Data in theFigure are mean±SE. Asterisk above bars indicates significant difference in the gene expression level between groups (P<0.05, t-test). The same forFigs. 4, 6 and 8.
2.2 蜂王上颚腺信息素对中蜂雄蜂大脑中气味受体基因mRNA表达量的影响
结果表明,QMP和9-ODA处理组的飞行中蜂雄蜂大脑中AcOr11,AcOr18和AcOr170基因的表达量均显著低于对照组的(P<0.05, 图3: A);9-ODA处理组飞行中蜂雄蜂大脑中AcOr170的表达量显著低于QMP处理组大脑中的(P<0.05, 图3: A);而QMP和9-ODA处理组均与对照组飞行中蜂雄蜂大脑中的AcOr10基因表达量没有显著差异(P>0.05, 图3: A)。
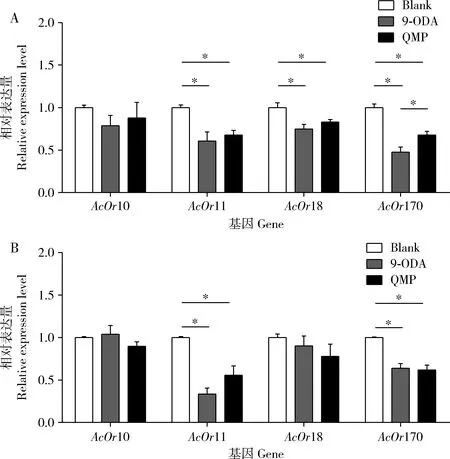
图3 QMP和9-ODA处理后飞行(A)和爬行(B)中蜂雄蜂大脑中AcOrs的表达量Fig. 3 Expression levels of AcOrs in the brains of flying (A) and crawling (B) drones of Apis cerana cerana exposed to QMP and 9-ODA
由图3(B)结果可知,QMP和9-ODA处理组爬行中蜂雄蜂大脑中AcOr11和AcOr170基因的表达量均显著低于对照组的(P<0.05);QMP与9-ODA处理组中蜂雄蜂大脑中AcOr11和AcOr170的表达量没有显著差异(P>0.05);而QMP和9-ODA处理组与对照组的爬行中蜂雄蜂大脑中AcOr10及AcOr18基因表达量相比差异不显著(P>0.05)。
由图4可知,在QMP处理下,爬行中蜂雄蜂大脑中AcOr11和AcOr170基因的表达量均显著低于飞行中蜂雄蜂大脑中的(P<0.05, 图4: A),而爬行与飞行中蜂雄蜂大脑中AcOr10和AcOr18基因的表达量没有显著差异(P>0.05, 图4: A);在9-ODA处理下,爬行中蜂雄蜂大脑中AcOr11基因的表达量均显著低于飞行中蜂雄蜂大脑中的(P<0.05, 图4: B),爬行中蜂雄蜂大脑中AcOr18基因的表达量均显著高于飞行中蜂雄蜂大脑中的(P<0.05, 图4: B),而爬行与飞行中蜂雄蜂大脑中AcOr10和AcOr170基因的表达量没有显著差异(P>0.05, 图4: B)。
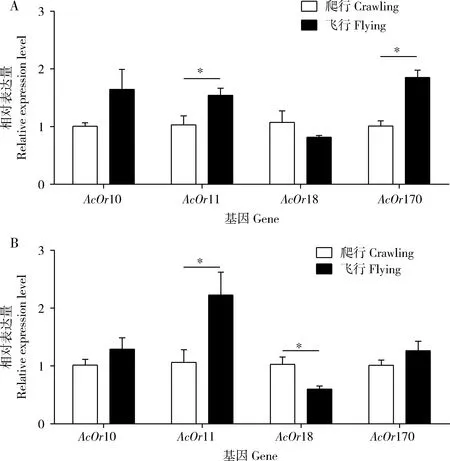
图4 QMP (A)和9-ODA (B)对飞行与爬行中蜂雄蜂大脑中AcOrs表达量的影响Fig. 4 Effects of QMP (A) and 9-ODA (B) on the expression levels of AcOrs in the brains of flying and crawling drones of Apis cerana cerana
2.3 蜂王上颚腺信息素对意蜂雄蜂触角中气味受体基因mRNA表达量的影响
结果表明,QMP和9-ODA处理组飞行(图5: A)与爬行(图5: B)意蜂雄蜂触角中AmOr10和AmOr11基因的表达量均显著低于对照组的(P<0.05);而处理组与对照组相比,其飞行(图5: A)与爬行(图5: B)意蜂雄蜂触角中AmOr18及AmOr170基因表达量均没有显著差异(P>0.05)。
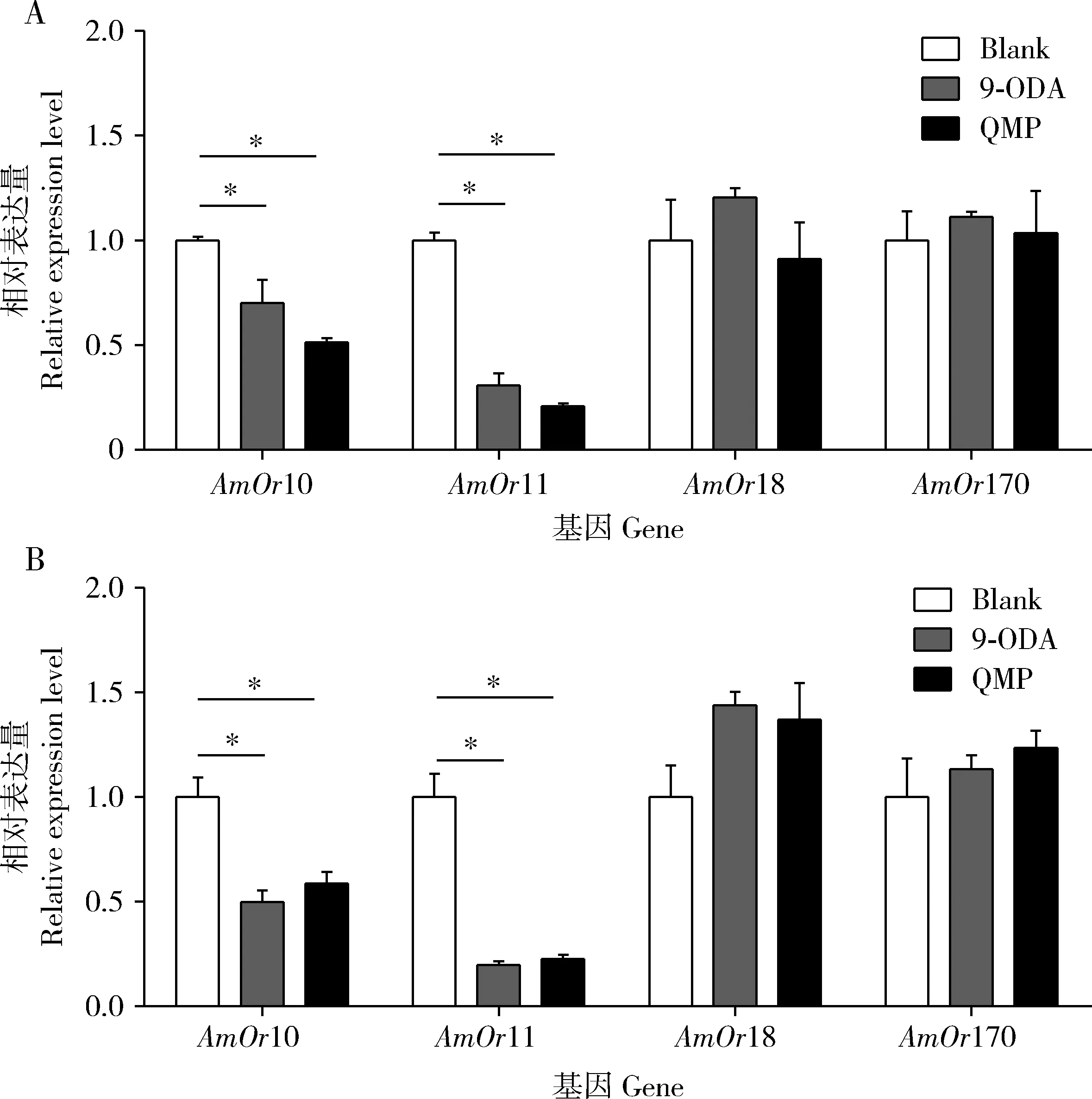
图5 QMP和9-ODA处理后飞行(A)和爬行(B)意蜂雄蜂触角中AmOrs的表达量Fig. 5 Expression levels of AmOrs in the antennae of flying (A) and crawling (B) drones of Apis mellifera ligustica exposed to QMP and 9-ODA
由图6可知,在QMP或9-ODA处理下,爬行意蜂雄蜂触角中AmOr170基因的表达量均显著高于飞行意蜂雄蜂触角中的(P<0.05),而爬行与飞行意蜂雄蜂触角中AmOr10,AmOr11和AmOr18基因的表达量没有显著差异(P>0.05)。
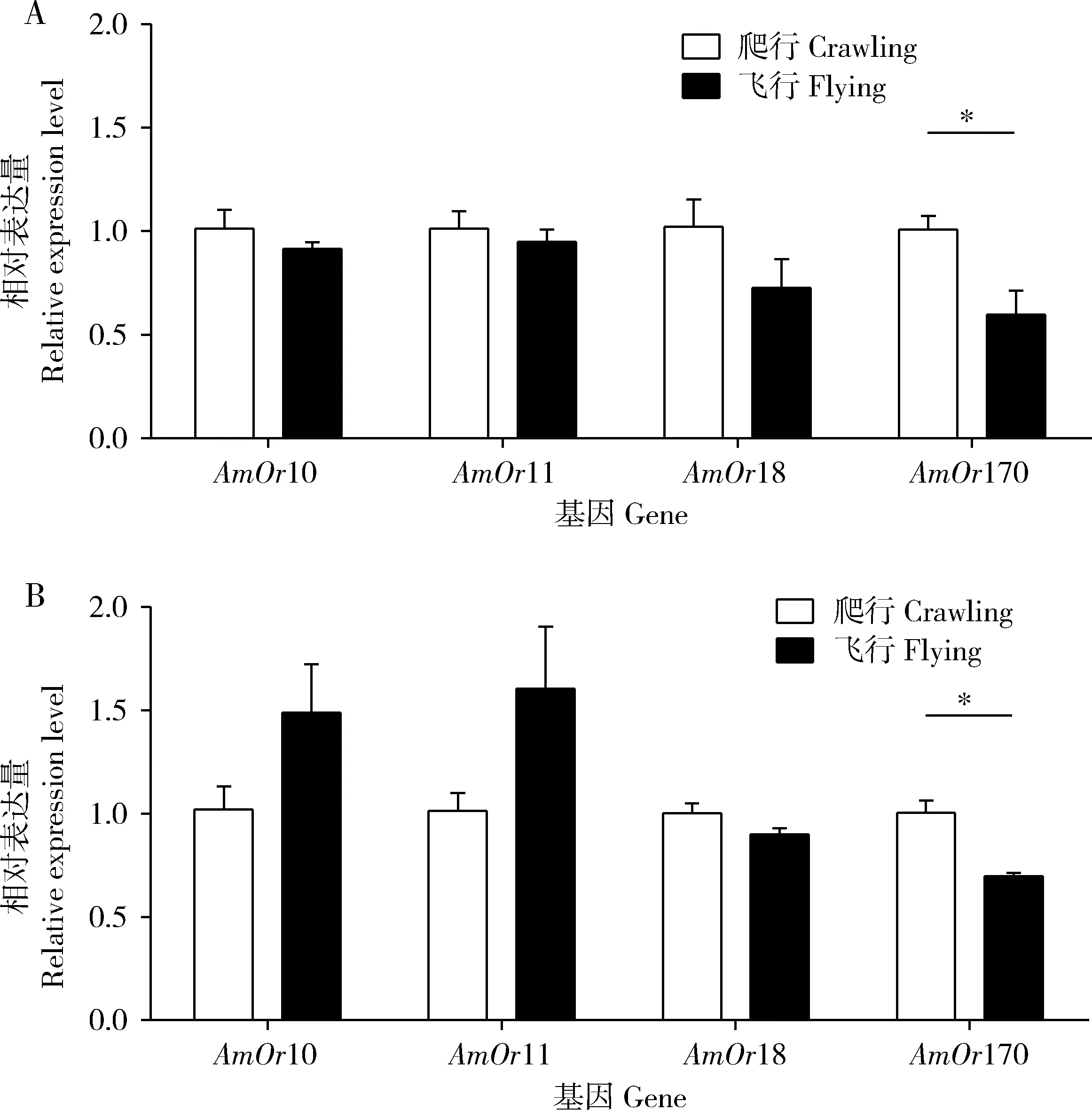
图6 QMP (A)和9-ODA (B)对飞行与爬行意蜂雄蜂触角中AmOrs表达量的影响Fig. 6 Effects of QMP (A) and 9-ODA (B) on the expression levels of AmOrs in the antennae of flying and crawling drones of Apis mellifera ligustica
2.4 蜂王上颚腺信息素对意蜂雄蜂大脑中气味受体基因mRNA表达量的影响
由图7(A)可知,QMP与9-ODA处理组飞行意蜂雄蜂大脑中AmOr11,AmOr18及AmOr170基因的表达量均显著低于对照组的(P<0.05),而处理组与对照组相比,其飞行意蜂雄蜂大脑中AmOr10基因的表达量没有显著差异(P>0.05);QMP处理组意蜂雄蜂大脑中AmOr18的表达量显著低于9-ODA处理组意蜂雄蜂大脑中的(P<0.05)。由图7(B)可知,QMP与9-ODA处理组爬行意蜂雄蜂大脑中AmOr11及AmOr170基因的表达量均显著低于对照组雄蜂大脑中的(P<0.05),而处理组与对照组相比,其爬行意蜂雄蜂大脑中AmOr10和AmOr18基因的表达量没有显著差异(P>0.05)。
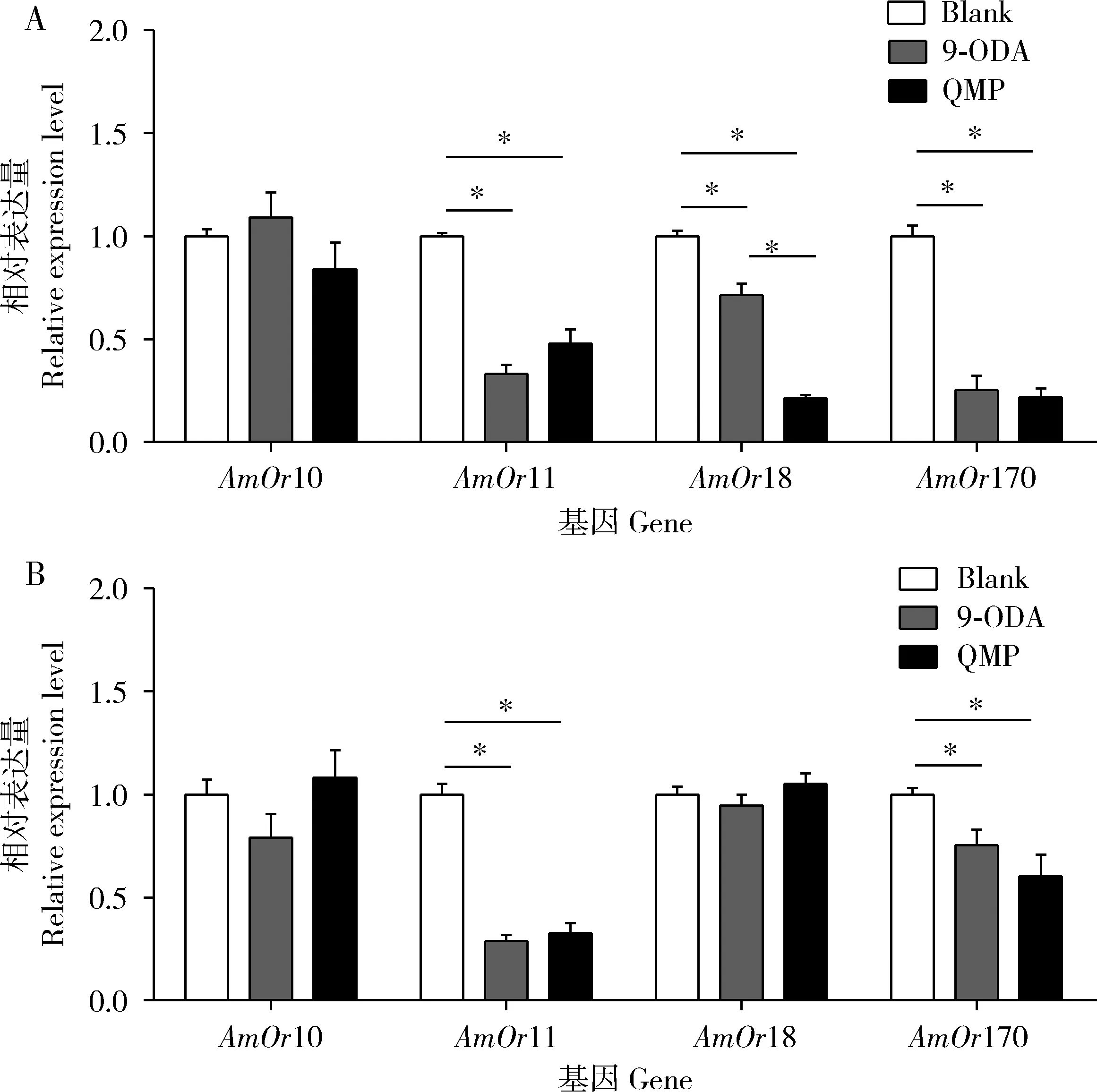
图7 QMP和9-ODA处理后飞行(A)和爬行(B)意蜂雄蜂大脑中AmOrs的表达量Fig. 7 Expression levels of AmOrs in the brains of flying (A) and crawling (B) drones of Apis mellifera ligustica exposed to QMP and 9-ODA
由图8可知,在QMP处理下,爬行意蜂雄蜂大脑中AmOr10和AmOr18基因的表达量均显著高于飞行意蜂雄蜂大脑中的(P<0.05, 图8: A),而爬行与飞行意蜂雄蜂大脑中AmOr11和AmOr170基因的表达量没有显著差异(P>0.05, 图8: A);在9-ODA处理下,爬行与飞行意蜂雄蜂大脑中4个AmOrs基因的表达量没有显著差异(P>0.05, 图8: B)。
3 讨论
性信息素受体在昆虫两性交流中发挥重要作用,雄虫能长距离地识别性成熟雌虫释放的性信息素,来寻找配偶并与之交配(Brockmannetal., 2006; Becheretal., 2010; Anderssonetal., 2014, 2016)。候选性信息素受体基因Or10,Or11,Or18和Or170在蜜蜂雄蜂触角中高表达,其中Or11特异性识别9-ODA(Wanneretal., 2007b)。
本研究发现QMP和9-ODA均能抑制Or11基因在中蜂雄蜂与意蜂雄蜂触角中的转录表达(图1, 3, 5和7)。这与斜纹夜蛾Spodopteralitura受性信息素处理后与未处理相比,其气味受体基因Or3,Or13和Or54表达下调结果(林欣大等, 2015)相似。蜜蜂气味受体与学习记忆有着密切的关系。训练工蜂对芳樟醇(linalool)和9-ODA进行喙伸反应(proboscis extension reflex, PER)嗅觉学习后,其对应的气味受体基因Or151与Or11转录水平均下调,且触角电位(electroantennography, EAG)反应也随之降低(Claudianosetal., 2014)。这一研究报道与本试验结果一致。蜜蜂对食物气味的联想记忆能力非常突出(Menzel and Muller, 1996; Giurfa, 2007),微弱熟悉的气味吹入蜂巢内足以触发蜜蜂相关的视觉和嗅觉刺激的跨模式回忆,引诱蜜蜂搜寻食物来源(Reinhardetal., 2004a, 2004b, 2006)。蜜蜂为了适应外界不断变化的气味环境,在成功学习了某种气味后,会相应地减少该气味受体表达,并上调其他气味受体表达以确保能继续灵敏地察觉、识别新的气味;在食物源消失或不再加强气味记忆时,蜜蜂气味受体的表达水平也将波动(Menzel and Muller, 1996)。本研究发现,中蜂雄蜂与意蜂雄蜂脑部组织中Or11基因的表达量也在9-ODA刺激后降低,这可能是Or11识别9-ODA后在蜜蜂大脑神经传导中继续发挥重要作用。昆虫触角中气味受体特异性结合在气味受体神经元(olfaction receptor neurons, ORNs)的细胞膜上,ORNs的功能取决于ORs的功能,相似的ORNs的轴突会聚集到昆虫中脑部嗅觉神经中枢——触角叶(antennal lobe, AL)内一个或几个定型的嗅神经球(glomeruli)上(Strausfeld, 2009),其中雄蜂AL中宏嗅神经球(macroglomeruli 2, MG2)特异性应答9-ODA(Sandoz, 2006),最终MG2通过投射神经元(projection neurons, PNs)将嗅觉信息传递至中枢神经系统——蘑菇体(mushroom body, MB)产生指令后做出相应的行为反应(Hansson and Stensmyr, 2011)。Or11具体在雄蜂脑部哪些神经组织中表达分布仍不清楚,需要进一步研究探索。
值得注意的是,在QMP或9-ODA刺激下,飞行中蜂雄蜂大脑中AcOr11基因的表达量显著高于爬行中蜂雄蜂大脑中的(图4),而飞行与爬行中蜂雄蜂触角中AcOr11基因的表达没有显著差异(图2)。这与性成熟时期中蜂雄蜂触角与大脑中AcOr11基因表达特性的结果(Liuetal., 2019)相似。我们推测,中蜂雄蜂脑组织中的气味受体AcOr11参与交配行为的调节。雄蜂在蜂群内、外同样能感知QMP,而其反应却截然不同。性成熟雄蜂在蜂群内不能与处女蜂王交配,雄蜂更多地集中在蜜粉脾、蜂箱内壁及底部等远离蜂王的位置(Ohtani and Fukuda, 1977),而户外飞行中的雄蜂能被处女蜂王或人工合成的QMP与9-ODA引诱追逐(Brockmannetal., 2006)。黑腹果蝇D.melanogaster通过调整嗅觉神经元性信息素受体的表达,以提高其对性信息素反应的灵敏性(Graham, 2015)。交配行为能抑制雄性小地老虎Agrotisipsilon对性信息素的嗅觉神经生理反应(Gadenneetal., 2001)。
本研究还发现,中蜂雄蜂触角AcOr18和AcOr170基因受QMP或9-ODA刺激后表达显著下调(图1),而意蜂雄蜂触角AmOr18和AmOr170基因的mRNA表达量不受QMP影响(图5)。这可能是由于Or18与Or170在中蜂、意蜂雄蜂触角中分布水平存在差异,致使该受体基因表达量也不同。蜜蜂感受蜂王信息素的嗅觉感器主要为板形感受器(赵慧婷等, 2019),其在意蜂雄蜂触角上的分布数量约为中蜂雄蜂的2.5倍(宋飞飞, 2011)。因此,我们推测中蜂雄蜂通过板形感受器表达出更多气味受体以应答性信息素,而意蜂雄蜂进化出更多的板形感受器来应对其对蜂王信息素的识别。此外QMP刺激后中蜂、意蜂在大脑中Or170表达特性与Or11一致,可能提示Or170也参与大脑组织对QMP识别过程。对Or170如何识别具体的蜂王性信息素成分或参与调控哪些气味受体,还需要进一步研究。
本研究通过对中蜂、意蜂雄蜂候选性信息素受体基因表达特性的研究,为探究雄蜂嗅觉识别机制以及婚飞行为研究提供了理论基础。本研究原计划取在空中追逐处女蜂王的飞行的性成熟雄蜂,由于很难寻找到处女蜂王交配的雄蜂聚集区,也尝试过用遥控无人机在空中取飞行雄蜂样品,都没有成功。后来是在巢门中取标记飞行回巢的14日龄性成熟雄蜂,但这种性成熟雄蜂与空中追逐处女蜂王的飞行雄蜂的生理以及信息素受体基因表达差异,目前没有报道,还有待于以后深入对比分析。
