梨小食心虫生物钟基因Gmper和Gmtim的鉴定及其对羽化节律的影响
2020-08-06方海波刘小侠张青文
方海波, 张 璟, 刘小侠, 张青文, 李 贞
(中国农业大学昆虫学系, 北京 100193)
梨小食心虫Grapholitamolesta属鳞翅目(Lepidoptera)卷蛾科(Tortricidae),简称“梨小”,是一种世界性果树害虫,在我国除西藏以外的各果产区均有发生。梨小食心虫主要以幼虫造成为害,果树生长季前期主要为害桃树新梢,后可转入梨、苹果、杏、李等多种果园蛀食为害果实(陈梅香等, 2009)。梨小食心虫蛀梢导致果树长势减弱,蛀果后又可严重降低果质和产量,影响果农收入(周仙红等, 2011)。由于梨小食心虫钻蛀取食、为害隐蔽,因此有效防控时间短,常规防控难以获得理想效果。
羽化、求偶、交尾、繁殖等过程是昆虫行为节律研究的重要内容。另外,害虫羽化高峰期经常是田间成虫防治关键期。因此,掌握害虫羽化规律对于适时开展有效防治具有重要参考意义。研究表明,昆虫的羽化规律同时受光周期、温度、性别等多种环境和个体因素的影响(Edmondsetal., 2000; Thiéryetal., 2014; Yadavetal., 2015)。例如,在自然条件下,条纹小斑蛾Thyrassiapenangae在弱光状态下羽化率更高,羽化高峰也会随着温度的升高而提前,但羽化时间受光周期影响极小(何海敏等, 2015);温湿度对杨小舟蛾Micromelalophasieversi的羽化有极显著影响,具体表现为随温湿度的增加其羽化率呈先上升后下降的驼峰式节律,并于光期温度30±1℃、暗期温度24±1℃、光期湿度50%±10%、暗期湿度70%±10%时达到最佳羽化效率,但不同光周期处理对其羽化节律无显著影响(范立鹏等, 2014);印鼠客蚤Xenopsyllacheopi的性比和羽化规律探究实验发现,实验室种群和野外种群中雌性均多于雄性,并且雄性的累积羽化率随时间的变化呈S型增长规律,但雌性的羽化数量与时间呈线性负相关关系(孟凤霞等, 2006);杨小舟蛾雄蛹羽化高峰期比雌蛹提前4 d(范立鹏等, 2014)。
生物的行为节律均受生物钟基因(circadian clock genes)的调控,目前确认的主要生物钟基因有钟蛋白基因(clock,clk)、周期蛋白基因(period,per)、永恒蛋白基因(timeless,tim)、周期循环蛋白基因(cycle,cyc)、双时蛋白基因(double-time,dbt)、旋转蛋白基因(vrille,vri)和隐花色素基因 (cryptochrome,cry)等。其中,以果蝇为模式的生物钟基因研究较为深入。在果蝇体内, CLK和CYC可结合形成异二聚体,此二聚体在正午时分可以与E-box序列(CACGTG)结合,激活多个节律基因(如per,tim,vri或PAR结构蛋白基因)启动子的E-box元件。其中,节律行为的核心激活因子per和tim的mRNA在傍晚/夜晚时分被大量转录,PER蛋白和TIM蛋白在细胞质中大量积累,TIM蛋白对PER蛋白的稳定存在至关重要,缺少TIM蛋白的保护PER蛋白将被 Double-Time (DBT)激酶磷酸化,磷酸化的PER蛋白将被泛素化并随之降解。夜间TIM和PER蛋白积累,各自或以异质二聚体形式进入细胞核内。PER可结合DBT激酶共同进入细胞核内,进入细胞核后,PER-DBT-TIM复合体靶标CLK和CYC,终止CLK和CYC的转录。白天期间CRY蛋白促进TIM的降解进而导致PER/TIM的降解,CLK和CYC的转录重新激活,这样在光照驱动下,相应生物钟基因呈现约24 h的周期性变化,对外表现为生物体的昼夜节律性(Collinsetal., 2006; Tataroglu and Emery, 2014)。与此同时,VRI和CWO对CLK的转录调控也共同参与生物体昼夜节律的调节作用(Zhouetal., 2016)。
在生物钟反馈回路中,per和tim基因作为核心激活因子具有极其重要的作用。因此,对重要蛀果害虫梨小食心虫生物钟基因per和tim的分子鉴定及两基因在梨小食心虫羽化过程中的功能分析将为进一步明确生物钟基因对鳞翅目害虫羽化节律的调控作用和监测害虫羽化规律进行适时防控提供数据参考,同时可为开发基于发育行为节律调控的梨小食心虫防控方法提供新线索。
1 材料与方法
1.1 供试昆虫
本实验的供试昆虫来自中国农业大学IPM实验室长期饲养的梨小食心虫室内种群,原始种群采集于辽宁果树科学研究所,并在室内采用人工气候箱连续培养30代以上,培养条件为光周期14L∶10D,温度为26±1℃,相对湿度70%±10%。培养箱于早上8∶00时开灯,晚上22∶00时熄灯,记灯亮时间点为授时时间0 (ZT0)。具体饲养方法参照中国农业大学曹进军等方法 (Caoetal., 2015) 并加以改进,具体操作如下:成虫在干净的2 000 mL玻璃烧杯中饲养,利用蘸有10%蜂蜜水脱脂棉饲喂成虫,并于烧杯口盖上一层纱布防止成虫逃逸,烧杯内放1~2个干净无伤痕的苹果和硫酸纸作为梨小食心虫产卵场所;根据梨小食心虫产卵情况及时更换苹果,将更换下来的苹果置于一次性塑料盒中,盒盖上扎小孔透气;约两周后,将接有虫卵的腐烂苹果用手术刀小心剖开,将各龄幼虫置于装有人工饲料的培养皿中饲养至老熟,每日挑取4~5头老熟幼虫放入装有人工饲料的10 mL指形管中,脱脂棉封口;化蛹后小心将蛹掏出并置于底部铺有湿润滤纸的一次性杯子中,雌雄成虫羽化后配对交尾产卵。
1.2 梨小食心虫Gmper和Gmtim的克隆
通过序列分析,从梨小食心虫转录组(未发表)数据中获得生物钟基因Gmper和Gmtim的序列信息,利用Primer Premier 5.0软件设计序列全长的扩增引物(表1)。
取10头梨小食心虫老熟幼虫,采用Trizol法提取总RNA,并通过1%琼脂糖凝胶电泳检测RNA产物的完整性,同时采用NanoDrop 2000检测其浓度和纯度,取1 μg质量合格的总RNA进行反转录反应(TaKaRa公司反转录试剂盒),cDNA产物于-20℃保存备用。
以上述合成的cDNA为模板进行PCR扩增。由于预测序列较长,因此使用两对引物进行扩增拼接。反应体系: 2×PCR Mix 10 μL, 上下游引物(10 μmol/L)各1 μL, cDNA模板1 μL, ddH2O 7 μL。反应程序: 94℃ 5 min; 94℃ 30 s, 55℃ 30 s, 72℃ 40 s, 30个循环; 72℃ 10 min。PCR产物于4℃保存。
采用天根胶回收试剂盒对PCR产物进行纯化回收,将纯化的PCR产物连接至T载体 (北京全式金生物技术有限公司)并转化至大肠杆菌EscherichiacoliDH5α感受态细胞 (天根生化科技有限公司),随后接种至带有氨苄青霉素 (100 mg/mL, Sigma-Aldrich)的LB固体培养基中37℃培养过夜,随机挑选多个阳性单克隆送至上海生工公司进行测序分析。
1.3 序列比对和系统发育分析
采用DNAMAN的ORF Finder工具预测克隆序列的开放阅读框,并采用SMART(http:∥smart.embl-heidelberg.de/)进行结构域鉴定,分析结果证明克隆所得的两序列确实为梨小食心虫生物钟基因Gmper和Gmtim的cDNA序列全长,并将其提交至GenBank数据库。后续使用Expasy在线工具pI/Mw(http:∥web.expasy.org/compute_pi/)预测其编码蛋白分子质量及等电点;利用NCBIblast(http:∥www.ncbi.nlm.nih.gov/BLAST/)数据库检索获得其他昆虫生物钟基因序列,并采用DNAMAN6.0进行梨小食心虫与其他昆虫生物钟基因氨基酸序列的多重联配分析;采用MEGA6.06构建邻接(neighbour-joining)系统发育树,同时选取亲缘关系较远的啮齿目鼠科的PER和TIM分别作为GmPER和GmTIM的外群。
1.4 RT-qPCR检测梨小食心虫Gmper和Gmtim基因表达模式
根据所获得梨小食心虫Gmper和Gmtim开放阅读框序列设计qPCR引物(表1),并以EF-1α作为内参基因(Caoetal., 2015; Wangetal., 2017)进行基因表达水平检测。
收集梨小食心虫羽化24 h内雌、雄成虫,用眼科镊分别将头、胸、腹、足取下后置于EP管中用于后续基因表达水平的组织特异性检测,每性别每个组织样品包括3个生物学重复,每个重复的组织样品来自20头个体;另外,每隔3 h取1日龄雌、雄蛹头部分别置于EP管中,持续取样24 h,获得雌雄蛹头部各8个时间点样品,用于检测生物钟基因在蛹头部的表达水平随时间的变化模式,每性别每个样品包括3个生物学重复,每个重复来自20头个体。将上述样品迅速置于液氮中冷冻,并于-80℃保存用于后续总RNA的提取。
总RNA提取及cDNA合成参照1.2节。采用SYBR Primer Script RT-PCR Kit (TaKaRa)进行qPCR检测。反应体系(20 μL): SYBR 10 μL, ddH2O 7 μL, 正反向引物 (10 μmol/L)各1 μL, cDNA模板1 μL。反应条件: 95℃ 30 s; 95℃ 10 s, 60℃ 30 s, 40个循环后65~95℃ (每5 s增加0.5℃,用于特异性扩增的解离和熔解曲线分析)。
1.5 siRNA显微注射及干扰效率检测
本实验通过注射siRNA进行靶标生物钟基因的RNA干扰。为保证干涉效率,基于1.2节克隆和测定的基因序列,为Gmper和Gmtim分别设计合成3段siRNA,引物序列见表1,由苏州吉玛基因股份有限公司完成。取梨小食心虫2日龄蛹,分别将Gmtim的3段siRNA和Gmper的3段siRNA按1∶1∶1均匀混合,采用显微注射仪(NanojectⅡ, 美国)分雌雄蛹分别注射。注射时将蛹置于冰袋上以降低其活动力,为避免对头部的机械损伤,我们选择从近头的翅下进行扎入注射,每头虫注射1.5 μg siRNA,对照注射等量阴性对照(NC) (siRNA合成时由公司附赠,序列见表1)。注射后的梨小食心虫单头置于指形管中于正常条件下饲养。
注射后24, 48和72 h分别取样(每个时间点3个重复,每个重复10头个体),进行总RNA的提取、反转录,并采用qPCR进行干涉效率检测。反应体系(20 μL): SYBR 10 μL, 正反向引物(10 μmol/L)各1 μL, cDNA模板1 μL, ddH2O 7 μL。反应条件: 95℃ 30 s; 95℃ 10 s, 60℃ 30 s, 40个循环; 65~95℃ (每5 s增加0.5℃,用于特异性扩增的解离和熔解曲线分析)。
1.6 梨小食心虫羽化节律的观察
另收集1.5节中成功注射的蛹30头,以10头为一重复置于事先放入湿润滤纸的培养皿中,培养条件为:温度为26±1℃,相对湿度70%±10%,光周期14L∶10D。将皿置于摄像头下记录每头蛹的羽化时间。
1.7 数据分析
基因的相对表达量采用2-ΔΔCt方法计算,其中ΔCt=Ct目标基因-Ct内参基因, ΔΔCt=ΔCt样品-ΔCt对照。用SPSS软件进行数据差异显著性分析。梨小食心虫不同组织和羽化时间点的基因表达量采用SPSS软件进行单因素方差分析(Tukey氏多重比较);雌雄间同一组织的基因表达量的比较以及siRNA处理组与其相应对照组间基因表达量、羽化率的比较均采用独立样本T检验进行差异显著性分析。
2 结果
2.1 序列分析
梨小食心虫Gmper(GenBank登录号: MN862636)的开放阅读框序列长2 862 bp,编码953个氨基酸,蛋白分子量107 kD,等电点为6.18;蛋白结构域分析发现,序列中含2个PAS结构域和1个PAC结构域。Gmtim(GenBank登录号: MN862637)开放阅读框长3 048 bp,编码1 015个氨基酸;推测相应编码蛋白分子量115.1 kD,等电点为5.13。系统发育分析显示,梨小食心虫GmPER与其他鳞翅目蝶类和蛾类的PER都聚在一簇,但与蜚蠊目、直翅目和双翅目昆虫的PER分别聚在不同分枝上;与PER系统发育情况不同,GmTIM与柑橘凤蝶Papilioxuthus的TIM系统发育关系最近,并与甜菜夜蛾Spodopteraexigua、棉铃虫Helicoverpaarmigera、家蚕Bombyxmori和柞蚕Antheraeapemyi等鳞翅目蛾类的TIM聚在一簇 (图1~4)。

图4 邻接法构建的基于梨小食心虫GmTIM与其他昆虫TIM氨基酸序列的系统发育树(1 000次重复)Fig. 4 Phylogenetic tree of GmTIM from Grapholita molesta and TIM proteins from other insect species based on amino acid sequence by neighbour-joining method (1 000 replicates)
2.2 Gmper和Gmtim的表达模式分析
Gmper和Gmtim在雌、雄成虫头部的表达水平均显著高于两基因在胸、腹、足中的表达水平;相同组织雌雄之间基因表达水平的结果分析表明,两基因在雄成虫胸和足中的表达水平均显著高于雌成虫(胸:tper=49.376,Pper=0.0003;ttim=16.770,Ptim=0.0007; 足:tper=19.318,Pper=0.002;ttim=15.741,Ptim=0.004<0.05),雄成虫腹部Gmper的表达水平高于雌虫(t=4.338,P=0.012),而雌虫腹部Gmtim表达量显著高于雄成虫(t=3.608,P=0.023),但头部两基因表达水平在雌雄之间均无显著性差异 (tper=2.247,Pper=0.088;ttim=0.679,Ptim=0.534) (图5)。

图5 Gmper (A)和Gmtim (B)在梨小食心虫成虫不同组织中的表达量Fig. 5 Expression levels of Gmper (A) and Gmtim (B) in different tissues of Grapholita molesta adults 图中数据为平均值±标准误;柱上不同小写字母和大写字母分别表示基因表达量在雄成虫和雌成虫不同组织间差异显著(P<0.05, Tukey氏多重比较);星号和ns分别表示雌雄成虫之间表达水平差异显著(P<0.05)和不显著(P>0.05)(独立样本T检验)。Data in theFigure are mean±SE. Different lowercase letters and uppercase letters above bars indicate significant difference in the gene expression level among different tissues of male adults and female adults, respectively (P<0.05, Tukey’s multiple comparison), and asterisk and ns represent significant difference (P<0.05) and no significant difference (P>0.05), respectively, in the gene expression level between male and female adults (independent samples T-test).
蛹头部两基因的日表达模式分析表明,Gmper和Gmtim呈现出类似的表达节律,且Gmper的表达水平在所有检测时间点均显著低于Gmtim的表达水平。雌雄蛹中,Gmper在光期和暗期均各有一个表达高峰,雄蛹头部光期的表达高峰出现在ZT12,暗期表达高峰出现在ZT18;雌蛹头部光期表达峰值出现在ZT0,暗期表达高峰出现在ZT15;雄蛹头部的表达峰值均出现在雌蛹之后(图6: A)。Gmtim在梨小食心虫蛹头部的表达水平均呈现出暗期高于光期的表达趋势,其中雌雄蛹的表达最低值均出现在ZT3,而表达峰值分别出现在ZT18的雄蛹头部和ZT15的雌蛹头部。进一步分析发现,除ZT3外,Gmper表达量在雄蛹头部的表达量均极显著高于对应时间点的雌蛹头部(t0=12.681,P0=0.0002;t3=4.051,P3=0.015;t6=11.99,P6=0.0003;t9=12.812,P9=0.0002;t12=16.661,P12=0.00008;t15=20.216,P15=0.00004;t18=9.941,P18=0.008;t21=15.235,P21=0.004) (图6: A);除ZT3和ZT12外,Gmtim在雄蛹头部的表达量极显著高于对应时间点的雌蛹头部(t0=11.328,P0=0.0003;t3=2.267,P3=0.086;t6=6.715,P6=0.003;t9=18.527,P9=0.00005;t12=0.074,P12=0.945;t15=4.628,P15=0.01;t18=17.299,P18=0.00007;t21=10.037,P21=0.006) (图6: B)。

图6 Gmper(A)和Gmtim(B)在梨小食心虫蛹头部的日表达模式Fig. 6 Daily expression patterns of Gmper (A) and Gmtim (B) in the head of Grapholita molesta pupae ZT: 授时时间Zeitgeber time; ZT0-ZT14: 光期Photophase; ZT14-ZT24: 暗期Scotophase. 图中数据为平均值±标准误;图上双星号表示雌雄间基因表达量差异极显著(P<0.01, 独立样本T检验)。Data in theFigure are mean±SE. Double asterisk represents extremely significant difference in the gene expression level between male and female (P<0.01, independent samples T-test).
2.3 RNAi对梨小食心虫羽化节律的影响
qPCR结果显示,注射siRNA可以显著降低Gmper和Gmtim在梨小食心虫蛹体内的表达水平。其中,雄蛹在注射Gmper-siRNA后,per在48 h和72 h呈现极显著下调趋势(tper-24h=0.540,Pper-24h=0.618;tper-48h=10.498,Pper-48h=0.0005;tper-72h=12.16,Pper-72h=0.0003)(图7: A);注射Gmtim-siRNA后24-72 h均表现出目的基因的极显著下调(ttim-24h=24.882,Ptim-24h=0.00001;ttim-48h=19.557,Ptim-48h=0.00004;ttim-72h=17.632,Ptim-72h=0.00006) (图7: C)。
雌蛹在注射Gmper-siRNA后,per在24-72 h呈现极显著下调趋势(tper-24h=15.438,Pper-24h=0.0001;tper-48h=7.334,Pper-48h=0.002;tper-72h=5.930,Pper-72h=0.004) (图7: B); 而注射Gmtim-siRNA后24和72 h均表现出目的基因的极显著下调(ttim-24h=16.721,Ptim-24h=0.0001;ttim-72h=26.42,Ptim-72h=0.0001) (图7: D)。
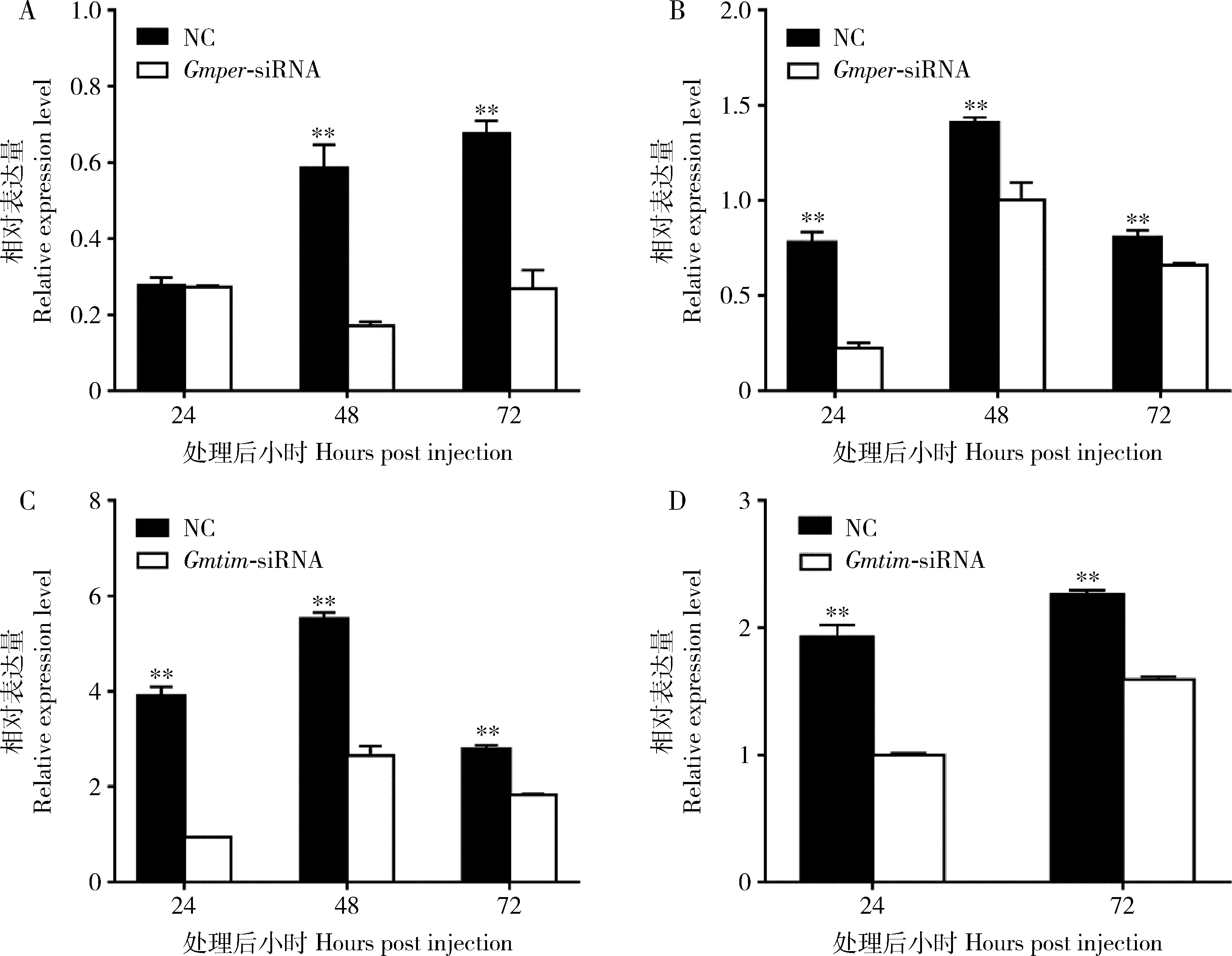
图7 梨小食心虫蛹体内Gmper (A, B)和Gmtim (C, D)的siRNA基因干涉效率Fig. 7 Interference efficiency of Gmper (A, B) and Gmtim (C, D) siRNA in Grapholita molesta pupae A, C: 雄蛹Male pupa; B, D: 雌蛹Female pupa. 图中数据为平均值±标准误;柱上星号和双星号分别表示基因表达量在siRNA处理组与对照组(NC)间差异显著(P<0.05)和极显著(P<0.01)(独立样本T检验)。Data in theFigure are mean±SE. Asterisk and double asterisk above bars indicate significant difference (P<0.05) and extremely significant difference (P<0.01), respectively, in the gene expression level between the siRNA treatment group and the control group (NC)(independent samples T-test).
成虫羽化率监测结果表明,Gmper干涉处理组与对照组试虫的羽化节律呈现出相似的趋势,但对照组羽化高峰时间更加集中(ZT0),而处理组呈现出两个明显的羽化高峰时间(ZT0和ZT2),在ZT0时处理组羽化率显著低于对照组(t=2.616,P=0.045)(图8: A)。类似地,Gmtim干涉处理后,对照和处理组试虫羽化高峰仍然集中出现在ZT0时,但干涉处理组羽化高峰期的成虫羽化率显著低于对照组试虫(t=2.998,P=0.040) (图8: B),干涉处理组试虫羽化时间也较对照组更加分散,但对Gmper和Gmtim进行干涉后对试虫整体羽化率没有显著性影响(tper=1.457,Pper=0.219;ttim=1.251,Ptim=0.279) (图8: C)。

图8 分别RNAi干扰Gmper (A)和Gmtim (B)对梨小食心虫羽化节律以及总体羽化率(C)的影响Fig. 8 Effect of the RNAi-based Gmper (A) and Gmtim (B) silencing on the emergence rhythm and overall emergence rate (C) of Grapholita molesta ZT: 授时时间Zeitgeber time; ZT0-ZT14: 光期Photophase; ZT14-ZT24: 暗期Scotophase. 图中数据为平均值±标准误; 柱上ns表示siRNA处理组和对照组(NC)间无显著性差异(P>0.05, 独立样本T检验);星号和双星号分别表示差异显著(P<0.05)和极显著(P<0.01)(独立样本T检验)。Data in theFigure are mean±SE. ns above bars represents no significant difference between the siRNA treatment group and the control group (NC) (P>0.05, independent samples T-test), and the asterisk and double asterisk represent significant difference (P<0.05) and extremely significant difference (P<0.01), respectively by independent samples T-test.
3 讨论
本研究通过基因克隆、序列分析、基因表达量测定及基于RNAi的基因功能研究,初步分析了梨小食心虫Gmper和Gmtim的组织和时间表达模式及对成虫羽化节律的调控作用。序列分析结果显示,GmPER蛋白含有2个PAS结构域和1个PAC结构域。进化树分析发现,GmPER和GmTIM均分别与鳞翅目昆虫的PER和TIM聚为一支(图3和4),但与昆虫间亲缘关系的一致性有差异,部分进化树上很多节点的支持值较小,一方面这可能是由于两个基因处于较为活跃的进化中,另外,鉴于已报道的昆虫per和tim基因的全序列较少,分析样本不足可能也会影响其准确性。在后续获得较多的全长基因序列后进行进一步比对,会得到更为可靠的分析结果。
在果蝇研究中,PAS (Per-Arnt-Stim)功能域,可以作为一个开关进行PER蛋白和TIM蛋白的结合调控(Yildizetal., 2005; Kingetal., 2011)。另外PAS+PAC结构域可以充当光传感器功能,接受外界环境光信号进而调控一系列下游回路(Ponting and Aravind, 1997)。TIM是一种酸性蛋白质,不仅在周期节律中起到核心因子的作用,在生物发育中也有重要作用。如在哺乳动物中,tim的缺失可导致上皮组织发育畸形,胚胎死亡率升高,近年来学者更是在其对肿瘤发生发展的预报功能上投入大量研究力量(宋何煜等, 2014)。蛋白激酶基因产物DBT对PER的稳定性具有负调控作用,同时也可以介导磷酸化后的PER与TIM结合形成稳定二聚体。在果蝇中PER/TIM复合体可抑制CYC和CLK的转录,CRY经光诱导后作用于TIM使其降解,自此PER/TIM复合体降解,CYC和CLK的新一轮转录启动(Ashmore and Sehgal, 2003)。因此,per和tim在昆虫体内作为重要的生物钟反馈途径元件保证了生物体一天24 h的行为活动节律。
基因表达水平检测表明,梨小食心虫雌雄成虫中,Gmper和Gmtim的表达水平均在头部最高(图5)。在果蝇中,生物钟可分为中枢生物钟和外周生物钟,中枢生物钟被定位于头部,梨小食心虫体内Gmper和Gmtim在头部的高表达说明两基因也在中枢生物钟中发挥更重要的调控作用,若要进一步探究其调节中枢可再从脑部、触角、复眼等结构进行更细致的表达分析。蛹头部Gmper和Gmtim的表达峰值均出现在暗期,在光期呈现表达水平低谷,且雄蛹中的表达水平显著高于雌蛹(图6),说明蛹期两基因的表达具有一定的昼夜节律性但同时存在一定的性别差异。两基因在夜间的大量表达与果蝇中tim和per的消长规律较为吻合(Tataroglu and Emery, 2014)。由于梨小食心虫的羽化高峰出现在凌晨,因此推测,蛹期生物钟基因在夜间的高表达可能对次日黎明的羽化有重要调控作用。果蝇的相关研究结果也表明,羽化节律的准确性依赖于昼夜节律调控作用的加强(Varmaetal., 2019)。虽然光照对蛹期Gmper和Gmtim的表达有显著的抑制效果,但昆虫各个时期对光的敏感性可能存在差异,如在家蚕中发现卵孵化期给予的光周期、温度变化对幼虫至蚕蛾期的per和tim表达无显著性影响(宋艳, 2009)。在鳞翅目昆虫中,per的作用和该基因在昼夜节律中的负反馈作用存在争议,但近年来通过基因敲除技术对家蚕的研究发现,敲除per的试虫出现羽化规律紊乱现象(Ikedaetal., 2019),这为进一步探索per在鳞翅目昆虫昼夜节律调控中发挥的作用提供了基础和方向。在梨小食心虫中,雌蛹Gmper和Gmtim的表达高峰期较雄虫略有提前(图6),猜测可能与雌虫的卵巢发育、交尾行为等有关。在哺乳动物中,确有大量数据表明per的缺失会导致卵巢发育受阻和产仔量下降(李瑞文, 2013; 刘超, 2015)。在昆虫中,per,tim和dbt等生物钟基因的缺失对于昆虫的卵泡发育、产卵行为、卵孵化率等都具有较大影响。如在果蝇中,per和tim的缺失会导致果蝇中成熟卵母细胞数量下降,而雌虫的产卵量可下降近50%(Beaveretal.,2003)。在双斑蟋Gryllusbimaculatus中tim2基因缺失后除了影响试虫的活动节律之外,卵巢中卵母细胞的数量会大大下降,且卵孵化率下降至2%以下(Noseetal., 2017),因此生物钟基因对生殖系统影响的探究极具研究潜力,可作为后续深入全面探究的切入点。面对诸多未探明的结果,昆虫全发育期的系统表达模式分析可为更加细致的探究per和tim的调控作用机制提供更多的参考信息。
Gmtim和Gmper的基因表达干涉对梨小食心虫的羽化节律有显著影响。与对照相比,处理组节律性明显减弱,表现出羽化时间点更加分散、羽化高峰期的羽化率显著低于对照的现象(图8: A, B)。果蝇的研究表明tim缺失型果蝇突变体timmutant的活动节律出现紊乱,但其羽化规律没有改变(Wülbecketal., 2005)。但麻蝇Sarcophagacrassipalpis的研究发现,per基因在温度影响羽化节律的过程中起到极其重要的调控作用。类似地,葱蝇Deliaantiqua的研究表明,温度改变可导致昆虫羽化时间和生物钟基因表达出现一致的改变。这些结果都说明,生物钟基因在某些种类昆虫的羽化过程发挥着重要作用 (Miyazakietal., 2016; Shortetal., 2016)。然而,不同物种的生活环境、生物学习性不同,因此种间的生物钟基因种类、表达模式和调控机制等均可能存在差异。随着更多相关研究,尤其是受物候变化影响巨大的农林害虫的相关研究进展的报道,将为我们进一步理解生物钟对昆虫羽化节律的调控作用提供更多参考,并可能为开发基于发育和行为节律调控的害虫防控方法提供新思路或新靶标。
