发酵辣椒中生物胺含量及其品质分析
2020-06-15吴训忠支菁蕾阚建全武运杜木英
吴训忠,支菁蕾,阚建全,武运,杜木英*
1(食品科学与工程国家级实验教学示范中心(西南大学),重庆,400715) 2(中匈食品科学合作研究中心,重庆,400715) 3(新疆农业大学 食品科学与药学学院,新疆维吾尔自治区 乌鲁木齐,830052)
食品在发酵过程中由于微生物作用不可避免地产生生物胺。生物胺是一类低分子质量含氮的有机活性物质,通常分为单胺和多胺两大类,广泛存在于多种食物之中,特别是发酵食品。生物胺按来源不同,可分为两种合成途径:一种是内源性生物胺,由醛或酮的转氨作用生成属于脂肪族的生物胺[1];二是由游离氨基酸脱羧产生,即游离氨基酸在微生物的氨基酸脱羧酶作用下脱羧生成相应生物胺,此途径需满足3个基本条件:氨基酸(前体物质);产氨基酸脱羧酶的微生物及适宜该微生物的环境条件。同时生物胺也是生物体内重要的活性成分,是激素、生物碱、核酸等物质合成的前体物质,适量的生物胺可以促进人体生长、增强代谢活力、清除自由基和增强肠道系统免疫功能[2-3],但过量的生物胺则会引起人体不良反应,如头痛、呕吐、心悸、呼吸紊乱及血压变化等[4]。组胺在生物胺中毒性最大,过量会引发头痛、消化障碍、血压异常,甚至有一定神经性毒性[5]。酪胺毒性次之,过量也会引起头痛和高血压等反应。尸胺和腐胺本身毒性较小,但这两者能抑制组胺和酪胺相关代谢酶的活性而进一步增加组胺和酪胺的含量,从而增强人体的不适症状[6],并且这2种生物胺能够与亚硝酸盐反应产生亚硝胺[7],具有潜在的致癌性。另外,高浓度的生物胺会严重影响食品风味甚至改变其成分[8]。因此,监控食品中的生物胺水平,控制食品中生物胺的形成,有助于提高和改善食品的质量和安全性。生物胺目前尚未有统一的限量标准,主要是因为:1)种类及毒性不一;2)生物胺可以在人体内相互转化[2];3)毒性受其他生物胺、胺氧化酶等影响;4)不同人体对生物胺敏感性不同。对于组胺,美国规定水产品中不得超过50 mg/kg;欧盟规定不得超过100 mg/kg;我国特别规定鲐鱼中生物胺不得超过1 000 mg/kg,其他鱼类不得超过300 mg/kg。
发酵辣椒是我国特别是西南一带较为流行的日常调味品,以新鲜辣椒为主要原料,添加食盐、酒、生姜、大蒜等调味辅料,采用传统工艺经厌氧发酵制成,保留了新鲜辣椒的形态、辣味,又有特有的发酵风味和香气,具有增味、增香、开胃、增进食欲等作用。我国常见的传统发酵辣椒制品有糟辣椒、剁椒、泡椒、酱辣椒、鲊辣椒5种。
目前关于生物胺的研究,多集中于我国特有的发酵食品,如豆瓣酱[9]、豆豉[10]、黄酒[11]、肉类产品[12]等。在肉类、豆豉、酱油等原材料蛋白质含量较高且发酵旺盛的食品中生物胺含量较高,甚至可以达到1 898 mg/kg。同时在生物胺控制方面部分研究也取得了相应研究成果[13-14],主要针对生物胺形成的途径进行控制。
为更加全面地评估发酵辣椒的综合品质,本研究采集云南、贵州、四川等地的各种发酵辣椒,采用柱前衍生-高效液相色谱法检测了5种发酵辣椒共20个样品中的生物胺含量,检测分析了可能与生物胺含量相关的还原糖、总酸及氨基酸态氮含量理化参数,分析发酵辣椒中不同含量生物胺存在的潜在原因。同时采用评分法进行感官评价,综合以上评价发酵辣椒品质,以期为发酵辣椒中生物胺的安全及品质研究提供参考依据。
1 材料与方法
1.1 材料与试剂
实验用发酵辣椒样品编号见表我。各样品于-18 ℃下保存。

表1 样品编号表Table 1 Sample number
色胺(CAS:61-54-1,纯度>98%)、腐胺(CAS:110-60-1,纯度>98%)、尸胺(CAS:462-94-2,纯度>98%)、2-苯乙胺(CAS:64-04-0,纯度>97%)、苯甲酰氯(纯度>98%),东京化成工业株式会社;亚精胺(CAS:124-20-9,纯度>98%)、精胺(CAS:71-44-3,纯度≥98%),上海阿拉丁生化科技股份有限公司,HCl、NaOH、NaCl、乙醚,分析纯,成都科龙化工试剂厂。
1.2 仪器与设备
LC-20A高效液相色谱仪,日本岛津公司;MX-F微型旋涡振荡器,上海泸西分析仪器有限公司;DK-8D型电热恒温水槽,上海一恒科技有限公司;PGC-21D可调式氮吹仪,北京中诺远东公司;VS-35S可调匀浆机,无锡沃信仪器有限公司;HZ-9211K恒温振荡器,太仓市科技器材厂;TG16可调高速离心机,长沙英泰仪器有限公司;pHS-3C pH计,上海仪电科学仪器股份有限公司;UV-1240紫外分光光度计,日本岛津公司。
1.3 试验方法
1.3.1 样品制备
1.3.1.1 生物胺标准储备液的制备
准确称取生物胺标准品各10 mg,以0.1 mol/L HCl溶液稀释,配制标准储备溶液,使其终质量浓度为1 mg/L,于4 ℃冰箱储存。
取上述各标准品储备液,仍以0.1 mol/L HCl溶液为稀释溶液配制成终质量浓度分别为0.5、1.0、2.0、5.0、10.0、20.0、40.0、60.0、80.0 μg/L单标准品使用液及混合标准品使用液。
1.3.1.2 生物胺的柱前衍生
吸取2 mL上述各浓度的生物胺混合标准溶液,分别加入2 mol/L NaOH溶液1 mL和苯甲酰氯10 μL,旋涡振荡混匀后,在30 ℃下避光反应40 min,并每隔10 min振荡混匀1次。完成后加入饱和NaCl溶液2 mL。然后加入无水乙醚3 mL进行萃取,1 200 r/min离心10 min后小心移取乙醚层于10 mL离心管中,再重复提取1次,合并乙醚层。用氮吹仪在35 ℃下吹干,最后用1 mL甲醇(色谱纯)溶解,0.45 μm过膜后进行检测分析。
1.3.1.3 样品衍生化
准确称量辣椒样品10 g于离心管中,加入20.00 mL 0.1 mol/L HCl溶液,使用匀浆机得到匀浆,振荡提取10 min后静置5 min,8 000 r/min离心15 min,取上清液于50 mL容量瓶;向沉淀中再次加入20.00 mL 0.1 mol/L HCl溶液按上述步骤重复提取,合并上清液。0.1 mol/L HCl定容至50 mL,混匀取2 mL于离心管中,加入2 mol/L NaOH溶液1 mL,10 μL苯甲酰氯静置30 s,于30 ℃避光加热40 min;继续加入2 mL饱和NaCl溶液、3 mL乙醚,1 200 r/min离心10 min,取上层液体置于离心管中。下层液体再次加入3 mL乙醚,1 200 r/min离心10 min,合并上层液体。35 ℃氮吹仪吹干,1 mL甲醇溶解,0.45 μm过滤膜备用。
1.3.2 生物胺测定
色谱柱为Thermo-C18(250 mm×4.6 mm,5 μm),流动相A为超纯水,流动相B为甲醇。参考刘敏等[16]的方法采用梯度洗脱(表2),为降低系统压力保证设备安全运行,流速设为0.6 mL/min,紫外检测波长为254 nm,进样量20 μL,柱温30 ℃。

表2 梯度洗脱程序Table 2 Gradient elution program
1.3.3 理化指标的测定
1.3.3.1 还原糖的测定
以3,5-二硝基水杨酸法进行测定,检测波长为550 nm,DNS显色剂用量为2.0 mL,沸水浴显色时间为5 min。
1.3.3.2 总酸的测定
取25.00~50.00 g匀浆,使之含0.035~0.070 g酸,置于250 mL三角瓶中。加入40~50 mL水及0.2 mL体积分数1%酚酞指示剂,用0.1 mol/L NaOH标准溶液滴定,至微红色且30 s不褪色。空白试验以水代替。样品中的总酸含量以质量分数(X)计,按公式(1)计算:
(1)
式中:c(NaOH),NaOH标准滴定溶液浓度,mol/L;V1,滴定试液时消耗NaOH标准滴定溶液的体积,mL;V2,空白试验时消耗NaOH标准滴定溶液的体积,mL;K,换算系数,苹果酸(0.067),乙酸(0.060),酒石酸(0.075),柠檬酸(0.070 0)(含1分子结晶水),乳酸(0.090),HCl(0.036),H3PO4(0.049);n,试液稀释倍数;m,试样的质量,g。
1.3.3.3 氨基酸态氮的测定
将样品搅拌均匀后放入研钵,在10 min内迅速研磨至无肉眼可见颗粒,装入磨口瓶中备用。用已知质量的称量瓶称取搅拌均匀的样品5.0 g,用50 mL 80 ℃左右的蒸馏水分数次洗入100 mL烧杯中,冷却后转入100 mL容量瓶中,用少量水分次洗涤烧杯,洗液并入容量瓶中,并加水至刻度,混匀后过滤。吸取滤液10.0 mL,置于200 mL烧杯中,加60 mL水,开动磁力搅拌器,用NaOH标准溶液[c(NaOH)=0.050 mol/L]滴定至酸度计指示pH值为8.2。加入10.0 mL甲醛溶液,混匀。再用NaOH标准滴定溶液继续滴定至pH值为9.2。同时做试剂空白试验,取 80 mL水,先用NaOH标准溶液调节至pH值为8.2,再加入10.0 mL甲醛溶液,用NaOH标准滴定溶液滴定至pH值为9.2。样品中的氨基酸态氮的含量(X)按公式(2)计算:
(2)
式中:X,试样中氨基酸态氮的含量,g/100 g;V1,测定用试样稀释液加入甲醛后消耗NaOH标准滴定溶液的体积,mL;V2,试剂空白实验加入甲醛后消耗NaOH标准滴定溶液的体积,mL;c(NaOH),NaOH标准滴定溶液的浓度,mol/L;0.014,与1.00 mL NaOH标准滴定溶液[c(NaOH)=1.000 mol/L]相当的氮质量,g;m,试样质量,g;V3,试样稀释液的取用量,mL;V4,试样稀释液的定容体积,mL;100,单位换算系数;计算结果保留2位有效数字。
1.3.4 感官分析评价
参考刘昕等[15]的质量评价指标分析修改后进行感官评定,总分60分,评定指标为色泽、香气和口感,计算平均分作为发酵辣椒制品的最终结果。感官评分表如表3所示。

表3 感官分析评分表Table 3 Sensory analysis score sheet
1.4 数据分析
所有数据均使用SPSS Statistic 20.0软件进行数据的线性回归分析,结果采用Origin 2018软件进行统计和绘图。
2 结果与分析
2.1 生物胺检测
2.1.1 生物胺标准品曲线回归方程
生物胺标准品液相色谱图见图1。结果显示该方法可使试样中的生物胺在25 min内有效分离,且峰形良好。

图1 生物胺标准品液相色谱图Fig.1 HPLC chromatogram of biogenic amine standards
通过高效液相检测单种生物胺标准品可得到8种生物胺的保留时间,梯度浓度检测得到各生物胺曲线回归方程,由表4可知其相关性系数R2均大于0.997,说明峰面积与生物胺含量之间存在显著的线性相关性。连续对40 μg/L混合标准品进样6次,RSD在0.05%~6.27%之间,以信噪比(S/N)>3作为检出限的判断标准,以信噪比(S/N)>10作为定量限的判断标准,样品含量<定量限标准不计算,酪胺的检测限最高为0.336 mg/kg,色胺最低为0.013 mg/kg。

表4 标准曲线的回归方程Table 4 Result of regression equations
2.1.2 样品中的生物胺含量及分析
各样品中的生物胺含量如表5,所有样品生物胺总量在3.281~398.381 mg/kg,跨度范围较大,说明不同种类发酵辣椒生物胺总量差别较大。所有样品中均含有酪胺,其中3号、4号样品中含量较高; 5号、 13号样品中色胺含量较高。由图2可见,糟辣椒样品中酪胺的含量明显高于其他种类发酵辣椒,泡椒样品中的酪胺含量均较低,同时11个泡椒样品中有8个样品生物胺含量均较低,此现象可能与糟辣椒和泡椒的制作工艺有关,糟辣椒多是取鲜红辣椒剁细后加入盐、酸、姜等调味料拌匀后封坛发酵,传统泡椒多是加入姜、蒜等采用直接酸渍或盐渍制成,发酵环境盐度及酸度高于糟辣椒,抑制了微生物的生长繁殖,从而抑制了生物胺的形成。大部分样品中酪胺、腐胺、尸胺、组胺占生物胺总量的绝大部分,5号样品、8号样品、7号样品、10号样品、13号样品中这4种生物胺含量占比较少,均是色胺或2-苯乙胺占总量的绝大部分,样品中高浓度色胺的原因可能是在原料中本身含有较高浓度的色氨酸。
所有样品都检测出的酪胺,是目前认为毒性仅次于组胺的生物胺。适量的酪胺具有明显的抗氧化作用[16],也对增强心率及血糖血压的升高有作用;但过量的酪胺会引起头痛、高血压等不良反应。另外,尸胺和腐胺可以抑制与其代谢相关酶活性从而增加酪胺的数量,进一步加强人体应激反应。目前世界各国及组织对于生物胺的限量没有一个较为统一的标准,而且大多是针对毒性较强的组胺,对于酪胺仅欧盟规定酪胺在食品中的限量为100 mg/kg[17]。

表5 发酵辣椒中的生物胺的检测结果Table 5 Determination of biogenic amines in fermented pepper
注:标注ND表示未检出;不同字母标注表示显著性差异(下同)
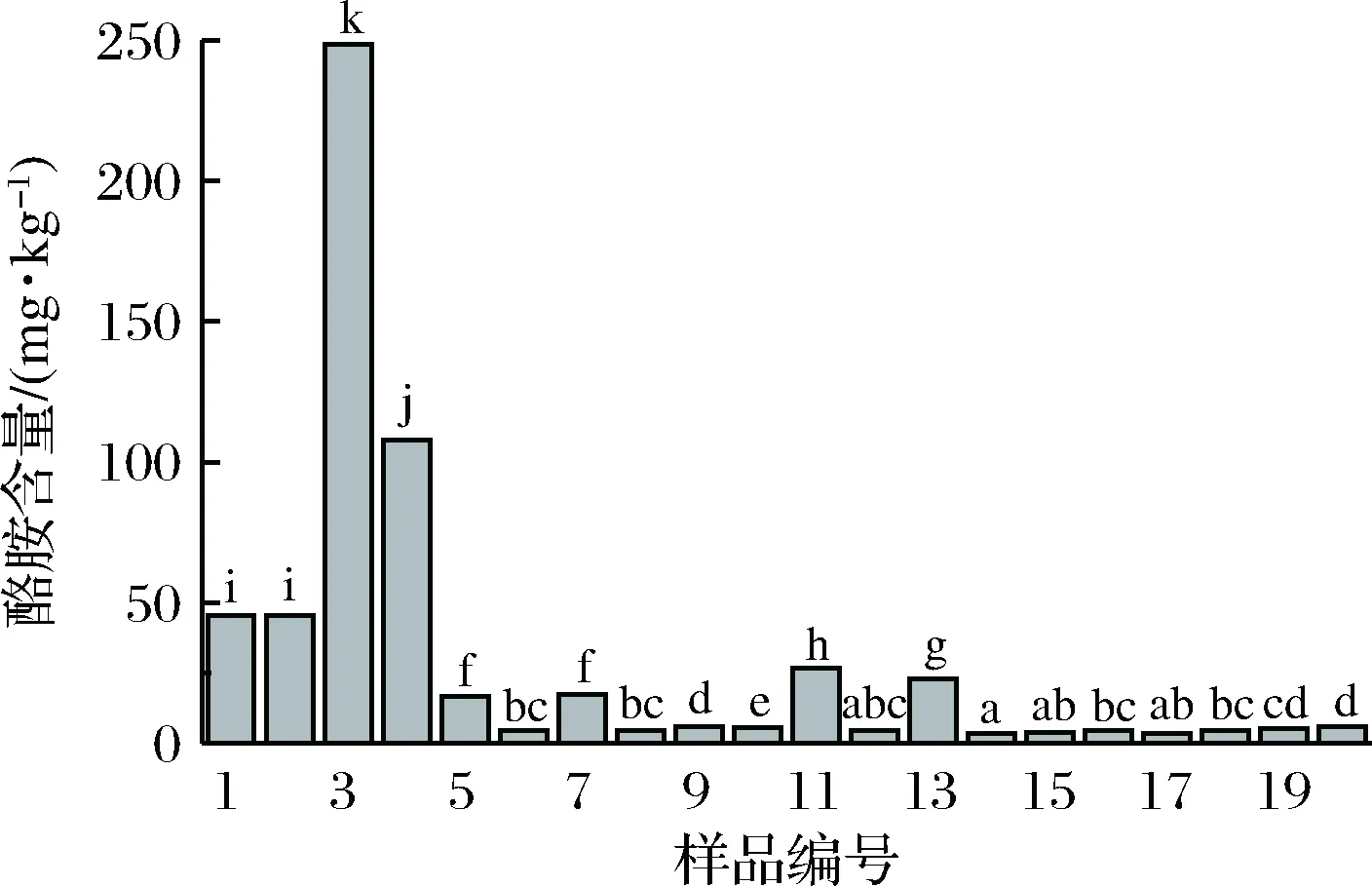
图2 各发酵辣椒酪胺含量Fig.2 The content of tyramine in fermented pepper注:不同小写字母表示显著性差异(下同)

图3 发酵辣椒生物胺总含量Fig.3 Total bioamine content in fermented pepper
作为一般日常生活中食用的调味品,发酵辣椒中的生物胺总量少,且毒性较强的组胺含量较低,以普通食物中的生物胺限定标准作为参照,每日从发酵辣椒中摄入的生物胺含量都低于限定标准,所以一般食用发酵辣椒不会引起不良反应。
2.2 理化指标
样品理化指标如表6所示,发酵辣椒样品中的还原糖含量在0.06%~10.21%之间,泡椒样品中的还原糖含量几乎都在1.00%以下,南昌糟辣椒还原糖含量甚至达10.21%。在辣椒发酵过程中,由于乳酸菌及其他杂菌的生长繁殖,会导致其中的葡萄糖含量迅速下降,到发酵后期由于酸含量的持续上升,绝大多数杂菌受到抑制,还原糖含量下降缓慢并趋于稳定。本次大部分样品中还原糖含量较低应是受蔬菜原料本身的影响,也有可能是因为发酵时间较长,发酵较为完全。其中还原糖含量较高的样品是由于原料中手动加入了糖进行提味增鲜或发酵程度较低。
糟辣椒总酸含量在0.18~1.85 g/100 g,较其他发酵辣椒有特殊明显的酸甜口味,但其酸味与总酸含量之间未发现明显的相关性。发酵辣椒样品中的氨基酸态氮含量在0.06~0.45 g/100 g,氨基酸态氮含量较高的发酵辣椒品种为酱辣椒,可能与其完全不同于其他发酵辣椒的制作工艺及原料的多样性有关。

表6 发酵辣椒理化指标检测结果Table 6 Physical and chemical indicators test resultsof fermented pepper
2.3 感官评价
从表7可知, 2号、6号、12号、14号、18号样品的得分均较高。得分较高的发酵辣椒基本保留了辣椒本身的红色,具有较好的色泽,且具有独有的醇香,容易激发人的食欲,易嚼,具有适当的酸甜及辣度。各样品的评分均满足人们的日常口味,出现的评分差异可能是在制作的过程中原料选择、发酵条件、发酵时间等的不同所造成的。由于7号河池酱辣椒及8号昆明酱辣子产品的工艺及主要原材料与其他辣椒制品相差较大,不纳入本感官评价范围。
选取得分较高的2号、6号、12号、14号、18样品得分进行雷达图分析。由图4可知,5个样品在色泽和香气得分存在较大的差异,2号样品色泽及6号的香气得分明显较高。口感方面,5个样品的得分差异较小,说明得分较高的发酵辣椒品种在辣味、微酸味、咸度及咀嚼难易程度等方面相似的。相比色泽和香气方面,口感得分较低,说明在口感方面仍有较大提升空间,以得到感官品质更好的产品。
由图4可知,5个样品在色泽和香气得分存在较大的差异,2号样品色泽及6号的香气得分明显较高。口感方面,5个样品的得分差异较小,说明得分较高的发酵辣椒品种在辣味、微酸味、咸度及咀嚼难易程度等方面相似的。相比色泽和香气方面,口感得分较低,说明在口感方面仍有较大提升空间。

表7 感官评分结果Table 7 Sensory score results

图4 感官分析雷达图Fig.4 The radar map of sensory analysis
3 结论与讨论
本文采用HPLC苯甲酰氯柱前衍生梯度洗脱测定发酵辣椒中的8种生物胺,梯度洗脱方法能使生物胺在25 min内达到完全分离。测定结果显示,样品生物胺总量在3.281~398.831 mg/kg。作为一种日常生活中食用的调味品,生物胺总量少,且毒性较强的组胺含量较低,以普通食物中的生物胺限定标准作为参照,每日从发酵辣椒中摄入的生物胺含量都低于限定标准,安全性良好。
不同种类发酵辣椒生物胺总量存在显著性差异,所有样品中均含有酪胺,糟辣椒的酪胺含量明显高于其他种类发酵辣椒,大部分泡椒的生物胺含量均较低。本研究发现,大多数样品中酪胺、腐胺、尸胺、组胺含量占总量绝大部分,但有5个样品中色胺或2-苯乙胺含量占绝大部分。谭李红等[18]的研究均发现乳酸菌混合发酵在适宜条件下能够抑制色胺的积累;韦宗卉等[19]研究发现乳酸菌发酵可降低辣椒酱中色胺和腐胺的含量,并推测色胺含量较高的产品可能是添加了生物胺含量较高的水产调味品。KALAC等[20-21]研究泡菜在储藏过程中的生物胺变化,发现发酵泡菜中的微生物产生了大量的生物胺,尤其是腐胺及酪胺含量最高,历经4~6个月贮藏甚至可达到200~300 mg/kg,但未检测到组胺及色胺;邢茜等[22]检测了市售泡菜中8种生物胺的含量,生物胺总量在39.38~628.82 mg/kg,除一个样品中未检测到色胺外,其余产品均含有8种生物胺,与本文结果有一定差异,原因可能是受原料本身及发酵程度的影响。生物胺的产生是多个因素共同影响的结果,发酵的温度、pH、盐度、原辅料、微生物、发酵时间等都会影响其浓度的高低。因此未来需进一步对发酵辣椒的生产工艺进行标准化,采取有效措施确保产品的安全及质量。
品质方面,还原糖、总酸、氨基酸态氮含量在各个样品间均有一定差异,可能与制作原料品种本身有关。研究表明,生物胺的产生与一些理化指标有一定的相关性,本研究中还原糖、总酸、氨基酸态氮含量与生物胺含量之间未发现较强相关性。其中氨基酸态氮提供了生物胺形成的前体,但高氨基酸也不一定总是导致高生物胺含量,LORENZO等[23]在葡萄酒中外加组氨酸、酪氨酸、苯丙氨酸、色氨酸,发现酒中的生物胺含量比未外加氨基酸的样品低。目前研究认为氨基酸态氮之间可能存在一定联系,尚待进一步研究。
