色胺酮合成方法研究
2017-03-21陈芳林
陈芳林
色胺酮合成方法研究
陈芳林
(温州大学 化学与材料工程学院,浙江 温州 325035)
阐述了色胺酮及其衍生物的合成方法。色胺酮广泛存在于植物中,由于色胺酮及其衍生物具有良好的抗癌、杀菌和消炎药用活性,回顾梳理色胺酮及其衍生物的合成方法是十分必要的。
色胺酮;衍生物;吲哚醌;吲哚酮;靛红酸酐;合成
含氮杂环化合物在天然的产物中广泛存在,是一类具有良好生物活性的杂环化合物[1],具有高度医用、药用价值,其中含氮杂环化合物色胺酮是喹唑啉酮衍生物中的一种,在青黛、大青叶、马蓝、蓼和菘蓝等植物中广泛存在。色胺酮具有突出的药用价值,且毒副作用小,在临床治疗药物中具有十分广阔的应用前景,具有抗炎[2]、抗肿瘤[3-5]、调节免疫[6]的活性,尤其对疟疾、利什曼原虫肺结核病菌有良好的药物活性[7-10],因此研究该类化合物、梳理合成思路具有十分重大的意义。
1915年Friedlander 等[11]用高锰酸钾水溶液催化氧化靛红得到色胺酮, 但产率极低,无任何实际意义(Scheme 1)。

Zeide等[12]用2-氯苯甲酸、2-氨基喹啉作为底物, 反应生成中间体后在CrO3氧化下得到色胺酮。该方法操作简单,可用于合成色胺酮及其衍生物(Scheme 2)。
1971年Schindler[ 13]从用色胺酸培养的解脂假丝酵母的代谢物中分离提纯得到了色胺酮。Honda等[ 14 -17]先后从马蓝和蓼蓝这两种植物中分离提纯得到了色胺酮, 1998年Takharu等[ 18]也从蓼蓝中提取出了色胺酮。我国科学家阮金兰[ 19],李彬[ 20]等先后从大青叶的乙醇溶解物中、菘蓝根的乙酸乙酯解物中提纯得到色胺酮。
Lygin[21]等人用溴苯腈和苯甲脂取代物作为原料,用叔丁基锂在零下78℃,于四氢呋喃中得到色胺酮(Scheme 3)。

绝大多数文献报道的合成方法基本都是用靛红作起始原料[22],再和其它原料反应生成色胺酮。合成色胺酮及其衍生物最有效、最常用的实验方法是靛红和靛红酸酐在三乙胺催化下甲苯溶剂中回流若干小时,产率达75 %~95 % (Scheme 4)。
2013年Chen Wang[23]报道的最新一篇色胺酮的合成方法是以吲哚为原料合成色胺酮,其实是以靛红为原料合成方法的向前一步延生,在合成上并无太大突破(Scheme 5)。
2015年Mahmoud等[24]利用Co作为催化剂,用靛红酸酐及靛红作为反应底物,得到色胺酮及其衍生物。该反应能得到较多色胺酮的衍生物,且其底物易得,操作简单,反应条件温和时间较短。使用水作为溶剂对环境友好,污染小。然而催化剂合成十分繁琐(Scheme 6)。

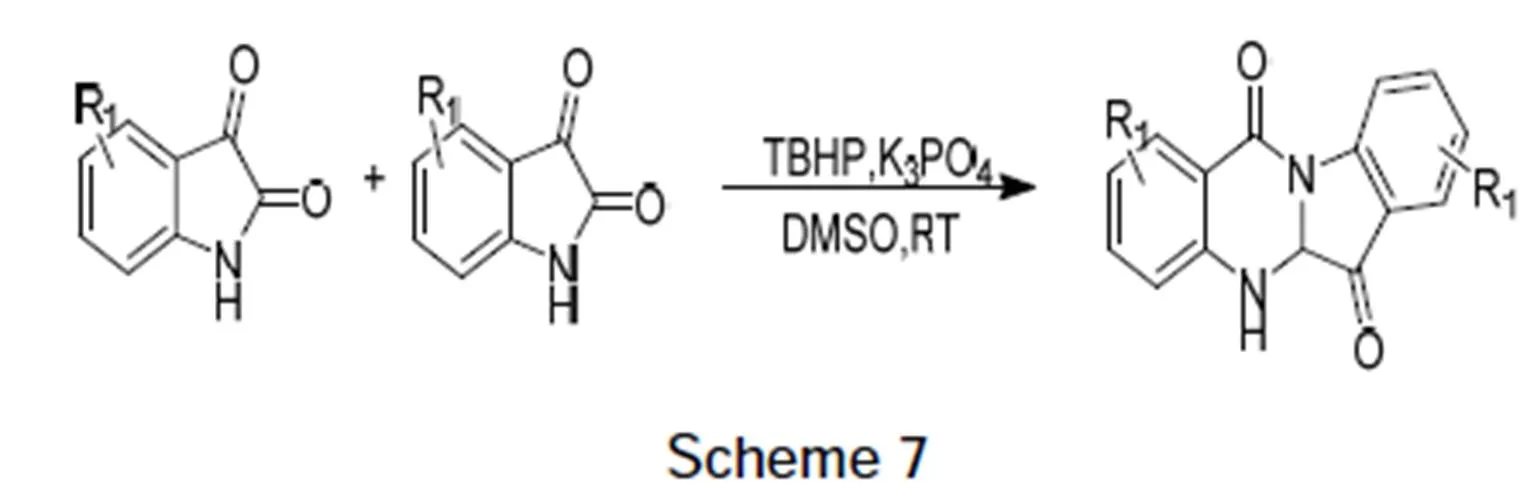
2016年Feng-cheng Jia等[25]利用靛红在叔丁基过氧化氢催化下,在室温二甲基亚砜溶液中二聚生成了色胺酮。该方法底物来源广,使色胺酮衍生物易得,但从反应机理来看还是经过靛红酸酐的中间状态后得到色胺酮(Scheme 7)。
纵观色胺酮及其衍生物的合成方法,我们不难发现文献报导的色胺酮合成方法,无论是最初还是近两年,都是以靛红和靛红酸酐为最初底物,合成方法上并无任何突破,希望今后色胺酮的合成有完全创新的方法,底物不仅仅拘泥于靛红及靛红酸酐。色胺酮合成最常用的方法,是以靛红和靛红酸酐为底物,在三乙胺催化下甲苯溶液中回流制得色胺酮,此方法不仅操作简单产率高,且反应条件十分温和,能用于合成色胺酮及其衍生物,且原料来源广泛。近年来国内色胺酮相关的合成文献相继发表, 也有从天然植物中提取色胺酮的文献。
从合成色胺酮合成原料来看, 靛红、靛红酸酐及其衍生物国内均有批量生产, 基于色胺酮及其衍生物具有良好的抗癌、消炎以及杀菌的活性, 且毒副作用较小, 该类化合物未来一定会拥有良好的应用前景。
此外, 通过对色胺酮衍生物的筛选, 有希望得到副作用小、安全性高的新型抗癌药物。因此, 对此类天然物合成方法加以重视和研究非常必要。
[1] (a) Crowley, P. J. In CoMp:rehensive Heterocyclic Chemistry; Katritzky, A. R., Rees, C.W., Eds.; Pergamon: New York, NY, 1984; (b) Xiao, X.; Antony, S.; Pommier, Y. et al. Total Synthesis and biological evaluation of 22-hydroxyacuminatine [J]. J. Med. Chem. 2006, 49: 1408−1412.
[2] Takel, Y.; Kunikata, T.; Aga, M.; Inoue, S.; Ushio, S.; Iwaki, K.; Ikeda, M.; Kurimoto, M.. 2003, 26, 365.
[3] Sharma, V. M.; Prasanna, P.; Seshu, K. V. A.; Renuka, B.; Rao, C.V. L.; Kumar, G. S.; Narasimhulu, C. P.; Babu, P. A.; Puranik, R. C.;Subramanyam, D.; Venkateswarlu, A.; Rajagopal, S.; Kumar, K. B.S.; Rao, C. S.; Mamidi, N. V. S. R.; Deevi, D. S.; Ajaykumar, R.;Rajagopalan, R.. 2002, 12(17), 2303.
[4] Yu, S. T.; Chern, J. W.; Chen, T. M.; Chiu, Y. F.; Chen, H. T.; Chen,Y. H.. 2010, 31, 259.
[5] Pathnia, A. S.; Kumar, S.; Guru, S. K.; Bhushan, S.; Sharma, P. R.;Aithagani, S. K.; Singh, P. P.; Vishwakarma, R. A.; Kumar, A.; Malik, F.,2014, 9, e110411.
[6] Pergola, C.; Jazzar, B.; Rossi, A.; Northoff, H.; Hamburger, M.; Sautebin, L.; Werz, O.. 2012, 165, 765.
[7] A K Bhattacharjee , M G Hartell , D A Nichols et al.Eur .J .Med .Chem ., 2004, 39 :59-67.
[8] L A Mitscher , W Baker .Med .Res .Rev ., 1998 , 18(6):363-374.
[9] K B Apurba , J S David , J Barton .Bioorg .Med .Chem ., 2002 , 10 :1979-1989 .
[10] 高婷, 孙启玲, 罗强.中国生化药物杂志, 2004 , 25(1):48-50.
[11] Friedlander, N.; Roschdestwensky, P.1915,, 1841.
[12] A Witt , J Bergman .Current Org.Chem ., 2003, 7 :659-677.
[13] F Schindler , H Zahner .Arch Mikrobiol , 1971 , 79 :187-203.
[14] G Honda, M Tabata .Planta Medi ca, 1979 , 36 :85-86.
[15] H Aga, S Arai , S Fukuda et al .USP :6 524 625, 2003.
[16] G Honda,V Tosirisuk, M Tabata.Planta Medica,1980, 38 (3):275-276.
[17] A V Muruganandam , S K Bhattacharya.Indian J .Chem ., Sect.B:Org .Chem .Incl.Med .Chem ., 2000, 39B(2):125-131.
[18] H Takaharu, A Hajime , C Hiroto et al.Nat.Med ., 1999, 53(1):27-31 .
[19] 阮金兰, 邹建华, 蔡亚玲.中国中药杂志, 2005 , 30(19):1525-1526 .
[20] 李彬,陈万生, 郑水庆等.药学学报, 2000 , 35(7):508-510.
[21] Lygin,A.V,de Meijere,A2009.11.389-392.
[22]Yu,ST Chern,JW Chen,Y.H.,2010,31,259-264
[23] Chen Wang, Lianpeng Zhang, Anni Ren, Ping Lu,, 2013,12, 2982-2985.
[24] Mahmoud Abd El Aleem Ali Ali El-Remaily , O. M. Elhady, Tetrahedron Letters, 2016, 57: 435-437.
[25] Feng-Cheng Jia, Zhi-Wen Zhou, Cheng Xu, Yan-Dong Wu, and An-Xin Wu,. 2016, 18, 2942−2945.
Research on Synthesis Methods of Tryptanthrin
(School of Chemistry and Materials Engineering, Wenzhou University, Zhejiang Wenzhou 325035, China)
Synthesis methods of tryptanthrin and its derivatives were described. It is very necessary to review the synthetic methods of tryptanthrin and its derivatives because of good anticancer, antibacterial and anti-inflammatory activities.
tryptanthrin; derivatives ;isatin ;indolone ;isatoic anhydride ; synthesis
TQ 201
A
1004-0935(2017)04-0387-02
2017-02-18
陈芳林(1990-),女,甘肃省天水市人,在读硕士,就读于温州大学金属有机催化合成专业。
