肉制品中酪胺检测方法及其控制技术的研究进展
2020-12-09包璐莹谢艳英黄志博夏秀芳
包璐莹,谢艳英,黄志博,夏秀芳
(东北农业大学食品学院,黑龙江哈尔滨 150030)
酪胺(tyramine,Tyr)又称4-羟基苯乙胺,分子式为C8H11NO,属于芳香族生物胺,分子量为137.2,是一种低分子量的单胺[1],具有热稳定性,无法通过热处理灭活[2]。它广泛存在于各种食品中,如李子[3]、鱼及鱼制品[4]和肉及肉制品[5]等。在人体中也存在少量酪胺,因肠道内存在可以降解酪胺的单胺氧化酶[6],所以处于低浓度水平的酪胺不会对人体造成危害。但在肉制品尤其是发酵肉制品的发酵和成熟过程中或腌制、熏制的鱼肉中,由于微生物的作用或贮藏条件不当,酪胺会逐渐积累至对人体有害的浓度[7]。目前,欧盟没有明确规定食品中酪胺的安全阈值,但是美国的食品药品监督局(Food and Drug Administration,FDA)已规定鱼中酪胺含量不得超过100 mg/kg[8],Brink等[9]也建议食品中酪胺的最大浓度不应超过800 mg/kg。酪胺与食品卫生安全密切相关。它可作为间接的细菌指标之一[10],与肉制品腐败相关的生物胺的浓度加和后用于评估肉质的指标即生物胺指数[11](biogenic amines index,BAI),Hernndez-Jover等[12]利用酪胺、组胺、腐胺和尸胺四种生物胺的浓度加和得到该指数,并提出若BAI<5 mg/kg,说明肉质新鲜;若BAI在5~20 mg/kg范围内,说明肉开始腐败但仍可接受;若BAI在20~50 mg/kg范围内,说明肉质低下;若BAI>50 mg/kg,说明肉已经腐败。
鉴于酪胺在食品中存在的广泛性及其对人体健康的潜在危害,人们相继开发了大量的方法对肉制品中的酪胺进行纯化、定量和控制。检测产酪胺菌的传统微生物法周期长、灵敏度低、操作复杂[13]。检测产酪胺菌功能基因的聚合酶链式反应,若扩增引物和扩增条件选择不当,会导致扩增效果差从而影响准确性[14]。而且微生物代谢复杂,在培养过程中容易产生酸性或碱性物质,造成假阴性或假阳性结果[13]。与微生物检测产酪胺菌方法相比,检测酪胺含量的方法更加准确和简单。为保证酪胺不会对人体产生危害,除了对其进行检测外还需控制其产生和积累。控制肉制品中游离氨基酸含量会对其风味产生影响[15],故人们对于酪胺的控制主要集中在破坏肉制品中酪氨酸脱羧酶和单胺氧化酶的平衡及抑制产酪胺菌的生长。
本文综述了肉制品中酪胺的检测方法所需样品前处理的优缺点和各检测方法的特点及肉制品在加工前、加工时和贮藏时应用到的控制技术,为肉制品中酪胺研究提供参考。
1 肉制品中酪胺对人体的生理和毒理作用
酪胺作为一种非挥发性的低分子量含氮有机物,对人体可以产生不同的生理和毒理作用。人体摄入酪胺后,酪胺主要存在于大脑、胃和肠道中,其生理作用表现在可以作为神经递质[16]、使外周血管收缩[17]、增强呼吸作用[18]、使血压升高[19]等。它可以在人的正常代谢活动中降解,其降解机制如图1(a)所示,人体中降解酪胺的酶主要是单胺氧化酶(monoamine oxidase,MAO),包括单胺氧化酶A(monoamine-A,MAO-A)和单胺氧化酶B(monoamine-B,MAO-B)两种同工酶。MAO-A主要负责胃和肠道中酪胺的降解,以阻止全身吸收酪胺;而MAO-B负责大脑中酪胺的降解[20-21]。


图1 人体中酪胺降解机制与毒性

图2 胃腔中C-亚硝化酪胺形成机制及毒性
2 肉制品中酪胺的检测方法及特点
2.1 酪胺的提取、富集与净化
因样品基质复杂且酪胺属痕量物质,故为了获得准确的检测结果,要对样品进行预处理。一是酪胺的提取,使半固体的肉样转化为液体以便进一步分析。二是酪胺的富集与净化,以从上述提取液中去除干扰物并浓缩酪胺,操作步骤如图3所示。

图3 固相萃取、液-液萃取和顶空固相微萃取步骤
肉及肉制品常用酸性溶剂三氯乙酸或高氯酸提取酪胺[27],但在液相色谱-质谱法检测酪胺时,这些氯化萃取剂很容易停留在离子通道内,在负离子检测模式下造成离子抑制,利用5-磺基水杨酸作为提取剂可解决这一问题[28]。传统的富集与净化方法包括固相萃取(solid phase extraction,SPE)和液-液萃取(liquid-liquid phase extraction,LLE),但由于它们耗时、萃取效率低、试剂消耗量大且成本高,现已发展出了顶空固相微萃取(head space solid phase microextraction,HS-SPME)和分散液-液微萃取(dispersive liquid-liquid phase microextraction,DLLME),它们分别是固相萃取和液-液萃取的小型化模式,仅需少量的固体吸附剂和化学试剂就能实现样品中酪胺的富集与净化,而液相微萃取因其具有分析物从水相到萃取相的转移速度快、萃取效率高且稳定和成本低的优点,应用较固相微萃取更广泛[29]。
其中DLLME通过加入分散剂可实现酪胺在水相与萃取相之间的快速转移[30],也可以利用超声辅助萃取使样品提取液与萃取相充分接触并分散在水相中以提高酪胺的萃取效率[31],且DLLME能增加酪胺的挥发性,有利于使用气相色谱法检测酪胺[32],但DLLME中常用的萃取试剂卤代烃有毒,不环保,现已有采用磁性离子液体如3-己基-14-烷基膦(Ⅱ)作为萃取试剂的方法[33]。各富集与净化方法及其优缺点见表1。

表1 酪胺的富集与净化方法及优缺点比较
2.2 常规联用检测方法及特点
在联用检测方法中,样品经预处理后即可进行酪胺与样品基质中其它物质的分离。由于色谱仪器具有良好的分离与检测能力,常用于酪胺的定性检测,包括液相色谱法[39]、气相色谱法[32]和毛细管电色谱法[40]。而高效液相色谱法(high performance liquid chromatography,HPLC)由于其具有选择性好、灵敏度高、通用性强的优点,现已成为最普遍的酪胺色谱分离方法。
为了提高酪胺检测的准确性并考虑到待测样品的特点,这些分离方法还需进一步与不同的检测器如荧光检测器(fluorescence detector,FL)、紫外检测器(ultraviolet detector,UV)、质谱仪和激光诱导检测器(laser induced fluorescence,LIF)联用。因酪胺不具有荧光发色基团和紫外吸收基团且极性大,故在进行荧光检测和紫外检测前,常用丹磺酰氯[5](dansyl chloride)、苯甲酰氯[4](benzoyl chloride)和达比氯[41](dabsyl chloride)对样品进行衍生化处理,使酪胺的氨基与衍生试剂发生反应转化为带有发色和吸收基团的衍生产物,这些常用衍生试剂与酪胺发生的衍生反应如图4所示[42-44]。衍生化处理在质谱检测中不是必需步骤,但进行衍生化处理,能够增强酪胺的保留,提高电离效率和灵敏度。He[45]合成了一种新型且灵敏的衍生试剂4-羰基氯玫瑰胺,可作为质谱检测中的衍生化试剂。
2.2.1 与紫外检测器联用的检测方法 若预处理后样品中杂质的紫外吸收值低,常与紫外检测器联用进行检测。紫外检测器原理是基于Lambert-Beer定律,通过衍生后酪胺的紫外吸收强度计算其浓度。Cao等[33]选用紫外吸收值低的磁性液体3-己基-14-烷基膦(Ⅱ)作为DLLME的萃取剂,对鱼样中酪胺进行萃取和预浓缩后,结合HPLC-UV法对酪胺含量进行测定,LOD为1.6 μg/kg,回收率在94.8%~97.9%范围内。此类检测方法需衍生化但预处理操作简单,灵敏度高。
2.2.2 与荧光检测器联用的检测方法 荧光检测器的工作原理是用紫外线照射化合物时,化合物可受激发而发出荧光,测定发出的荧光能量即可对此化合物定量。因此,决定荧光检测器灵敏度的一个重要因素就是荧光激发波长和发射波长的选择,对于不同的目标分析物要选择不同的激发波长及发射波长。Donthuan等[46]设定荧光激发波长为270 nm,发射波长为315 nm,对9-芴甲基氯甲酸酯衍生后经超声辅助分散液-液微萃取处理的酪胺含量进行测定,LOD为0.02 ng/mL。Li等[47]设定荧光激发波长为270 nm,发射波长为430 nm,采用HPLC-FL法对乙基吖啶磺酰氯荧光标记的酪胺含量进行测定,LOD为0.38 ng/mL,无需富集与净化即可准确测定酪胺含量。
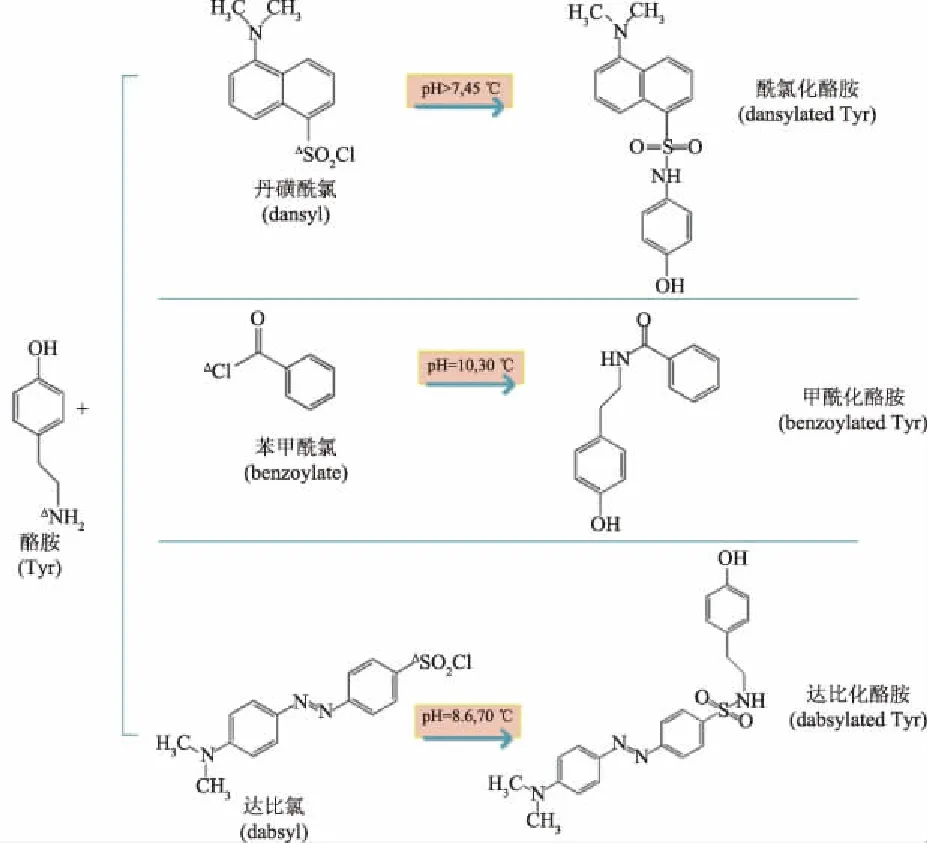
图4 常用衍生剂与酪胺的衍生反应
2.2.3 与质谱仪联用的检测方法 液相色谱[35]和气相色谱[32]常与质谱仪联用检测酪胺。Ochi等[35]用离子对固相萃取法萃取腌鲭鱼片中的酪胺后,采用超高效液相色谱法与三重四极杆质谱仪联用对酪胺含量进行测定,LOD为0.02 mg/kg,回收率在90.6%~91.9%范围内。Wojnowski等[32]选用甲醇作为DLLME的分散试剂对肉样进行富集与净化处理,增加了酪胺的挥发性,便于采用气相色谱-质谱法进行酪胺测定,LOD为0.007 mg/kg,回收率为87%。色谱串联质谱检测无需衍生化,预处理简单,取代了许多复杂耗时的检测方法,具有快速、准确度和灵敏度高的优点。
2.2.4 与激光诱导检测器联用的检测方法 毛细管电色谱法(capillary electrochromatography,CEC)是集毛细管电泳分离的高效率和液相色谱分离的强选择性为一体的微型分离方法[48],常与激光诱导检测器联用。张冰宇等[49]建立了柱前衍生毛细管电色谱与激光诱导检测器联用法,成功应用于鸡肉肠中酪胺含量的测定,该方法LOD为0.4 μg/L。此方法具有化学试剂用量少,成本相对低,分析用时短的优点,但与传统分离方法相比,其缺点为灵敏度较低,毛细管填充柱损耗快且不够稳定。
2.3 新型检测方法及特点
2.3.1 电化学生物传感器 电化学生物传感器是通过测量生物传感器表面酶法所生成物质的化学还原相关的安培信号的衰减,从而计算出样品中酪胺浓度[50],无需进行富集、净化及衍生化处理,操作简便。Apetrei等[50]开发了一种电流型酪氨酸氧化酶生物传感器,LOD为0.62 μmol/L,并成功用于腌制和熏制鱼制品中酪胺含量的检测。屠青霞[51]制备了固相电化学发光传感器用于酪胺的检测,得到LOD为0.064 μmol/L,并成功用于四种鱼中酪胺含量的检测。与传统检测方法相比,电化学生物传感器为酪胺的实时在线分析提供了简单、快速且经济的检测方法,但缺点为无法排除基质中其它化合物的干扰。
2.3.2 方波伏安法 方波伏安法是利用同时向工作电极叠加特定的电信号及电压后产生的振幅曲线,通过在一个周期时间内对电流两次取样从而测定待测物质的电化学分析方法[52]。Henao-Escobar等[53]选用掺硼金刚石电极作为工作电极,用6种不同的有机试剂对火腿中的酪胺进行提取,采用方波伏安法对有机提取液中的酪胺含量进行测定,并将此方法检测结果的平均值与传统的HPLC法测定结果的平均值进行t检验,发现两种方法测得酪胺含量的均值相差不大,说明伏安法可准确地测定火腿中酪胺含量。此方法准确度高,样品前处理简单,掺硼金刚石电极具有环保、导电性好、电化学窗口宽、背景电流低、物理和化学稳定性高且抗腐蚀的优点,伏安法可考虑作为酪胺传统检测方法的替代方法。
2.3.3 离子迁移率谱法 离子迁移率谱法(ion mobility spectrometry,IMS)是一种在均匀电场的作用下,根据气态分析物离子通过气体氛围的迁移率不同从而将其分离的分析方法[54]。Parchami等[37]采用离子迁移率谱法对罐装鱼制品中酪胺含量进行测定,通过使用18-冠醚-6作为气相修饰剂以解决离子迁移率谱出现重叠峰的问题,发现生物胺相对标准偏差为5.7%~6.3%,且测定结果与GC-MS法测定结果相差不多。该方法灵敏度高,无需衍生化处理,操作简便。
2.3.4 分子印迹聚合物 将分子印迹聚合物用作SPE法的吸附剂,可实现对目标分析物高度专一地识别[55]。Zhang等[36]通过将共价有机骨架接枝到量子点上合成了一种分子印迹聚合物,该量子点的部分氨基可与酪胺非共价结合,将此分子印迹聚合物作为吸附剂,利用该吸附剂与酪胺结合会发生荧光猝灭的特性,采用光感法对肉末样品中的酪胺进行测定,LOD为7.0 μg/kg,此方法成功地应用于猪肉和鸡肉香肠、猪肉和鸡肉火腿、培根、熏猪肉和意大利发酵香肠中酪胺含量的测定,测定结果与SPE-HPLC法测定得到的结果相近。分子印迹聚合物具有构效可预测、对目标分析物可高度专一性识别、化学性质稳定及普适的优点,但缺点为传质速度慢且不够稳定。
3 肉制品中酪胺的形成及其控制技术
3.1 肉制品中酪胺的形成过程
肉制品中产酪胺菌产生酪氨酸脱羧酶(tyrosine decarboxylase,TDC),在酶的作用下游离酪氨酸发生脱羧反应生成酪胺[56],或在酸性条件下游离酪氨酸与脂质氧化产物发生反应生成酪胺[57]。酪胺检测完成后,为保证酪胺含量不会达到对人体产生危害的阈值,需根据肉制品所处阶段及两种酪胺形成途径,对肉制品中的酪胺含量进行控制。
3.2 加工前保证原料肉的质量
3.2.1 涂层的选择 选择涂层的原则是尽量抑制原料肉中微生物的生长,复合涂层比单一涂层的控制效果好。如将表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)与明胶生物膜交联后使膜更加坚硬致密,且具有更高的抗菌性[58]。Cao等[59]将EGCG的优良抗菌特性与明胶可保护鱼的微结构、维持其肌纤维的稳定性从而显著降低其变质几率的特性相结合,研究发现分别用明胶、EGCG和EGCG-明胶处理液处理后的鱼片,在4 ℃下真空包装贮存21 d过程中,每三天测定鱼片中酪胺含量,经EGCG-明胶处理液处理的鱼片中酪胺含量最低。Zhao等[60]采用鱼胶和葡萄籽提取物复合涂层处理罗非鱼鱼片,既解决了鱼胶抗菌性不足的缺点,又控制了酪胺含量的增加速率。
3.2.2 添加剂的使用 为控制原料肉中酪胺含量,可使用不同的添加剂,包括防腐剂如根皮素[61]和氨乙基根皮素[62],保鲜剂如水基壳聚糖[63]和茶多酚-壳聚糖复合液[64],抑菌剂如红花提取物和苦瓜提取物[65]。根皮素能通过抑制产酪胺菌的生长从而延缓贮藏过程中酪胺的形成,但水溶性差是这些天然活性成分在实际应用中的主要缺陷,为解决这一问题,Wei等[62]利用2-溴乙胺和根皮素合成了氨乙基根皮素,该物质不仅溶解度高,且能显著控制贮藏过程中酪胺的积累。水基壳聚糖有低聚壳聚糖和纳米晶须壳聚糖两种主要形态,均能抑制肠杆菌属活性从而抑制酪胺的积累[63]。在茶多酚和壳聚糖分别为3和10 g/L的最佳配比下,该复合液对鮸鱼中的酪胺在4和25 ℃贮藏过程中的积累,具有明显的抑制效果[64]。红花提取物和苦瓜提取物均能有效抑制鱼中产酪胺菌不动杆菌的产酪胺能力[65]。
3.3 加工时发酵剂的选择
3.3.1 不产酪氨酸脱羧酶/具有单胺氧化酶活性的菌株 肉制品中酪氨酸脱羧酶与单胺氧化酶的动态平衡决定着酪胺含量[66],故选择发酵剂的原则为减少酪氨酸脱羧酶含量或增加单胺氧化酶含量。在发酵肉制品的发酵过程中,低pH、低温和高盐环境有利于抑制病原菌生长且有利于风味产生,将在此条件下正常生长且无TDC活性的菌株作为发酵剂,可有效减少酪胺生成。如木糖菌株Sx-3和Sx-8对低pH、低温和高盐表现出了高抗性,且均无TDC活性,可作为发酵鱼制品的发酵剂[67]。另一方面,单胺氧化酶可将肉制品中已生成的酪胺降解为醛类、过氧化氢和氨[68],将具有单胺氧化酶活性的菌株用作不同肉制品的发酵剂可有效减少酪胺积累。翟钰佳[66]从传统发酵的肉肠中分离筛选出具有单胺氧化酶活性的植物乳杆菌X22-2,用作羊肉发酵香肠的发酵剂可显著抑制酪胺积累。
3.3.2 抑制产酪胺菌活性的菌株 除破坏发酵肉制品中TDC与单胺氧化酶之间的平衡外,还可选择抑制产酪胺菌活性的菌株作为发酵剂以控制酪胺含量,其原因是这类菌株在发酵过程中的代谢产物如有机酸、过氧化氢和细菌素能降低体系pH,抑制产酪胺菌的生长[69]。乳酸菌CECT5764、金黄色葡萄球菌SA25和嗜酸乳杆菌CECT903组成的混合发酵剂可降低达契亚香肠中酪胺含量,与未加入发酵剂的成品相比,酪胺含量降低了50%以上[70]。乳酸乳球菌KTH0-1S可产细菌素,与粪肠球菌D0KS13竞争营养物质从而抑制其生长,可作为泰国发酵虾宫尾虾的发酵剂,与未使用该发酵剂的成品相比,酪胺积累量减少了31%[71]。
3.4 加工时添加剂的选择
对不同肉制品来说,添加剂的种类和用量对其酪胺含量的控制效果不同。葡萄酒能增加干发酵香肠的香气并抑制酪胺的积累,当其在意大利腊肠中添加量为7.5%时,发酵60 d后,酪胺最终积累量减少了3.53 mg/kg[72]。绿茶多酚(Green tea polyphenols,GTP)是肉制品中常用的天然抗氧化剂,添加GTP的干腌培根经过12 d成熟后,酪胺含量比未添加GTP的干腌培根减少了50.6%[73]。此外,发酵剂与植物提取物如生姜精油的协同作用也能有效抑制酪胺积累[74]。
3.5 贮藏时酪胺的控制
贮藏过程中酪胺的产生与脂质氧化和贮藏条件密切相关。脂质氧化物的存在会使酪氨酸发生脱羧反应生成酪胺[57],因此常采用聚乙烯薄膜、玻璃罐或金属罐使肉制品处于真空状态的方法减少脂质氧化。贮藏条件如温度、pH等会影响产酪胺菌的生长从而影响酪胺含量。雷志方等[75]研究发现温度越低酪胺生成速率越慢。一种由碳酸钙、滑石和二氧化钛结合而成,并在表面涂上高密度聚乙烯树脂的新型材料OVTENE@可实现对pH的控制,从而控制酪胺含量,使用这种材料在真空条件下贮藏的意大利腊肠,15个月后腊肠中酪胺含量比同等条件下使用玻璃罐贮藏相同时间的意大利腊肠的酪胺含量减少了60%[76],且该材料的合成无需水、树木和胶料,100%可循环再造,可分解或生物降解[77],是一种能有效控制贮藏期间肉制品中酪胺含量的环保包装材料。
4 展望
酪胺的常规检测方法主要集中在HPLC/RP-HPLC与不同的检测器联用,但此方法前处理复杂,与紫外检测器和荧光检测器联用检测时还需进行衍生化,耗时且成本高。新型检测技术虽然具有前处理简单甚至无需进行前处理、准确度和选择性高的优点,但研究还不成熟,因此无法广泛应用。如何建立操作简单、环保、准确度高且成本低的酪胺检测方法是未来需要解决的问题。
肉及肉制品中的酪胺因其浓度不同而对人体产生影响不同的特殊性,对其进行检测和控制就会成为消费者最关注的问题。加工前对原料肉中酪胺的控制技术以物理技术如涂层和化学技术如使用添加剂为主,加工时对酪胺的控制技术以生物技术如使用无TDC活性的菌株做发酵剂为主,贮藏时对肉制品中酪胺的控制技术以物理技术为主。但酪胺的产生与积累是一个受到多种因素及其相互作用影响的复杂的过程,因素组合的多样性和易变性及肉制品种类不同也会影响酪胺的生成和积累程度,因此根据实际情况采用有效的复合防控技术对原料肉及肉制品中的酪胺进行控制是未来的研究方向。
