天然产物色胺酮的研究进展
2023-11-29张定堃
廖 维,宋 娇,韩 丽,张定堃
成都中医药大学药学院 西南特色中药资源国家重点实验室,成都 611137
色胺酮(见图1),化学名为吲哚[2,1-b]喹唑啉-6,12-二酮(分子式C15H8N2O2),常温下呈黄色针状结晶。色胺酮属于吲哚喹唑啉类生物碱,是传统抗病毒中药板蓝根和解热中药青黛及其药用植物马蓝、菘蓝、蓼蓝等的主要成分之一,某些微生物的代谢产物中也能检测到[1-4]。现代药理学研究表明色胺酮具有抗肿瘤、抗菌、抗炎、抗病毒、保护心血管等多种药理活性[5]。色胺酮在肿瘤治疗、细菌感染、炎症损伤、病毒侵害等方面展现出的较高药用价值,使之成为众多学者关注的焦点。细胞毒性试验与小鼠毒性试验均证实其安全性较好[6-8]。本综述对色胺酮的相关文献进行系统梳理,综合分析了色胺酮的来源、药理作用、药动学特征、毒性等方面的研究进展情况,旨在为色胺酮作用机制的深入研究提供更多最新、最全面的信息,最终为临床上色胺酮类药物的开发提供新的思路。
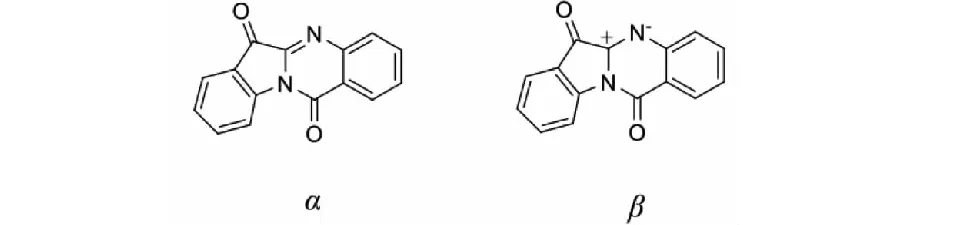
图1 色胺酮的两种构型Fig.1 Two conformations of tryptanthrin
1 色胺酮的来源
1.1 天然植物来源及其生物合成前体
色胺酮的发现不同于一般天然产物。大多天然产物是先从植物中分离出来,而后对其进行药理与合成方面的研究。而色胺酮的人工合成比发现它是一种天然产物早了半个世纪,但产率极低,致使这个具有良好药理活性的小分子化合物在很长时间内无人问津[9]。1997年,Masayuki等[10,11]从两种兰科植物Calanthediscolor和C.liukiuensis中分离出了一种糖苷(calanthoside)并发现其酶水解的主要产物是色胺酮。除菘蓝、蓼蓝、马蓝等药用植物外(色胺酮含量分别为0.003%、0.006%、0.001%)[3,4],中药青黛中也含有色胺酮(0.01%~0.006 5%)[1,2]。此外,色胺酮的含量受产地、采收时间及处理方式等因素的影响。以中国福建省为例,12批不同产地的马蓝中,产于南靖和溪的马蓝茎、叶中色胺酮总含量最高(244.56 μg/g)[12]。对不同生长时期板蓝(Baphicacanthuscusia)中色胺酮的含量进行测定,发现色胺酮的含量变化趋势不太稳定,整体看来十月份是其采收的最佳时期[13]。Oberthür等[14]检测了不同方法处理后菘蓝中色胺酮的含量,发现40 ℃烘干叶片中色胺酮含量最高(0.18%~0.33%),冷冻干燥叶片中的含量最低(0.034%~0.055%),其次是室温干燥叶片(0.06%~0.207%),而经发酵的叶片中色胺酮的含量低于检测限。提示色胺酮的产生是一个后熟过程,干燥和高温可能促进了色胺酮的形成,且该过程是非酶催化的,因为烘干会使酶失活而无催化作用。随后,有研究人员分别用烘干、阴干、冻干三种方法对马蓝进行处理,发现阴干法处理的马蓝根、茎、叶中色胺酮含量相对最高,冻干法处理的色胺酮含量最低[15]。其原因可能是,相对烘干法和冻干法,阴干法干燥温度适中,干燥时间较长,在药材未完全干透之前有利于色胺酮的后熟,致使其含量升高。
随后,有学者探寻了色胺酮在植物体内的生物合成前体。分析色胺酮的结构,其可能是由靛红与邻氨基苯甲酸经脱水缩合而成。为此Wang等[9,16]选取了药用植物菘蓝作为研究对象,来验证猜测的正确性。成分检测发现,新鲜菘蓝叶片中不含色胺酮,但有靛红,叶片经烘干、晾干或研磨处理后靛红消失,色胺酮生成。前体追加实验结果显示,追加靛红或邻氨基苯甲酸或者两者都加均能大幅度提高色胺酮的含量,表明色胺酮与靛红及邻氨基苯甲酸存在生源关系。结合色胺酮和靛红分布实验,可以证实靛红和邻氨基苯甲酸是色胺酮的合成前体,同时也进一步证实了色胺酮的形成是化学催化而非酶催化。此外,关于植物中莽草酸酯和L-Trp生物合成途径的现有知识,以及色胺酮的逆生物合成分析表明,邻氨基苯甲酸和N-甲酰苯胺酸也可能是色胺酮的主要生物合成前体。2018年,Pedras等[17]基于同位素标记化合物中氘的引入,通过HPLC-DAD-ESI-MS对青黛叶片提取物进行分析,并使用ESI-MS光谱的峰值强度确定了各代谢物中掺入同位素的百分比。该同位素标记化合物并入色胺酮的总体实验结果表明,邻氨基苯甲酸和N-甲酰氨基苯甲酸是色胺酮主要的生物合成前体(见图2)。
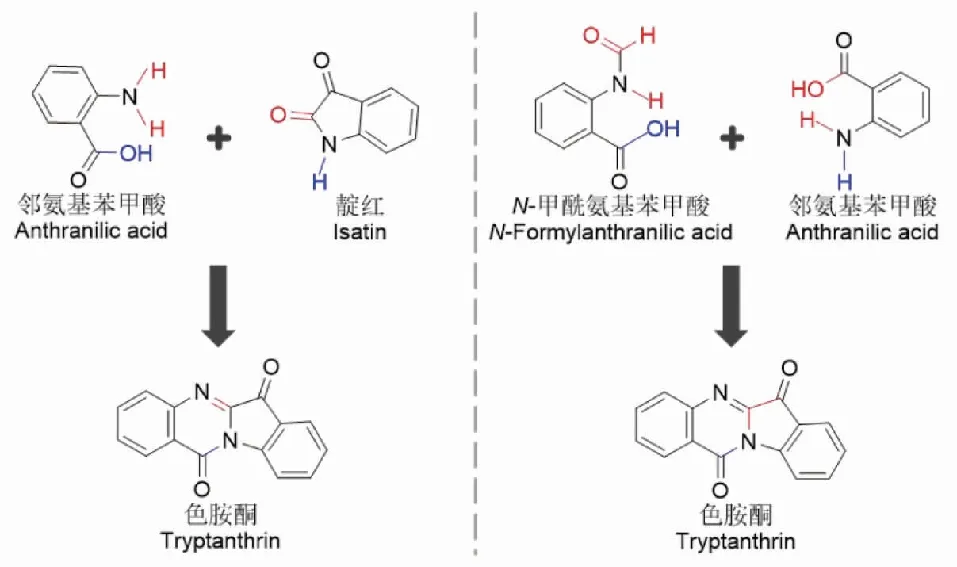
图2 色胺酮的生物合成Fig.2 The biosynthesis of tryptanthrin
1.2 微生物途径
除植物来源外,还能通过微生物发酵的方法获得色胺酮。1971年,Schindler等[18]首次从过量L-色胺酸培养的解脂假丝酵母代谢产物中分离出了色胺酮。此外,担子菌属裂褶菌的发酵液、海洋微生物和大型生物中也能分离得到色胺酮及其衍生物[19]。有学者利用HPLC-DAD和LC-MS结合的方法,从海洋链霉菌Streptomycessp.B9173次级代谢产物中成功分离出了色胺酮[20]。随后,Utkina等[21]从假俭鱼中也分离得到色胺酮的衍生物ophiuroidine 1,这是首个在海洋无脊椎动物中发现的吲哚喹唑啉生物碱的例子,光谱数据确定其结构为4,8,9-三羟基吲哚[2,1-b]喹唑啉-6,12-二酮。微生物代谢产物中色胺酮的发现,可为色胺酮的合成生物学和代谢工程的研究提供新思路,以建立一个强有力的生物合成途径,来满足日益增长的需求。但目前天然产物在微生物宿主中的生物合成仍面临挑战,还需进一步研究,发展更新颖的合成生物学技术,进一步提升色胺酮生物合成的综合效率。
1.3 人工合成
色胺酮在植物和微生物中含量极低,目前市场上主要通过人工合成获得色胺酮,众多合成方法如下[22-28](见图3)。最初是通过靛红自身反应得到色胺酮。阴极还原、高锰酸钾水溶液处理或POCl3处理靛红均能得到色胺酮,但存在产率低、反应条件不够温和等问题[22]。现最常用的方法是以靛红和靛红酸酐为初始底物合成色胺酮。靛红和靛红酸酐可在三乙胺的作用下,直接发生亲核进攻和分子内的缩合脱水反应,以更简洁的步骤得到色胺酮[24]。为提高实用性,Wang等[25]开发了一种新的色胺酮合成路径,先将靛红氧化成靛红酸酐,再将靛红酸酐与靛红在碱性条件下得到目标产物,实现了无需催化剂参与、原子利用率高的合成目标,大大降低了反应成本,具有潜在应用价值。此外,以邻氨基苯甲酸为底物,在二氯亚砜、羟胺和水等作用下,与靛红发生环化也能得到色胺酮,产率可达85%[26]。随后,Jia等[28]以靛红和脒盐作为底物,在室温条件下,发展了一例TBHP/K3PO4协同促进的氧化环化策略,可用于合成喹唑啉酮类衍生物。相同的条件下,在缺少脒盐底物时,靛红极易发生自聚得到天然产物色胺酮,这为色胺酮的绿色合成提供了一条极具利用价值的新途径。
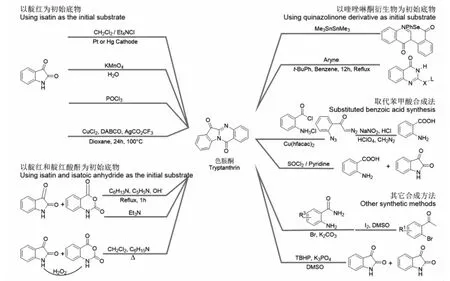
图3 色胺酮的合成途径Fig.3 The synthetic pathway of tryptanthrin
2 药理作用
2.1 抗肿瘤作用
色胺酮类化合物是一种芳香烃受体激动剂,也是一种有效的IDO-1抑制剂,有成为抗肿瘤药物的潜力[29]。天然产物色胺酮低毒性、强抗肿瘤活性的特点使之成为新药开发研究的热点之一,其抗肿瘤的作用机制也不断被发现(见图4)。
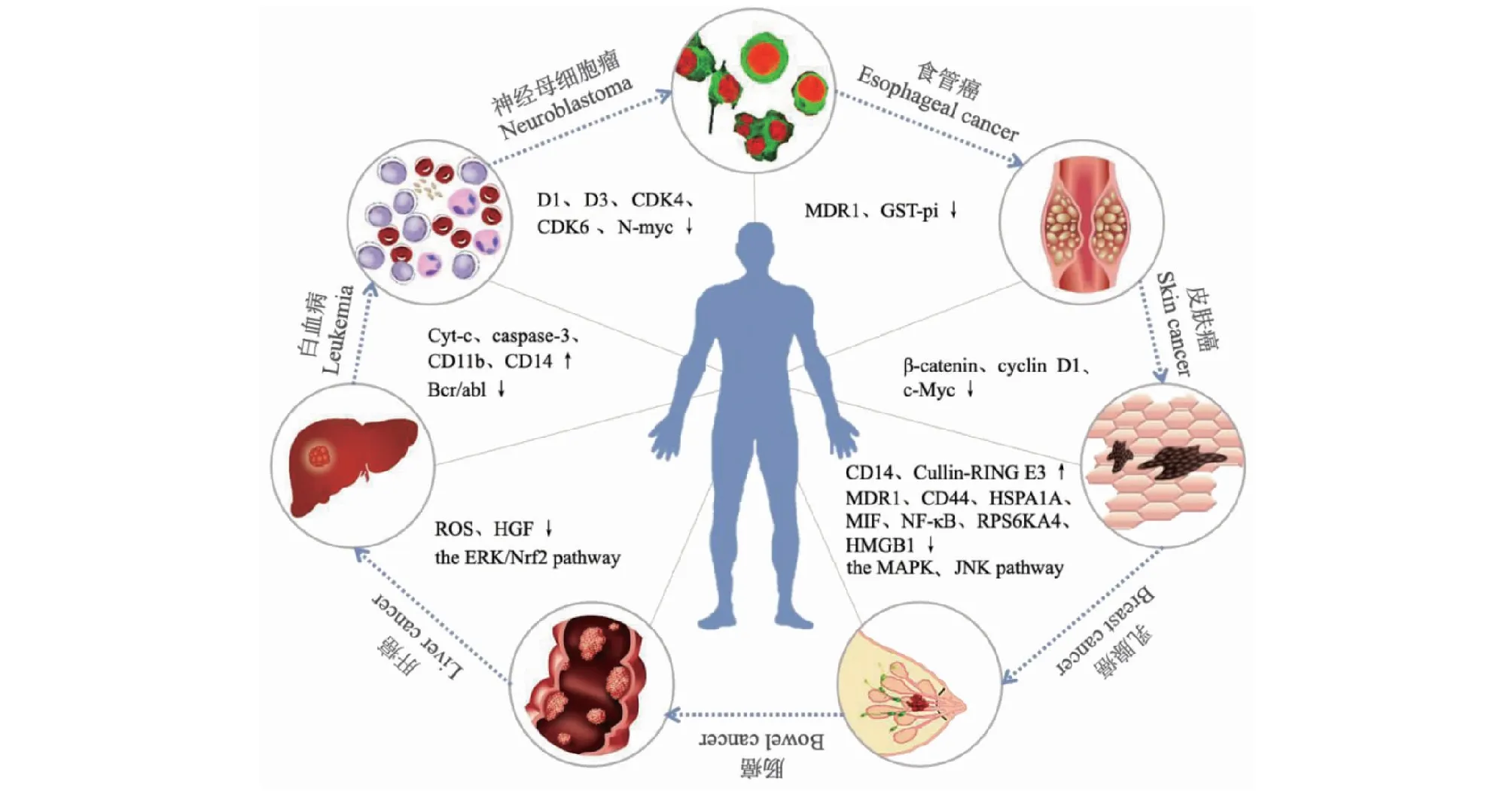
图4 色胺酮的抗肿瘤作用Fig.4 The antitumor effects of tryptanthrin
2.1.1 白血病
青黛,在中国被广泛用于白血病的治疗,色胺酮作为青黛的活性成分也被证实具有抗白血病的作用。研究表明,色胺酮在体外对多种人类白血病细胞有较强的杀伤作用,低浓度的色胺酮(0.5 μg/mL)可诱导人类白血病细胞U-937分化为单核细胞/巨噬细胞,HL-60细胞分化为骨髓细胞/单核细胞,并增强CD11b的表达;高浓度的色胺酮(10 μg/mL)则可能通过caspase-3/Fas抗原途径诱导细胞凋亡[30]。色胺酮在体外对人白血病细胞株K562也具有增殖抑制和诱导凋亡作用,且呈一定的浓度(3.12~50 mg/L)和时间(24~72 h)依赖性。相关分子机制可能是,一方面通过调节Bcl-2、Bax基因及蛋白的表达、降低线粒体跨膜电位、促使Cyt-c释放至胞浆,刺激下游分子caspase-3的活化引起K562细胞发生凋亡;另一方面通过抑制融合基因bcr/abl及蛋白的表达,抑制K562细胞增殖和诱导凋亡。体内实验发现,K562-SCID小鼠口服色胺酮(50 mg/kg)后病理症状得到明显改善,髓组织中异型细胞明显减少,脾脏淤血症状减轻,肝脏、肺、肾脏组织中淋巴细胞明显减少,表明色胺酮对白血病具有治疗作用[31,32]。在同系BALB/c小鼠体内,腹腔注射色胺酮(0.08、0.16 mg/kg)后,小鼠粒单核细胞白血病WEHI-3B JCS细胞的生长得到显著抑制,其作用机制可能与引起细胞周期阻滞和诱导细胞分化有关[33]。
在人类和小鼠白血病细胞系如HL-60、U-937、K-562和WEHI-3B JCS,均证明色胺酮具有类似的抗增殖作用,表明其对白血病细胞的抗增殖作用不是物种或细胞系特异性的。提示色胺酮具有成为一种新的、有效的预防或治疗白血病的先导化合物的潜力。
2.1.2 肝癌
色胺酮不仅能减缓氧化应激给肝脏带来的危害,对肝癌细胞也有抑制作用。现普遍认为氧化应激是人体一种最基本的保护机制,但过度的氧化应激会导致细胞和组织损伤,引起高血压、糖尿病、心血管等疾病。过度氧化应激是肝脏发病的病理生理基础,可通过减少氧化应激或提高肝脏的抗氧化能力减少氧化应激带来的危害。Moon等[34]发现色胺酮能有效抑制叔丁基过氧化氢(tBHP)介导的细胞毒性,使人肝细胞源性HepG2细胞免受氧化损伤和凋亡,包括活性氧(ROS)的产生、线粒体膜电位(MMP)的改变和细胞死亡,这种抑制可能与通过ERK/Nrf2途径上调HO-1和GCLC蛋白表达有关。色胺酮还可抑制肝细胞生长因子(HGF)发挥抗肝癌的作用。HGF在肿瘤的侵袭、生长和转移方面起着重要作用,与健康人相比肝癌患者体内HGF的表达明显增加。具体而言,色胺酮对表皮成纤维细胞中的多种HGF诱导剂具有强烈的抑制作用,如乙酸肉豆蔻佛波醇酯(PMA)、表皮生长因素(EGF)、血小板生长因素(PDGF)和基本的纤维原细胞生长因素(bFGF)。与此同时,色胺酮可有效抑制EGF、PDGF和bFGF诱导的成纤维细胞增殖,且无毒副作用。但色胺酮不能减弱因PMA诱导引起的MAPK磷酸化作用,表明色胺酮抑制HGF的产生可能是通过MAPK活化的下游过程来实现的[9]。Liang等[35]在筛选抗肿瘤药物过程中发现,色胺酮呈剂量依赖性(3~50 mg/mL)抑制人肝癌细胞BEL 7402的体外增长,当浓度为50 mg/L时抑制率可达88.02%。进一步用半数抑制浓度(8.2 μg/mL)的色胺酮培养1、3、5天后,BEL-7402细胞端粒酶活性A值分别为0.381、0.276和0,而未经药物处理的肝癌细胞A值为1.60,表明色胺酮能抑制BEL-7402细胞的端粒酶活性,且抑制效果随色胺酮作用时间增加而增加。此外,集落形成实验也表明色胺酮具有逆转肿瘤细胞向正常细胞转化的能力。上述研究表明,色胺酮在肝癌的预防、治疗与康复全过程均能发挥功效,且毒性较低,具有开发成抗肝癌新药的前景。但上述研究均为细胞实验,目前还缺乏体内试验来证明色胺酮抗肝癌的有效性和安全性,因此还需要对色胺酮进行深入地研究,以充分发挥其抗肿瘤活性。
2.1.3 乳腺癌
乳腺癌是全世界女性发病率最高的恶性肿瘤,其术后复发率和转移率极高,化疗也易出现不同程度的副作用,如神经毒性、肝肾功能损伤、胃肠道反应等。因此从中药中寻找疗效好、毒副作用低的乳腺癌术后和放化疗辅助药物,具有重要的现实意义。色胺酮能上调E-cadherin蛋白水平、下调MMP-2和Snail在人乳腺癌MCF-7细胞中的表达,从而抑制MCF-7细胞的增殖、迁移和侵袭,还能抑制TGF-β1诱导的MCF-7细胞转化。4T1乳腺癌小鼠灌胃色胺酮(25、50、100 mg/kg)后,食欲更好,肢体运动范围更大,肿瘤生长得到显著抑制,且不会引起体重和脏器系数的波动(P>0.05)。相关的药理机制是下调小鼠肿瘤组织中NOS1、COX-2和NF-κB P65蛋白的表达,上调小鼠血清中IL-2和TNF-α,并恢复小鼠血清IL-10水平[56]。进一步的Label-free蛋白质组学实验结果提示色胺酮可能通过调节与炎症相关的蛋白发挥抗小鼠体内4T1乳腺癌的作用,与之密切相关的差异表达蛋白包括上调CD14、PTGS2,泛素蛋白连接酶E3和下调CD44、HSPA1A、MIF、NF-κB、RPS6KA4、HMGB1[36,37]。MAPK途径在乳腺癌的增殖、生长和化疗耐药中起着重要作用,参与乳腺癌的侵袭和转移过程。为考察色胺酮能否通过MAPK信号通路对MCF-7细胞增殖产生影响,Zhou等[38]将色胺酮与MAPK抑制剂PD98059、SB203580和SP600125联合使用对MCF-7细胞进行处理。结果显示,单独给予色胺酮处理后MCF-7细胞活力明显下降,细胞中p-ERK、p-p38 MAPK和p-JNK蛋白表达均有增加的趋势;而联合给予色胺酮和不同浓度的MAPK通路抑制剂后,细胞的增殖活力均有不同程度的上升,细胞中p-ERK表达有所下降,p-p38 MAPK和p-JNK表达变化不明显。提示色胺酮对MCF-7细胞的抑制作用可能与MAPK信号通路激活有关,与ERK以及JNK通路的关系尤为密切。此外,Yu等[39]惊喜地发现色胺酮具有下调多药耐药性(MDR)的功能,通过下调MDR1基因的表达,发挥逆转乳腺癌细胞阿霉素耐药株耐药性的作用。相对于人体内其他细胞而言,癌细胞生长同样需要适应的环境,于是Zeng等[36]将目光投向癌症与人体微环境之间的联系—肿瘤微环境。结果表明,在体内和体外,色胺酮均能通过调节肿瘤炎症微环境发挥抗乳腺癌作用。
综上所述,色胺酮能从多个方面抑制乳腺癌的发生发展,主要机制是:抑制乳腺癌细胞的增殖、侵袭和迁移,促进凋亡,调节肿瘤炎症微环境等。此外,色胺酮还表现出较好的MDR逆转作用,且安全性较好。鉴于此,可考虑将色胺酮与临床常用的某些一线化疗药物联用,增强疗效的同时克服耐药。
2.1.4 皮肤癌
皮肤癌可分为基底细胞癌、鳞状细胞癌和黑色素瘤三大类,多发于脸颊、鼻部、眼睑皮肤等长期暴露于阳光的部位。其中黑色素瘤仅占皮肤癌总体的2%,但其恶性程度高,侵袭、迁移能力强,传统的放化疗治疗效果不理想。早在1985年便有报道称色胺酮对黑色素瘤细胞株B16有抑制作用[40]。Jayesh等[41]也发现从药用植物Wrightiatinctoria(Roxb.) R.Br.叶子中分离出来的半纯化组分DW-F5在体外和体内均能阻断黑色素瘤生长。光谱分析表明,DW-F5由色胺酮、一种芳香化合物和一种未经鉴定的脂肪族成分组成。此外,Shankar等[42]还研究了色胺酮对非黑色素瘤皮肤癌(NMSC)的作用,并用瑞士白化小鼠皮肤癌变模型对色胺酮的功效进行评估。在小鼠模型中,色胺酮(0.5、1 mg)成功地使肿瘤发病率、大小和多样性大幅度减少。经色胺酮处理后,小鼠毛囊细胞增殖和扩张受阻,表皮细胞中炎性细胞(中性粒细胞和淋巴细胞)浸润减少,β-连环蛋白、细胞周期蛋白D1和c-Myc表达降低,但未观察到小鼠皮肤或肿瘤中细胞凋亡水平的显著变化。其机理是通过抑制炎症和阻止毛囊细胞中的β-catenin和相关信号通路来抑制皮肤癌的发生,从而阻止其扩张和随后的肿瘤发展。
2.1.5 肠癌、食管癌
色胺酮对一些较为常见的消化道恶性肿瘤如肠癌和食管癌也有一定的治疗效果。Koya等[43]研究了口服色胺酮对azoxymethy(AOM)诱发的F344大鼠肠肿瘤的影响。结果显示色胺酮组(50 mg/kg BW)小肠肿瘤发生率低于AOM对照组(5% versus 26%),表明色胺酮能降低肠道肿瘤的发生率,对肠癌有预防作用。顺氯氨铂(cDDP)是食管癌后期化疗的主要药物,但其耐药性的产生极大地影响了化疗效果。Huang等[44]发现色胺酮(16 mg/L)能增强顺铂对癌细胞的敏感度,抑制MDR1和GST-pi基因的表达逆转食管癌细胞顺铂耐药株Eca109/cDDP的耐药性,表明色胺酮一种潜在的食管癌术后化疗辅助药物。
2.1.6 神经母细胞瘤
神经母细胞瘤主要起源于肾上腺,是儿童期最常见的颅外实体瘤,约占所有儿童癌症的10%。传统的放化疗会有残留病变、局部复发以及不良反应出现的可能,因此对于神经母细胞瘤的治疗仍是儿科肿瘤学面临的一个重大挑战[45]。为寻找更安全有效的药物,研究人员用N-myc扩增技术研究了色胺酮在体外对人神经母细胞LA-N-1细胞生长和分化的影响。结果表明色胺酮对人神经母细胞瘤细胞的生长抑制具有剂量(0~30 μmol/L)和时间(24、48、72 h)依赖性。其机制可能是诱导细胞周期阻滞于G0/G1期;增强乙酰胆碱酯酶活性和诱导LA-N-1细胞向神经元分化;降低LA-N-1细胞中N-myc的表达[46]。
2.2 抗炎
自古以来菘蓝便有治疗刀伤、溃烂、蛇咬、痔疮等炎症的记载,现多用于治疗风湿性关节炎、皮炎、哮喘、结肠炎等疾病[47]。作为菘蓝的活性成分,色胺酮的抗炎作用也不容忽视(见图5)。体外实验证明,色胺酮能抑制与炎症相关的因子如NO、PGE2、PG、LTs的合成影响炎症的反应进程[48,49]。此外,色胺酮(1~10 mmol/L)还能抑制肥大细胞的增殖,有用于治疗肥大细胞介导的特应性皮炎的潜能。其作用机制是:抑制胸腺基质淋巴生成素刺激的HMC-1细胞中Ki67、MDM2和IL-13的表达;增加HMC-1细胞中PARP和caspase3的表达;降低TSLP诱导的TNF-α产生和IL-7Ra/TSLPR mRNA表达[50]。另一细胞实验发现,色胺酮(10 mmol/L)可抑制LPS刺激的BV2小胶质细胞中促炎介质和细胞因子(如TNF-α、IL-6、IL-1b、iNOS、NO、COX-2和PGE2)的过度生成和TLR4和MyD88蛋白的表达,发挥抗神经炎症的作用,这与色胺酮促使NF-κB通路失活,抑制p38 MAPK途径的激活有关[6,51]。
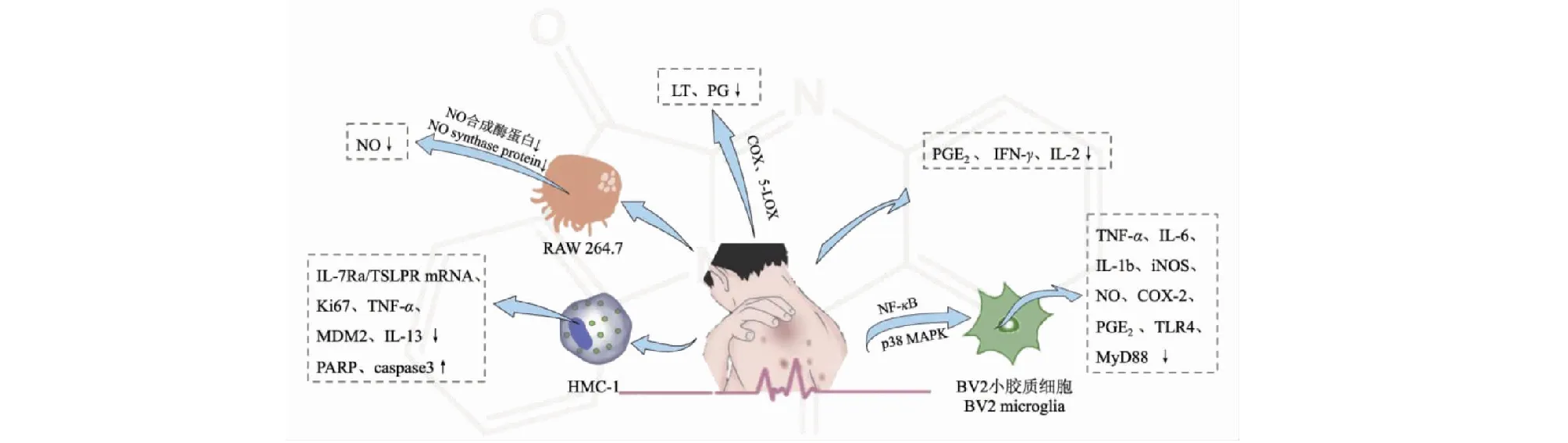
图5 色胺酮的抗炎作用Fig.5 The anti-inflammatory effect of tryptanthrin
2.3 抗菌
抗生素的滥用导致多重耐药、泛耐药菌株不断增加,可供临床选择的抗生素越来越局限。研发新型抗生素的周期较长,故从天然植物中挖掘毒副作用小的活性成分逐渐成为现代抗菌药物研究的热点。色胺酮是菘蓝根抗菌作用的有效成分,且在体内外均有一定的抗菌作用。在体外,色胺酮能够呈剂量依赖性抑制幽门螺杆菌(1.0~10 μg/mL),浓度为10 μg/mL时菌落形成被完全抑制。体内实验发现,与溶剂对照组比,口服色胺酮(5 mg/只)能显著抑制蒙古沙土鼠胃中的细菌菌落。此外,色胺酮与克拉霉素联用时还能发挥协同效应,为降低抗生素的使用剂量提供可能性,从而减轻副作用[52]。色胺酮(亚-MIC 2 μg/mL)对霍乱弧菌也有较好的抑制作用,其靶点为群体感应(Quorum sensing)调节蛋白LuxO。溶血性实验发现,色胺酮在12 h内溶血率至少为0.72%,在第12 h至少为2.78%(溶血<10%通常被认为是安全的),说明其亚-MIC浓度为非溶血性[7]。色胺酮对霍乱弧菌的抑制作用较好、且无溶血性,因此可以考虑将色胺酮与抗生素联用,用于治疗霍乱。色胺酮还能有效抑制各种肺结核菌株,其对结核分枝杆菌MTB H37Rv、M avium和M smegmatis具有较好的抑制活性,最小抑制浓度分别为1、4、6 mg/L,同时对多药耐药结核分枝杆菌菌株仍能保持较强抑制作用[53]。不仅如此,与空白组相比色胺酮(6.25~25 μg/mL)对革兰氏阳性致龋菌和革兰氏阴性厌氧牙周病菌均有显著抑制作用,因此色胺酮还用于龋齿和牙周病的防治[54]。
色胺酮对许多真菌也表现出良好的抑制作用。隐球菌可从树木和鸟类排泄物中分离出来,多通过散布在空气中的繁殖体引起感染,并伴随着诱发脑膜炎、肺炎等并发症的风险。目前,隐球菌病是世界范围内最严重的动物真菌病之一。一项关于中东地区隐球菌感染的流行病学调查发现,其在伊朗的树木,鸟粪,动物和人类中的总体流行率分别估计为4.7%、20.4%、1.7%和2.8%[55]。研究表明在30 ℃时,钙调神经磷酸酶抑制剂FK506和环孢霉素A诱导了色胺酮的抗隐球菌活性,最低抑菌浓度为2 μg/mL。值得注意的是,高温环境中色胺酮仍能具有较强的抗隐球菌活性,具体表现在调节编码细胞周期蛋白的基因和新生隐球菌孢子虫的SBF/MBF复合物(CLN1、MBS1、PCL1和WHI5)的表达,诱导细胞周期停滞于G/S期。对新生隐球菌孢子虫突变体数据库的筛选进一步揭示了色胺酮与多种转运蛋白和信号通路有关,如钙转运蛋白(Pmc1)和蛋白激酶a信号通路。提示色胺酮通过干扰细胞周期和信号传导途径对隐球菌产生了抗菌活性[56]。此外,色胺酮对犬小孢子菌、须毛癣菌、红色癣菌、紫色癣菌、断发癣菌、絮状表皮癣菌、石膏样癣菌、石膏样小孢子菌、羊毛状小孢子菌等皮肤类真菌也有较好的抑制效果[4]。
上述研究表明色胺酮具有活性强,抗菌谱广的特点。色胺酮抗菌作用的发现为一些复杂致病菌的治疗提供了新思路。可考虑单独使用色胺酮,或将其与其它抗菌药物联合应用达到预防和治疗细菌性疾病的目的。接下来还需对色胺酮的抗菌机制和科学合理使用进行深入研究,以期研发出以色胺酮为有效成分的抗菌新药。
2.4 抗病毒作用
在短短20年间,冠状病毒已经引发了包括COVID-19、严重急性呼吸系统综合征冠状病毒(SARS-CoV)、中东呼吸系统综合征冠状病毒(MERS-CoV)在内的3次传染病大流行,给人类的健康带来了极大的危害。尽管冠状病毒具有极高的物种多样性,但它们共享着关键的基因组元素,可依据病毒基因组信息和生物信息学特征指引发现潜在的有效药物[57]。人冠状病毒NL63(HCoV-NL63)是一种呼吸道病原体,感染后可引起上、下呼吸道感染,在儿童及免疫力低下的人群中的感染率较高。Tsai[58]等发现Strobilanthescusia(Nees) Kuntze叶的甲醇提取物能有效抑制HCoV-NL63感染细胞的细胞病变效应(CPE)和病毒产量,IC50为0.64 μg/mL,并确定其关键活性成分是色胺酮。在LCC-MK2和Calu-3细胞中,色胺酮表现出与细胞类型无关的抗HCoV-NL63活性,IC50分别为1.52 μmol/L和0.30 μmol/L。免疫荧光染色的感染性实验结果表明,在两种模式下,色胺酮阻止HCoV-NL63复制的早期(IC50=0.32 μmol/L)和晚期(IC50=0.06 μmol/L),特别是阻断病毒RNA基因组的合成和类木瓜样蛋白酶2的活性。此外,色胺酮(IC50=0.06 μmol/L)还表现出较强的杀病毒活性。值得注意的是,HCoV-NL63棘突蛋白(S蛋白)靶向ACE2受体,显示出与SARS-CoV和SARS-CoV-2高度保守的序列和结构相似性,提示色胺酮有可能被作为一种生物活性剂来对抗SARS-CoV-2和其他人类冠状病毒。3CLpro是冠状病毒复制所必需的酶,也是SARS-CoV-2最具特征的药物靶点之一,因此寻找以3CLpro为靶点的抑制剂对于COVID-19的防治具有重要意义[59]。Narkhede等[60]筛选出了包括甘草酸、色胺酮、大黄酸和小檗碱等在内的12种能发挥抗SARS-CoV-2感染作用的潜在候选药物。分子对接结果显示,色胺酮与3CLpro结合的亲和力是-8.2 kcal/mol,通过与GLN 110形成两个氢键以及与ILE 106、VAL 104的pi-alkyl烷基相互作用以及与ARG 105、GLN 107、THR 111、THR 292、PHE 294、ASP 153和SER 158的几种范德华相互作用。它遵循利宾斯基的五定律,显示出良好的药物性质,没有任何违反,提示色胺酮可用于抗COVID-19的探索性研究。
不仅如此,色胺酮对流感病毒也有潜在的预防作用。流感病毒分为甲、乙、丙三型,其中甲型流感病毒(IVA)最容易发生变异,流感大流行就是甲型流感病毒出现新亚型或旧亚型重现引起的。Xu等[61]对不同的IVA株,包括野生型和抗药性IVA株,进行了细胞病变作用还原试验(CEP)。意外地发现在A/Minfang/151/2000(野生型H3N2)病毒感染前给犬肾细胞注射色胺酮,其IC50=76.33±3.4 μmol/L与奥司他韦(IC50=54.45±14.24 μmol/L)和利巴韦林(IC50=62.45±16.24 μmol/L)相似,表明色胺酮对野生型IAV具有保护作用。神经氨酸酶(NA)是一种分布于流感病毒被膜上的糖蛋白,具有抗原性,能促进新生病毒的释放。Zhang等[62]采用分子对接试验研究了色胺酮对两种流感病毒NA活性的影响(PDB密码分别为3ti6和4mww)。发现色胺酮以显著的结合能抑制NA(对3ti6编码的结合能为-8.07 kcal/mol,对编码4mww的NA的结合能为-7.52 kcal/mol),甚至优于奥司他韦(对3ti6编码的结合能为-5.92 kcal/mol,对编码4mww的NA的结合能为-7.12 kcal/mol),这表明色胺酮可有效地抑制NA,从而产生抗病毒作用。色胺酮可作为抗流感病毒的候选化合物,但还需进一步研究其体内功效、机制和结构转化。
2.5 保护心脏
色胺酮可通过改善心肌缺血发挥保护心脏的作用。结扎冠状动脉所致心肌缺血大鼠在灌胃色胺酮(0.10 g/kg)后,心肌收缩能力增强,心肌舒张顺应性得到改善,左心室内收缩压LVSP和左心室内压最大变化速率±dp/dtmax明显增高,与模型组比有明显差异(P<0.05)。病理组织学检测发现,给予色胺酮治疗后心肌组织肌间隙纤维增生、慢性炎细胞浸润和灶性坏死状况均有一定改善,说明色胺酮对缺血心肌损伤有保护作用。但随给药剂量的增大,其对心肌的保护作用反而减弱,不呈量效依赖关系。这可能与色胺酮剂量增加,其对COX-2蛋白的抑制增强,导致副作用增大有关[63]。
2.6 抗血管生成
抗血管生成治疗是一种通过血管生成抑制剂阻断促血管生成因子,靶向抑制肿瘤血管生成的一种治疗方法。血管生成因子众多,常见的有血管内皮生长因子(VEGF)、表皮生长因子(EGF)、肝素、前列腺素E1/E2等。细胞试验表明,色胺酮(50 μmol/L)能特异性作用于血管内皮细胞,抑制细胞增殖,这是通过下调内皮细胞中apelin的表达、抑制apelin启动子活性和缩短mRNA半衰期来实现的[64]。色胺酮还能阻断PKB或Akt和FAK途径,使血管内皮细胞G2/M期阻滞,抑制血管内皮细胞的迁移和成管。在mRNA和蛋白质水平上,色胺酮(0~50 μmol/L)能呈剂量依赖性地降低细胞周期蛋白A、细胞周期蛋白B、细胞周期蛋白依赖激酶CDK1和CDK2的表达。值得注意的是,该研究是在原代血管内皮细胞用色胺酮预处理24 h后进行的,并且在没有色胺酮的情况下进行迁移和成管实验,提示色胺酮具有持续的抑制作用。
3 药物动力学特征
药代动力学性质是筛选新药的重要指标之一,为给色胺酮的进一步研究和应用提供依据,学者们对色胺酮的药代动力学特征进行了研究。Zhu等[65]对色胺酮(0.8~20 μmol/L)在Caco-2细胞中的吸收和转运特性进行了考察,发现在该浓度范围内色胺酮的吸收型Papp(AP→BL)和分泌型Papp(BL→AP)均无显著变化,表明色胺酮的转运不受浓度的影响;Papp(AP→BL)/Papp(BL→AP)大于1,表明色胺酮能被很好地吸收且以被动扩散为主;外排转运蛋白P-gp和MRP2抑制剂的加入几乎不影响色胺酮(4 μmol/L)的Papp,表明其外排不受P-gp和MRP2抑制剂的影响。
Zhang等[66]研究了色胺酮(80 mg/kg)在昆明小鼠体内的分布情况。小鼠灌胃2.5 h后,肝脏中色胺酮含量最高(3.54 g/g),其次是肾脏(2.12 g/g),肺(1.46 g/g),提示色胺酮与这些组织可能存在一定的关联和靶向性;脑中含量最低(<0.2 g/g),提示色胺酮可能难以穿过小鼠血脑屏障。小鼠灌胃第12 h的Cmax是第1.5 h的Cmax的四十八分之一,表明色胺酮在体内无明显蓄积。雄性SD大鼠体内初步药代动力学研究表明,色胺酮(2 mg/kg BW i.v.)的半衰期为40.63±6.66 min,清除率为1.00±0.36 L/(h·kg)[67]。随后,Wu等[68]研究了色胺酮在体内的药代动力学过程。SD大鼠尾静脉注射色胺酮(75 mg/kg)后,t1/2β为2.193 h,AUC(0-∞)为4.616 mg/(L·h),V1为33.794 L/kg,CL为29.76 L/(h·kg)。上述研究表明,色胺酮在体内具有吸收迅速、分布广泛、代谢较快等特点,但还需进一步研究其作用靶点、代谢途径,为色胺酮的临床应用提供更多可靠的数据。
4 毒性
大量细胞毒性试验表明,色胺酮不具直接毒性。Lee等[6]研究了色胺酮(2.5~20.0 μmol/L)对BV2小胶质细胞活性的影响,MTT结果显示在没有或存在LPS的情况下色胺酮均无细胞毒性。此外,显微镜下的形态学评估发现经色胺酮(2 μg/mL)处理的哺乳动物细胞系HEK-293细胞显示出与PBS阴性对照组相似的纺锤形健康细胞,该结果进一步验证了色胺酮非细胞毒性的特点[7]。急性毒性研究表明,小鼠灌胃色胺酮(25、50、80 mg/kg)后,体重略有减轻,但未见其他异常,无死亡。随后,按同剂量连续给药30 d,进行亚急性毒性研究。试验期间动物的一般指标,如外观、行为、对刺激的反应、分泌物排泄物等均无显著异常,且未见小鼠死亡。小鼠脏器,如心、肝、脾、肺、肾、大脑等未见异常,脏器系数和空白对照组无显著性差异(P>0.05)。结果提示,色胺酮毒性较低,安全性较好,是一种很有前途的替代疗法药物[8]。
5 总结
色胺酮的天然来源十分广泛,在药用植物马蓝、菘蓝、蓼蓝中均能分离得到色胺酮。现已证实色胺酮是一种后熟产物,且其合成过程是非酶催化的。色胺酮还是某些微生物如解脂假丝酵母、裂褶菌、海洋链霉菌的次生代谢产物。然而,自然界中色胺酮的含量很低,且存在提取工艺繁琐、分离过程费时、提取率低等问题。因此色胺酮的化学合成是当前研究的热点,靛红和靛红酸苷是常用的合成原料。与直接从植物中提取色胺酮相比,人工合成提高了色胺酮的产率,但合成路线较为繁琐,反应条件较为苛刻,仅适用于实验室少量合成。若想大规模生产,还需探索更简捷、低成本的人工合成方法及工艺,色胺酮的仿生合成可作为未来的研究方向。
众多药理实验表明,色胺酮具有良好的抗炎、抗菌、抗肿瘤、抗病毒等生物活性,且毒副作用低。色胺酮具有的药理作用及在肠道中易于被吸收的特点使其在疾病的预防与治疗方面具有广阔的应用前景。然而,现今有关色胺酮的报道仅限于体外实验或动物实验,具有局限性,未来还需足够的临床试验数据作为有力支撑,如何充分利用、开发具有市场价值的色胺酮类化合物产品,将会是今后的研究重点。
