右美托咪定通过p38通路改善发育期大鼠七氟醚麻醉后认知功能障碍①
2020-06-06康文越邢丹丹王志华海南省人民医院麻醉科海口570300
康文越 邢丹丹 付 强 丁 容 王志华 林 慧 (海南省人民医院麻醉科,海口 570300)
大量研究已证实麻醉药物是诱导术后认知功能障碍的重要因素,有研究发现七氟醚可通过促进神经细胞凋亡导致老年患者术后认知功能障碍[1,2]。七氟醚作为婴幼儿最常用的吸入麻醉药,在动物实验中发现七氟醚可诱发新生鼠神经细胞凋亡和认知功能障碍[3]。右美托咪定为高选择性α2肾上腺素受体激动剂,为常用的麻醉辅助药物,具有镇痛、镇静、抑制交感神经活动、抗焦虑等效应,可通过抑制神经元细胞凋亡抑制七氟醚引起的海马神经细胞凋亡,从而发挥神经保护作用[4]。但右美托咪定减轻七氟醚对神经细胞凋亡的影响的机制尚需进一步探讨。鉴于右美托咪定可通过p38信号通路等多种信号通路发挥作用[5],本文探讨右美托咪定是否通过p38信号通路改善发育期大鼠七氟醚麻醉后认知功能障碍,现报道如下。
1 材料与方法
1.1材料
1.1.1动物 健康、清洁级、7日龄、体重15~20 g、雌雄各半SD大鼠90只(北京华阜康生物科技股份有限公司、动物许可证号:SCXK(京)2014-000)。
1.1.2试剂 七氟醚(日本制药株式会社,生产批号:40181),右美托咪定(江苏恒瑞医药股份有限公司,生产批号:12011634),生物素化抗地高辛抗体、二氨基联苯胺、苏木素-伊红、SABC-FITC免疫荧光试剂盒、SABC免疫组化染色试剂盒、二氨基联苯胺(DAB)显色试剂盒等(美国Invitrogen公司),荧光标记的抗人球蛋白抗体、兔抗大鼠p38丝裂原活化蛋白激酶(p38MAPK)多克隆抗体、兔抗大鼠磷酸化p38MAPK(p-p38MAPK)多克隆抗体、兔抗鼠Caspase-3多克隆抗体、兔抗鼠Bcl-2相关X蛋白(Bax)多克隆抗体、兔抗鼠B淋巴细胞瘤-2基因(Bcl-2)多克隆抗体、羊抗兔多克隆二抗等抗体(美国SANTA CRUZ公司)。
1.2方法
1.2.1动物分组和处理 将90只大鼠随机分为对照组(C组)、七氟醚组(S组)、七氟醚+右美托咪定组(S+D组),每组30只。C组大鼠腹腔注射0.9%生理盐水10 μl,放入混合气(氮气∶氧气=7∶3)的密闭箱中;S组大鼠腹腔注射0.9%生理盐水10 μl,放入体积分数为0.68的氮气、体积分数为0.30的氧气、体积分数为0.02的七氟醚的混合气的密闭箱中;S+D组大鼠腹腔注射右美托咪定10 μl(25 μg/kg右美托咪定用生理盐水稀释至10 μl),放入体积分数为0.68的氮气、体积分数为0.30的氧气、体积分数为0.02的七氟醚的混合气的密闭箱中。混合气体流量为2 L/min,持续吸入4 h。
1.2.2标本采集 麻醉结束后4 h每组取出10只大鼠麻醉处死,取出海马组织,放入多聚甲醛(4%)中固定,常规石蜡包埋,切成厚4 μm切片,用于TUNEL染色、免疫荧光染色和免疫组化染色;每组再取出10只大鼠麻醉处死,取出海马组织用于Western blot测定;每组剩余的10只大鼠于麻醉后3周进行水迷宫实验。
1.2.3TUNEL染色测定大鼠海马CA1区凋亡细胞数 取大鼠海马组织切片加入过氧化氢反应10 min,蒸馏水冲洗,加入Tris缓冲液稀释的蛋白酶(1∶200)消化10 min,加标记液孵育2 h,Tris缓冲液冲洗,加入封闭液反应30 min,加入生物素化抗地高辛抗体反应30 min,加入生物素化过氧化物酶复合物反应30 min,Tris缓冲液冲洗,DAB显色,苏木素-伊红复染,Tris缓冲液冲洗,脱水、透明和封片。在光学显微镜下观察海马CA1区细胞凋亡情况,细胞核含棕褐色颗粒为凋亡细胞,采用Meta Morph分析系统计算每个高倍视野凋亡细胞数。
1.2.4免疫荧光染色测定大鼠海马CA1区Caspase-3、Bax、Bcl-2表达 取大鼠海马组织冰冻切片,放入多聚甲醛(4%)中固定,加入兔抗鼠Caspase-3多克隆抗体、兔抗鼠Bax多克隆抗体、兔抗鼠Bcl-2多克隆抗体(1∶200)过夜孵育,加入荧光标记的抗人球蛋白抗体孵育5 min,加入羊抗兔多克隆抗体二抗孵育30 min,加入缓冲甘油,采用激光扫描共聚焦显微镜扫面荧光标记阳性反应物,发绿色荧光为阳性反应物,测定每个高倍视野下阳性细胞数和荧光强度。
1.2.5免疫组化染色测定大鼠海马CA1区p38MAPK表达 取大鼠海马组织切片经烤片、脱蜡、复水,加入内源性过氧化物酶孵育10 min,消除内源性过氧化物酶活性,加入枸橼酸钠缓冲液加热孵育15 min,胰蛋白酶消化30 min,加入BSA孵育20 min封闭非特异结合位点,加入兔抗大鼠p38MAPK多克隆抗体(1∶100)过夜孵育,加入生物素标记二抗孵育1 h,加入辣根酶标记的链酶卵白素孵育30 min,加入DAB显色剂孵育10 min显色,加入苏木素染色4 min,经脱水、透明、封片,光镜下观察细胞染色情况,细胞核周围出现棕褐色颗粒为阳性表达,采用Image-Pro Plus图像分析系统测量阳性细胞显色强度和阳性细胞所占百分数。阳性细胞显色强度为:0级为阴性,1级为弱阳性,2级为阳性,3级为强阳性;阳性细胞所占百分数分级为:0%~1%为0级,2%~10%为1级,11%~50%为2级,51%~80%为3级,81%~100%为4级。免疫组化IHS评分为阳性细胞显色评分×阳性细胞所占百分数评分,总分为0~12分。
1.2.6Western blot测定海马CA1区p38MAPK、p-p38MAPK蛋白水平 取250 mg海马组织加入1 ml RIPA在冰上匀浆,12 000 r/min离心10 min,提取总蛋白,测定总蛋白浓度,经电泳、切胶、转膜,加入BSA封闭1 h,加入一抗(兔抗大鼠p38MAPK多克隆抗体、兔抗大鼠p-p38MAPK多克隆抗体,1∶1 000),以β-actin为内参(1∶2 000)过夜孵育,加入过氧化物酶标记的羊抗兔IgG二抗孵育2 h,加入ECL显影,放入机器曝光,采用NIH1162软件分析蛋白条带光密度值,p38MAPK、p-p38MAPK蛋白水平用p38MAPK、p-p38MAPK蛋白条带光密度值/β-actin光密度值表示。
1.2.7Morris水迷宫实验测定认知功能 麻醉后3周,取每组剩下的10只大鼠进行水迷宫实验。前4 d进行定位航行试验:将高55 cm、直径94 cm圆形水池注入水,水深40 cm,将水池分为4个象限,将平台放在第3象限,平台顶部距离水面3 cm,将大鼠每天上午10点和下午5点分别从4个象限中点放入水池,记录大鼠逃避潜伏期(即达到平台的时间)。第5天进行空间探索实验:将水池中的平台撤去,观察大鼠90 s时间内穿越原平台次数。

2 结果
2.1大鼠海马CA1区凋亡细胞数比较 与C组比较,S组和S+D组大鼠海马CA1区凋亡细胞数升高(P<0.05);与S组比较,S+D组大鼠海马CA1区凋亡细胞数降低(P<0.05),见表1和图1。
2.2大鼠海马CA1区Caspase-3、Bax、Bcl-2表达情况比较 与C组比较,S组和S+D组大鼠海马Cas-pase-3、Bax阳性细胞数和荧光强度升高(P<0.05),Bcl-2阳性细胞数和荧光强度降低(P<0.05);与S组比较,S+D组大鼠海马CA1区Caspase-3、Bax阳性细胞数和荧光强度降低(P<0.05),Bcl-2阳性细胞数和荧光强度升高(P<0.05),见表2和图2。
2.3大鼠海马CA1区p38MAPK免疫组化染色比较 与C组比较,S组和S+D组大鼠海马CA1区p38MAPK免疫组化IHS评分升高(P<0.05);与S组比较,S+D组大鼠海马CA1区p38MAPK免疫组化IHS评分降低(P<0.05),见表3和图3。
2.4大鼠海马CA1区p38MAPK、p-p38MAPK蛋白水平比较 3组大鼠海马CA1区p38MAPK蛋白水平比较差异无统计学意义(P>0.05),三组大鼠海马CA1区p-p38MAPK蛋白水平比较差异有统计学意义(P<0.05),其中与C组比较,S组和S+D组大鼠海马CA1区p-p38MAPK蛋白水平升高(P<0.05);与S组比较,S+D组大鼠海马CA1区p-p38MAPK蛋白水平降低(P<0.05),见表4和图4。
2.5大鼠水迷宫结果比较 与C组比较,S组和S+D 组大鼠逃避潜伏期延长(P<0.05),穿越原平台次数减少(P<0.05);与S组比较,S+D组大鼠逃避潜伏期缩短(P<0.05),穿越原平台次数增加(P<0.05),见表5。

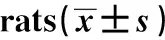

GroupsnApoptotic cells(cells/mm2)Group C1016.47±3.24Group S1047.58±3.511)Group S+D1027.13±3.621)2)F208.739P0.000
Note:Compared with group C,1)P<0.05;compared with group S,2)P<0.05.

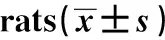
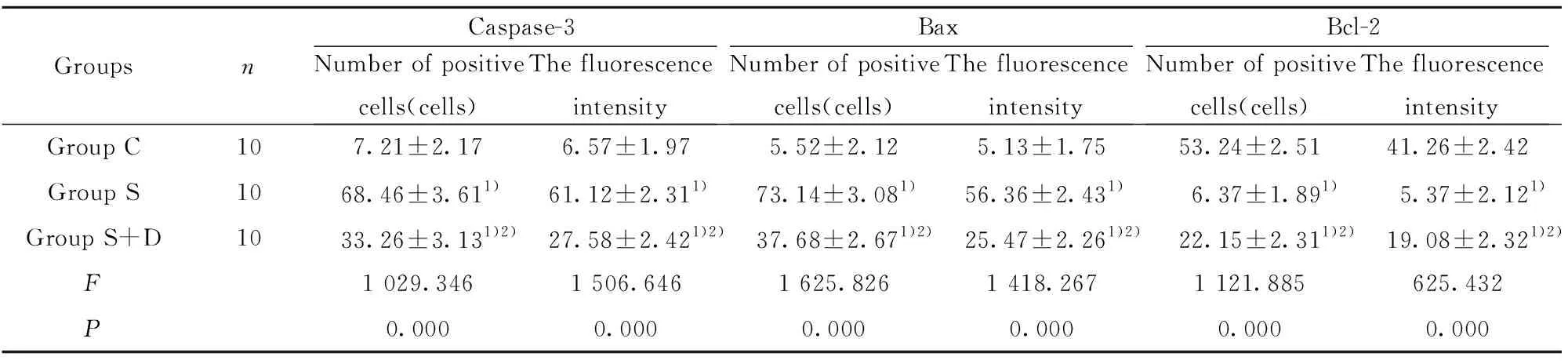
GroupsnCaspase-3Number of positivecells(cells)The fluorescenceintensityBaxNumber of positivecells(cells)The fluorescenceintensityBcl-2Number of positivecells(cells)The fluorescenceintensityGroup C107.21±2.176.57±1.975.52±2.125.13±1.7553.24±2.5141.26±2.42Group S1068.46±3.611)61.12±2.311)73.14±3.081)56.36±2.431)6.37±1.891)5.37±2.121)Group S+D1033.26±3.131)2)27.58±2.421)2)37.68±2.671)2)25.47±2.261)2)22.15±2.311)2)19.08±2.321)2)F1 029.3461 506.6461 625.8261 418.2671 121.885625.432P0.0000.0000.0000.0000.0000.000
Note:Compared with group C,1)P<0.05;compared with group S,2)P<0.05.

图1 大鼠海马CA1区凋亡细胞TUNEL染色(×400)Fig.1 TUNEL staining of apoptotic cells in hippocampal CA1 region of rats (×400)

图2 大鼠海马CA1区Caspase-3、Bax、Bcl-2免疫荧光染色(×400)Fig.2 Immunofluorescence staining of Caspase-3,Bax and Bcl-2 in hippocampal CA1 region of rats (×400)



Groupsnp38MAPK IHS scores(score) Group C100.57±0.42Group S103.15±0.571)Group S+D101.46±0.531)2)F65.869P0.000
Note:Compared with group C,1)P<0.05;compared with group S,2)P<0.05.

图3 大鼠海马CA1区p38MAPK免疫组化染色(×400)Fig.3 Immunohistochemical staining of p38MAPK in hippocampal CA1 region of rats (×400)

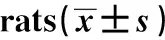
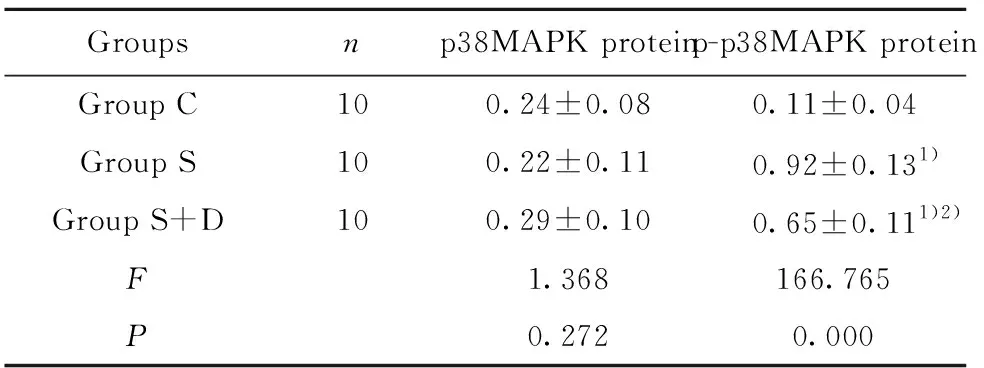
Groupsnp38MAPK proteinp-p38MAPK proteinGroup C100.24±0.080.11±0.04Group S100.22±0.110.92±0.131)Group S+D100.29±0.100.65±0.111)2)F1.368166.765P0.2720.000
Note:Compared with group C,1)P<0.05;compared with group S,2)P<0.05.
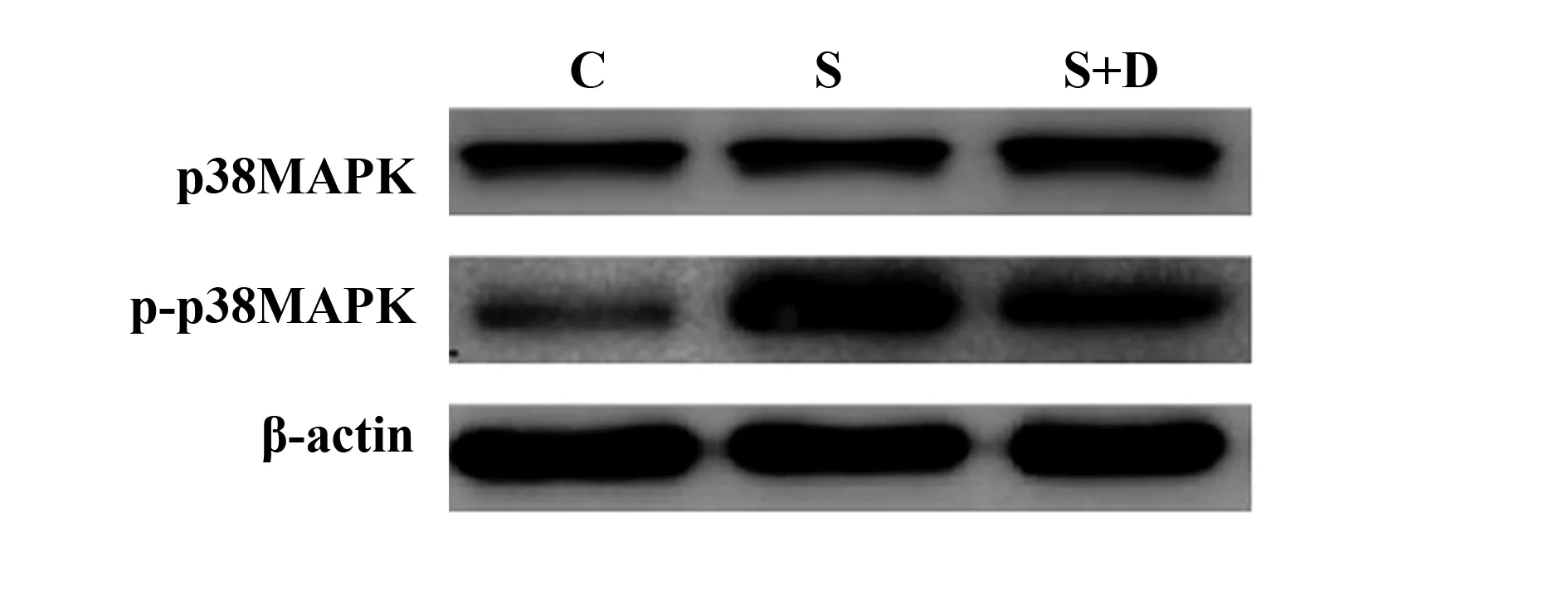
图4 大鼠海马CA1区p38MAPK、p-p38MAPK蛋白Western blot电泳图Fig.4 Western blot analysis of p38MAPK and p-p38MAPK proteins in hippocampal CA1 region of rats


GroupsnEscape latency(s)1 d2 d3 d4 dNumber of crossing theoriginal platform(times)Group C1026.41±3.5215.46±3.3812.16±2.289.42±2.358.79±1.74Group S1042.25±3.411)33.57±3.521)28.72±2.311)25.47±2.461)4.35±1.581)Group S+D1034.17±3.261)2)22.15±3.371)2)19.03±2.161)2)15.71±2.171)2)6.21±1.641)2)F54.32271.527136.620120.50118.159P0.0000.0000.0000.0000.000
Note:Compared with group C,1)P<0.05;compared with group S,2)P<0.05.
3 讨论
细胞凋亡和细胞坏死不同,细胞凋亡为主动过程,为由基因控制的细胞有序凋亡,在维持内环境稳定中具有重要作用。细胞凋亡是多种基因参与的一种生理过程,如Caspase家族、Bcl-2家族、癌基因如C-myc、抑癌基因P53等基因均参与调控细胞凋亡过程,这些基因在种属之间比较保守[6]。随着研究的不断深入,发现细胞凋亡受多种信号通路调控,MAPK信号通路为参与细胞凋亡的重要信号通路,p38MAPK为MAPK家族成员之一,p38MAPK可能为Caspase家族上游发挥抗凋亡的作用,Caspase可通过激活p38MAPK上游蛋白激酶诱导p38MAPK磷酸化,p38MAPK活化可通过磷酸化P53、诱导Bax转位等多种途径诱导细胞凋亡[7,8]。Caspase-3、Bax、Bcl-2在细胞凋亡中发挥重要作用,Caspase-3为凋亡过程中的凋亡执行蛋白酶,在细胞凋亡中发挥最关键作用;Bax、Bcl-2为Bcl-2家族成员,在细胞凋亡调控中发挥相互对立的作用,Bcl-2为凋亡抑制基因,Bax可拮抗Bcl-2的作用,具有促进细胞凋亡的作用;Caspase-3、Bax、Bcl-2三者相互作用,共同调控细胞凋亡的发生[9,10]。
七氟醚为临床常用的麻醉药之一[11],具有接受性好、不刺激呼吸道、诱导快等优点,是婴幼儿麻醉中最常用的吸入麻醉药,近年来研究发现七氟醚对神经元具有损伤作用,可引起认知功能障碍[12];七氟醚可通过抑制N-甲基-D-天冬氨酸受体功能发挥麻醉作用,可通过抑制海马CA1区突触长时程增强表达而影响认知功能[13]。七氟醚引起神经损伤和认知功能障碍的机制比较复杂:可通过影响新生大鼠海马结构中的Wnt/β-catenin信号通路影响新生大鼠的认知功能[14];可通过p38MAPK信号通路引起新生大鼠神经细胞凋亡。
右美托咪定为α2肾上腺素受体激动剂,具有高选择性,α2肾上腺素受体在外周神经细胞和中枢神经系统广泛存在,主要分布在海马旁回、蓝斑、扣带回等区域,其中海马是学习记忆的基础,学习记忆功能和海马神经的发生关系密切[16]。右美托咪定作为麻醉辅助药物,具有催眠、镇静、镇痛等作用,对呼吸无抑制作用,具有神经保护作用,可通过减轻七氟醚诱导的海马细胞周期阻滞等途径治疗七氟醚引起的神经损伤和认知功能障碍[17,18]。右美托咪定可通过p38等信号通路发挥作用,如右美托咪定通过抑制p38MAPK/TXNIP信号传导活化治疗肾缺血和再灌注损伤[19];右美托咪定通过p38MAPK/ERK信号传导途径保护大鼠免受氧-葡萄糖剥夺/再氧合损伤诱导的细胞凋亡[20]。
鉴于七氟醚可通过p38等多种途径诱导神经细胞凋亡,导致认知功能障碍,右美托咪定可减轻七氟醚引起的神经细胞凋亡和认知功能障碍,且可通过p38信号通路途径发挥神经保护作用,因此本文探讨右美托咪定是否通过p38通路改善发育期大鼠七氟醚麻醉后认知功能障碍,结果发现七氟醚可引起发育期大鼠海马CA1区凋亡细胞数升高;Caspase-3、Bax、p38MAPK表达量增加,Bcl-2表达降低,逃避潜伏期延长,穿越原平台次数减少;而右美托咪定可使七氟醚作用的发育期大鼠海马CA1区凋亡细胞数降低,Caspase-3、Bax、p38MAPK表达量下降,Bcl-2表达升高,逃避潜伏期缩短,穿越原平台次数增加。Caspase-3、Bax、Bcl-2和细胞凋亡关系密切,Caspase-3、Bax表达量升高,Bcl-2表达量下降表明海马CA1区细胞凋亡增加。
综上所述,七氟醚可通过p38信号通路途径诱导海马区细胞凋亡,引起神经功能障碍;右美托咪定可通过抑制p38信号通路途径抑制海马区细胞凋亡,从而改善认知神经功能障碍。
