CD19 CAR-T细胞治疗骨髓侵犯B细胞淋巴瘤疗效分析①
2020-06-06陈新峰郑州大学第一附属医院生物细胞治疗中心郑州450052
王 添 陈新峰 张 震 张 毅 (郑州大学第一附属医院生物细胞治疗中心,郑州 450052)
淋巴瘤是免疫系统的实体瘤,其中非霍奇金淋巴瘤(NHL)约占所有淋巴瘤病例的90%[1]。在近二十年中,虽然化疗药物、靶向药物和自体造血干细胞移植技术的发展极大地改善了非霍奇金淋巴瘤患者的临床疗效。然而,仍有高达40%的患者在初次接受治疗或治疗一段时间后出现复发[2]。因此,在目前的治疗方式下,B细胞非霍奇金淋巴瘤(B cell-non-Hodgkin′s lymphoma,B-NHL)患者难以完全治愈,而复发难治(relapsed/refractory,R/R)B-NHL伴随淋巴瘤细胞骨髓侵犯的患者预后更差。近年来,嵌合抗原受体T细胞(chimeric antigen receptor-T cells,CAR-T)疗法在淋巴瘤治疗领域中的应用受到广泛关注。CAR-T技术通过基因修饰使T淋巴细胞表达特定的CAR结构域,可以特异性识别靶抗原、杀伤靶细胞[3]。CAR-T细胞具备针对特定肿瘤抗原的高度亲和性,能高效杀伤表达该抗原的肿瘤细胞。CD19在不同分化阶段的B淋巴细胞表面均有特异性表达,95%以上的B淋巴瘤细胞表达CD19抗原,因此构建抗 CD19 CAR-T细胞可以实现对B细胞肿瘤的治疗目的。在治疗复发难治性B细胞恶性肿瘤中,靶向CD19分子的CAR-T细胞疗法已经取得了较好的临床疗效[4]。骨髓是NHL常见的淋巴结外受累部位,对于确诊时已有骨髓侵犯的患者,Ann Arbor分期即为Ⅳ期,多数患者肿瘤负荷较高且伴有明显的淋巴结外侵犯,患者可出现进行性贫血、血小板下降等表现,无论单因素或多因素分析均显示骨髓侵犯是淋巴瘤患者的不良预后因素[5]。目前,关于应用抗CD19 CAR-T细胞治疗伴随骨髓侵犯的R/R B-NHL患者中的相关文献尚少[6],且CAR-T细胞在治疗后骨髓中的维持复制能力也鲜有报道。本文我们将我院应用抗CD19 CAR-T细胞治疗的5例骨髓侵犯的R/R B-NHL患者的疗效以及不良反应报道如下。
1 资料与方法
1.1资料 选取2017年11月至 2018年5月在我院接受CD19 CAR-T细胞治疗的R/R B-NHL患者(NCT03156101)共5例,患者临床特征详见表1。其中男4例,女1例,中位年龄54(18~60)岁。原发疾病全部为B-NHL,其中滤泡型淋巴瘤(follicular lymphoma,FL)1例,套细胞淋巴瘤(mantle cell lymphoma,MCL)1例,淋巴母细胞淋巴瘤(lymphoblastic lymphoma,LBL)1例,弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)1例,高级别B细胞淋巴瘤(high-grade B-cell lymphoma,HGBCL)1例。入组时肿瘤负荷为高负荷4例,低负荷1例。所有患者在入组之前均接受过化疗,接受CAR-T回输治疗前的疾病状态为复发难治及MRD+。所有患者均经骨髓活检及骨髓细胞流式证实骨髓中有CD19+的异常B细胞侵犯,并通过免疫组织化学(immunohistochemistry,IHC)证实了淋巴瘤组织上的CD19表达。主要的排除指标是活动性感染和血细胞减少(淋巴细胞绝对值<0.8×109L)。本研究经我院医学科学研究伦理委员会审批通过,入组患者对于临床研究内容完全知情,并签署知情同意书。
1.2CAR-T细胞治疗方案 在回输前第14天,采集5例患者的自体外周血淋巴细胞并进行基因修饰。将带有CD19单链可变区(single chain fragment variable,scFv)、人4-1BB共刺激域和CD3ζ信号域的CAR-T19-4-1BB载体克隆到慢病毒骨架中。收集,纯化和浓缩慢病毒上清液。采用密度梯度离心法及磁分选方法分离并应用anti CD3/CD28活化微珠激活患者的CD3+T细胞。然后将细胞在含有5 ng/ml IL-7和5 ng/ml IL-15的X-VIVO 15培养基(Lonza)中培养,并在24~48 h内用浓缩的慢病毒转导细胞后培养10 d。慢病毒转导后,使用流式细胞仪(BD)采用流式细胞术(FACS)评估转导效率(转染率40%~70%)。在回输前对患者采用FC方案(氟达拉滨25 mg/m2×3 d,环磷酰胺250 mg/m2×3 d)进行预处理,并分3次进行CD19 CAR-T细胞回输治疗(第0天10%,第1天30%,第2天60%),输注CAR-T细胞总数为0.62(0.39~1.30)×106个/kg(图1)。
1.3疗效及不良反应判定标准 CAR-T细胞输注后第28天时进行近期疗效评估,评估依据NCCN指南进行。根据《2017国际工作组共识:淋巴瘤疗效评价标准》(RECIL 2017)将患者的疗效评价为:CR、PR、SD和PD[7]。根据针对NHL的Lugano反应评价标准[8],使用CT或PET-CT评估患者的疾病改变。根据至少满足一项Group d′Etude des Lymphoma Folliculaires criteria评价标准来定义高肿瘤负担[9]。CRS诊断标准参考Lee等[10]提出的标准,分为4级。
1.4随访 对招募的所有接受CD19 CAR-T细胞治疗的患者进行随访,随访时间为2017年8月12日至2019年9月30日。中位随访时间为18(12~19)个月。
2 结果
2.1临床特征 共有5例患者接受了抗CD19 CAR-T细胞治疗,患者临床特征详见表1。5例患者均为血液学全面复发,且在入组时均被诊断为淋巴瘤骨髓侵犯。4例B-NHL患者行多轮(5~18轮)化疗后复发,其中3号患者因在接受标准化疗方案后得到持续4年的CR后LBL复发,入组前未接受化疗。
2.2CAR-T疗效 5例患者输注CAR-T细胞后,检测CAR-T细胞在外周血中占CD3+T细胞的比例及达峰时间,详见图1。全部患者外周血中均能检测到CAR-T细胞,中位达峰时间为治疗后第14(9~28)天,其中,5号患者在回输后第4天出现CAR-T细胞一过性的下降(6.06%),随后几天内上升。外周血流式结果显示,回输前患者的外周血CD45+淋巴细胞中,CD19+B细胞所占的中位百分比为4.3%(0.5%~53.6%),而CD3+T细胞占82.9%(36.0%~86.8%)。详见图2,回输CD19 CAR-T细胞后的第14天,在外周血中均未检测到正常或恶性的CD19+B细胞,而CD3+T细胞占84.1%(63.3%~98.8%),骨髓活检显示5例患者均未检测到骨髓侵犯。所有患者均在接受抗CD19 CAR-T细胞输注后30 d进行疗效评估,4例(80.0%)达CR,1例(20.0%)达PR,总CR率为80.0%(4/5),见表1。
表1 5例接受抗CD19 CAR-T细胞治疗患者的临床特征
Tab.1 Clinical characteristics of 5 patients receiving anti-CD19 CAR-T cell therapy
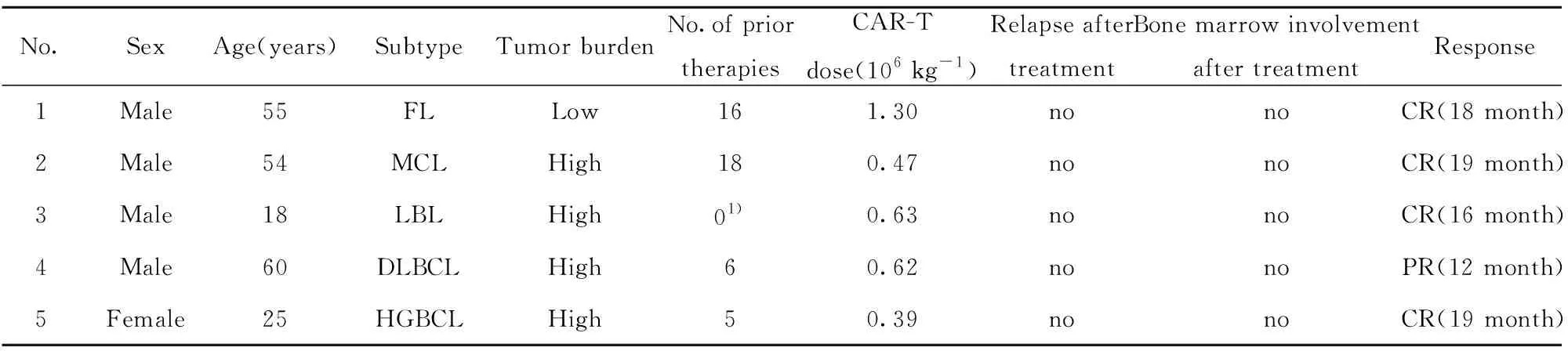
No.SexAge(years)SubtypeTumor burdenNo.of priortherapiesCAR-Tdose(106 kg-1)Relapse aftertreatmentBone marrow involvementafter treatmentResponse1Male55FLLow161.30nonoCR(18 month)2Male54MCLHigh180.47nonoCR(19 month)3Male18LBLHigh01)0.63nonoCR(16 month)4Male60DLBCLHigh60.62nonoPR(12 month)5Female25HGBCLHigh50.39nonoCR(19 month)
Note:Patient 01)received CR for 4 years after a standard chemotherapy regimen,and relapsed with B-LBL who enrolled onto this study without any chemotherapy.
表2 患者CRS的临床表现
Tab.2 Clinical manifestations of CRS in patients

No.CRS levelClinical features1ⅡAnemia,thrombocytopenia,hypoglobulinemia,elevated transaminase level,myalgia,hypertension2ⅡFever,anemia,neutropenia,hypoglobulinemia,infection,tachycardia,hypertension3ⅡFever,anemia,hypoxemia,thrombocytopenia,elevated transaminase,anorexia,vomiting,tachycardia,hyper-tension,bone marrow suppression4ⅡFever,anemia,pain,hypertension5ⅣFever,grade 4 neutropenia,grade 4 thrombocytopenia,hypoxemia,pain,elevated transaminase,rash,hypoten-sion,prolonged prothrombin time

图1 患者体内CAR-T细胞扩增情况Fig.1 CAR-T amplification in patients
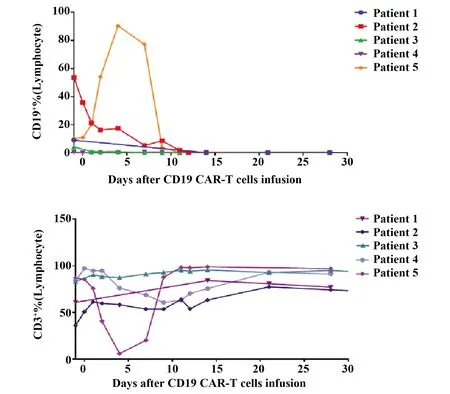
图2 患者外周血内CD3+T细胞及CD19+B细胞的比例变化Fig.2 In vivo expansion and persistence of CD3+T cells and CD19+B cells
2.3CRS 5例患者均发生CRS,其中2级4例,4级1例(表2)。4例患者出现发热,开始于回输后第1、2天,持续约1周,14 d内体温均恢复正常。其中,5号患者在第6日出现持续性高热,给予托珠单抗(160 mg) 注射液治疗后恢复正常。4例患者出现贫血;2例患者出现转氨酶升高;5号患者发生4级CRS,出现高热、血压降低、凝血异常、缺氧和腹痛,应用吗啡对症治疗、IL-6抗体及糖皮质激素治疗后好转;因其出现4级骨髓抑制,应用粒细胞集落刺激因子、重组人血小板生成素、血小板、辐照悬浮红细胞、冷冻血浆和抗生素进行对症治疗后得到好转。
2.4长期随访及无病生存情况 对所有患者随访1年以上,中位随访时间18(12~19) 个月。4例患者在CAR-T细胞输注后获得CR,1例患者获得PR。随访结束时,5例患者无复发,无淋巴瘤骨髓侵犯。
3 讨论
经历多轮化疗后伴有淋巴瘤骨髓侵犯的B-NHL复发患者仅依靠化疗很难获得CR,且疾病再次复发率高,难以获得长期存活[11],因此,该类患者迫切需要新的治疗方法。近年来,针对特异性肿瘤抗原的CAR-T细胞免疫疗法在治疗B细胞淋巴瘤中展现出较好的治疗效果,对降低患者死亡率有重要意义[12]。靶向CD19的CAR-T细胞在体内展现出强大的清除CD19+B淋巴细胞的能力,因此有望成为B细胞恶性肿瘤的治疗方法[13]。目前,对于CAR-T细胞治疗NHL的安全性及有效性也已得到证实[13]。但关于CAR-T细胞治疗多轮化疗后复发伴随骨髓侵犯患者远期临床疗效的研究尚无大量报道,本研究中纳入了具有不同亚型的B-NHL患者,5例患者在入组时均呈现血液学复发状态,且伴随淋巴瘤骨髓侵犯,患者应用抗CD19 CAR-T细胞输注治疗后进行疗效及不良反应评价并随访1年以上,4例患者评价为CR,1例患者评价为SD-PR,CR率为4/5(80.0%),尚无复发情况。虽然本报道病例数少,但初步结果好于其他一些报道[4,13]。
应用CAR-T细胞治疗最常见的不良反应是CRS[14],CRS临床表现为发热、缺氧、低血压等症状,有较少患者会出现多器官衰竭或淋巴细胞增多等症状[10]。CAR-T细胞与其靶抗原结合后导致CAR-T细胞活化并大量释放细胞因子,释放的促炎因子过多则会导致CRS相关的临床症状[9]。据报道,CD19 CAR-T细胞治疗后,分别有13%和28%的B细胞淋巴瘤患者发生3级或更高的CRS和神经系统症状[15]。本研究在4/5(80.0%)的患者中观察到1~2级CRS,仅有1/5(20.0%)的患者发生4级CRS。5号患者发生4级CRS可能与其肿瘤负荷高有关,在给予托珠单抗和糖皮质激素治疗后得到成功控制。提示应用CAR-T细胞治疗时,4级CRS发生率低且患者可耐受、症状可处理。
B-NHL患者应用CAR-T细胞治疗后仍存在疾病复发的风险,其主要原因可能是 CAR-T细胞进入人体后增殖水平差,维持时间较短。Park等[16]随访报道了53例B-ALL复发患者应用CAR-T 细胞治疗的病例,结果表明应用CAR-T细胞治疗后患者的生存期可能与CAR-T细胞在体内存活时间无关,而与回输CAR-T细胞前患者的疾病状态和肿瘤负荷有关。本研究中纳入了4例高肿瘤负荷的复发患者,在应用CAR-T细胞治疗后有3例获得CR,1例获得PR,提示CD19 CAR-T细胞治疗对于高肿瘤负荷患者也有较好的疗效。本研究5例患者均接受了自体T细胞改造的CAR-T细胞回输,无移植物抗宿主现象,这可能与CAR-T细胞疗效提升以及CAR-T细胞在患者体内维持长期疗效有关[17]。
综上所述,应用CD19 CAR-T细胞治疗多轮化疗后复发伴随骨髓侵犯B-NHL患者,随访1年以上,疗效及安全性较令人满意,对淋巴瘤的长期控制疗效良好,且能有效缓解骨髓侵犯,重度CRS发生率较低,且相关不良反应也能通过治疗得到控制。可以认为在多轮化疗后复发伴骨髓侵犯的B-NHL患者中应用CD19 CAR-T细胞治疗是一种有前途的治疗策略。但是本研究涉及病例数少,有待增加病例做进一步的验证。
