炙甘草多糖对小鼠巨噬细胞再极化的影响①
2020-06-06孟繁平延边大学医学院免疫学教研室延吉133002
冯 磊 李 响 孟繁平 李 妍 (延边大学医学院免疫学教研室,延吉 133002)
血液中单核细胞被募集分布于组织成为巨噬细胞(macrophage),组织微环境中巨噬细胞通过经典极化的途径和选择性极化的途径分别向M1型和M2型极化[1]。在细胞因子IFN-γ、病原体成分脂多糖(lipopolysaccharide,LPS)等刺激下,巨噬细胞向M1型极化,其细胞膜CD40、CD80和CD86等表达增加,并分泌促炎因子,抗病原体和抗肿瘤效应增强。而M2型极化后CD40、CD80和CD86等表达减少,CD206表达增加;其抗原提呈和介导炎症活性下降,免疫调节、促进组织修复作用增强[2]。M1型和M2型是活化巨噬细胞的两个极端状态,其分化受到复杂环境的调节。M2 型可再极化为M1 型,反之亦然。肿瘤微环境中(tumor microenvironment,TME)的肿瘤相关巨噬细胞(tumor associated macrophage,TAM)倾向于M2型极化,分泌TGF-β、IL-10、血管内皮生长因子(vascular endothelial growth factor,VEGF)和基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)等细胞因子[3]。研究表明,局部TAM数量多与肿瘤患者癌转移复发快、生存期短密切相关[4]。筛选逆转M2极化的制剂,对干预TAM分化,辅助肿瘤治疗具有重要意义。前期研究发现炙甘草的中等分子量多糖(medium molecular weight polysaccharide from roasted radixglycyrrhizae,MPRR)具有较强活化巨噬细胞的作用[5]。本研究通过探讨IL-4诱导巨噬细胞向M2型极化,并检测MPRR对其再极化的调节,阐明不同极化型巨噬细胞对肿瘤细胞生长的影响。
1 材料与方法
1.1材料 小鼠RAW264.7巨噬细胞和小鼠4T1乳腺癌细胞引自美国标准生物品保藏中心。胎牛血清购自黄岩四季青有限公司。1640 培养液购自美国 Gibco 公司。藻红蛋白(phycoerythrin,PE)标记抗体(CD86、CD206 )和PE标记同型对照抗体购自天津三箭生物技术有限公司。羧基化聚苯乙烯荧光微球 (fluospheres carboxylate yellow-green 505/515)购自美国赛默飞公司。IL-4购自北京义翘科技有限公司。ELISA试剂盒(检测小鼠IFN-γ和TGF-β)购自美国eBioscience公司。小鼠 STAT-6抗体、磷酸化STAT-6(Tyr641)抗体、β-actin抗体和辣根过氧化物酶(HRP)标记的二抗购自美国Abcam公司。牛血清白蛋白(BSA)、噻唑蓝(MTT)和碘化丙啶(PI)等购自上海碧云天生物技术有限公司。蛋白电泳和免疫印迹相关缓冲液购自北京索莱宝生物科技有限公司。采用水提和醇沉法制备炙甘草多糖,采用超滤离心法制备炙甘草的中等分子量多糖(MPRR)[6]。用1640培养液溶解IL-4(50 μg/ml),分装后-20℃保存;1640培养液溶解MPRR(5 mg/ml),过滤除菌并分装后-20℃保存。
1.2方法
1.2.1细胞培养 自液氮中取出冻存RAW264.7 细胞和4T1细胞,复苏后用含10%小牛血清1640培养液、5%CO2、饱和湿度、37℃培养。消化液(0.25%胰蛋白酶和 0.2%乙二胺四乙酸)消化后传代培养,取对数生长期细胞用于实验。
1.2.2免疫荧光染色和流式细胞术分析 接种细胞于6孔板,加入不同浓度IL-4(0、12.5、25、50和100 ng/ml),培养12 h,更换培养液继续培养12 h,收集细胞,PBS洗涤细胞2次,采用直接免疫荧光,法检测CD86和CD206的表达。即200 μl含0.5% BSA 溶液重悬细胞(细胞总数约为1×106个),加入抗体1 μg(PE标记抗CD86、CD206或同型对照抗体),避光染色30 min。PBS洗涤细胞2次,转入流式管后上机检测。以膜分子表达阳性细胞百分率代表实验结果。相同方法分析其他处理因素作用后CD86和CD206表达。
1.2.3吞噬功能检测 收集不同处理因素作用后的细胞,每组细胞数为(1~2)×106个,细胞与2 μl羧基化聚合苯乙烯荧光微球(细胞与微球的比例为1∶25~1∶100)孵育2 h后收集细胞,洗涤3次后采用流式细胞术检测细胞内绿色荧光,发射绿色荧光的细胞为吞噬荧光微球的细胞,以阳性细胞百分率代表吞噬效应的强度。
1.2.4免疫印迹实验 接种RAW264.7细胞于6孔板,按如下分组进行处理。M0组(以培养液培养细胞12 h,更换新培养液后继续培养12 h),M2组(50 ng/ml IL-4 诱导细胞12 h,更换培养液继续培养12 h),MPRR组(100 μg/ml MPRR 诱导12 h,更换培养液继续培养12 h),Rp组(50 ng/ml IL-4 诱导12 h,洗涤细胞2次,100 μg/ml MPRR 诱导12 h)。收集不同处理因素诱导后细胞,PBS洗涤2次;末次离心弃上清,加入细胞裂解液提取细胞总蛋白。蛋白定量试剂盒测定各组样品的蛋白浓度,并调为浓度一致;加入上样缓冲液后水浴煮沸5 min,分装蛋白样品并冷冻保存。将蛋白样品上样于聚丙烯酰胺凝胶进行电泳分离;通过转膜电泳将蛋白转印于PVDF膜。用含5%脱脂奶粉的封闭液室温下封闭2 h,洗涤3次后将膜与稀释的一抗在4℃下反应过夜。次日洗涤PVDF膜3次,将膜与稀释的HRP标记二抗在室温下反应2 h。洗涤3次后与ECL发光工作液反应2 min,用凝胶成像系统曝光照相记录结果。
1.2.5细胞因子含量检测 接种细胞于6孔板,按M0组、M2组、MPRR组和Rp组进行处理。消化液处理并收集细胞,洗涤2次后按相同密度接种细胞于6孔板,以不含IL-4或MPRR的培养液继续培养24 h;收集上清液并用0.22 μm无菌针头过滤器过滤后分装保存;采用ELISA试剂盒检测培养上清液IFN-γ和TGF-β的含量。
1.2.6细胞生长检测 接种4T-1于96孔板,对照组每孔加入200 μl;实验组加入150 μl 培养液,并分别加入不同处理组的巨噬细胞培养上清液(M0组、M2组、MPRR组和Rp组)50 μl,继续培养细胞,用MTT还原法检测72 h后细胞增殖变化。检测前4 h,每孔加入20 μl MTT溶液(5 mg/ml);继续培养4 h后,弃上清,每孔加入200 μl 二甲基亚砜溶解细胞内还原产物甲臜,检测490 nm吸光度值(A490),以各组A490均值代表不同处理因素对细胞生长的影响。

2 结果
2.1IL-4 流式细胞术检测极化巨噬细胞CD86和CD206的表达 流式细胞术分析RAW264.7细胞在IL-4和MPRR的作用下,其CD86和CD206表达变化,随IL-4浓度增加,CD86阳性细胞的百分率下降(P<0.05),而CD206阳性细胞的百分率增加(P<0.05);伴随MPRR浓度增加促进CD86的表达(P<0.05),但CD206阳性细胞表达下降(P<0.05),见表1。
2.2流式细胞术检测M2极化巨噬细胞再极化后CD86和CD206的表达 M0组(对照组)、M2组(M2极化组)、MPRR(极化组) 和Rp组(再极化组)的CD86和CD206表型分析, 与M0组比较,M2极化组 CD86表达减少(P<0.05)和CD206 表达增加(P<0.05),MPRR组CD86表达增加而CD206表达减少(P<0.05);与M2极化组比较,再极化组CD86表达增加而CD206表达减少(P<0.05),见表2。


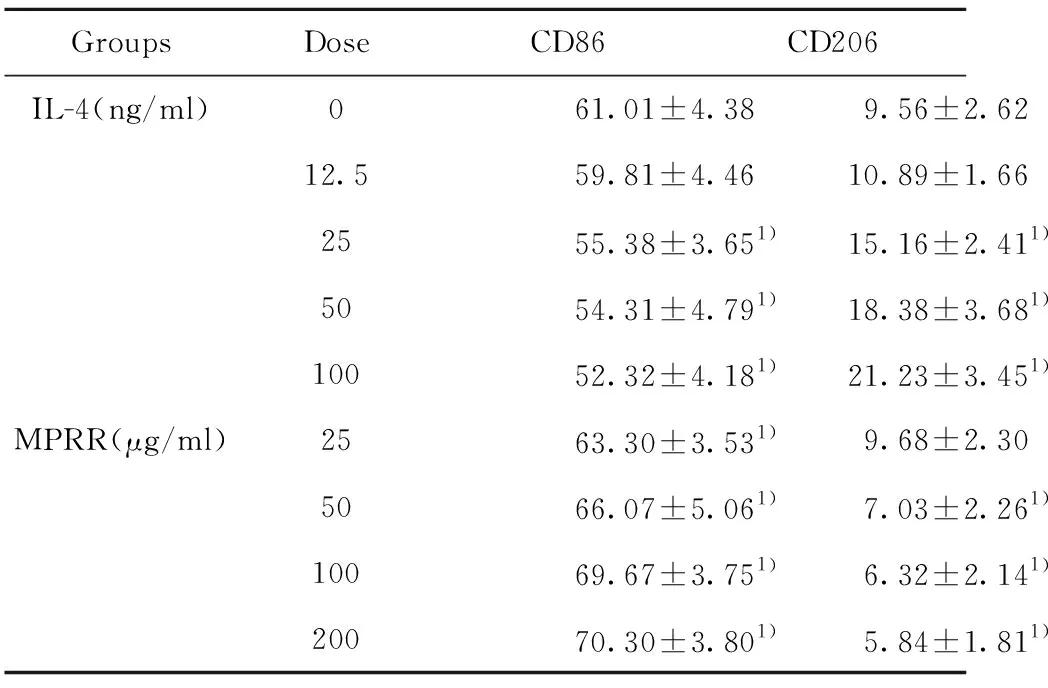
GroupsDoseCD86CD206IL-4(ng/ml)061.01±4.38 9.56±2.6212.559.81±4.4610.89±1.662555.38±3.651)15.16±2.411)5054.31±4.791)18.38±3.681)10052.32±4.181)21.23±3.451)MPRR(μg/ml)2563.30±3.531)9.68±2.305066.07±5.061)7.03±2.261)10069.67±3.751)6.32±2.141)20070.30±3.801)5.84±1.811)
Note:Compared with IL-4 0 ng/ml,1)P<0.05.
如图1所示,采用免疫印迹法分析转录因子STAT-6表达和磷酸化的变化。各组细胞STAT-6表达无明显变化;M0组STAT-6磷酸化极低,与M0组比较,M2组细胞STAT-6磷酸化显著增强;与M2组比较,再极化组磷酸化STAT-6(Tyr641)明显下降。
2.3M2极化巨噬细胞再极化后吞噬功能分析 收集不同条件诱导后巨噬细胞,检测M0组、M2组、MPRR组和Rp组细胞对荧光微球的吞噬,结果见表3。与M0组比较,M2极化组吞噬率下降(P<0.05),MPRR组吞噬效应增强(P<0.05);再极化组(Rp)的吞噬效应强于M2极化组(P<0.05)。
2.4流式细胞术检测巨噬细胞条件培养上清中IFN-γ和TGF-β的水平 收集不同条件诱导后巨噬细胞的培养上清,检测M0组、M2组、MPRR组和Rp组IFN-γ和TGF-β的浓度。与M0组比较,M2极化组IFN-γ表达减少(P<0.05)和TGF-β表达增加(P<0.05),MPRR组IFN-γ表达增加而TGF-β表达减少(P<0.05);与M2极化组比较,再极化组IFN-γ和TGF-β的表达均增加(P<0.05),见表4。



GroupsCD86CD206M061.77±4.799.78±1.36M254.64±3.711)17.64±2.381)MPRR68.88±3.591)6.72±1.561)Rp61.26±3.302)10.51±1.712)
Note:Compared with M0 group,1)P<0.05;compared with M2 group,2)P<0.05.

图1 MPRR对M2极化细胞STAT-6表达和磷酸化的影响Fig.1 Effect of MPRR on expression and phosphorylation of STAT-6 in M2-polarized cells

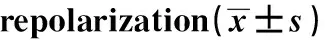

GroupsIFN-γM062.6±4.8M253.3±5.41)MPRR71.5±6.61)Rp65.1±7.62)
Note:Compared with M0 group,1)P<0.05;compared with M2 group,2)P<0.05.
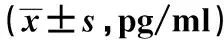


GroupsIFN-γTGF-βM0514.8±21.6115.0±14.4M2249.4±26.31)245.4±25.91)MPRR591.6±25.21)90.6±12.81)Rp434.1±31.72)327.1±29.72)
Note:Compared with M0 group,1)P<0.05;compared with M2 group,2)P<0.05.
2.5巨噬细胞不同条件培养上清液对小鼠乳腺癌细胞增殖的影响 以新鲜培养液为对照,MTT还原法检测不同的条件培养上清对4T1细胞生长的影响。M0组OD值为1.072±0.093,M2组OD值为1.482±0.086,MPPR组OD值为0.955±0.057,Rp组OD值为1.243±0.063。与M0组比较,M2组上清液OD值升高,MPPR组上清液OD值指标下降(P<0.05);与M2组比较,Rp组上清液OD值下降(P<0.05)。
3 讨论
体内微环境中巨噬细胞可发生表型极化,而其功能也因不同极化而变化。静息或未分化状态的巨噬细胞(M0)可在 IFN-γ(活化Th1分泌)和LPS 诱导下向 M1 型转变,转录因子STAT-1、NF-κB和AP-1转位入核,调节IL-1、IL-6、IL-12、TNF-α、IFN-γ、一氧化氮合酶和多种趋化因子产生,其细胞膜CD40、CD80和CD86的表达增强。M1型巨噬细胞通过募集DC、NK和Th1,增强对病原体和肿瘤的免疫应答,NO和IFN-γ参与对肿瘤细胞和病原体的杀伤[6,7]。IL-4和IL-13(Th2等分泌)等细胞因子均可促进M2极化,M2高表达CD206、精氨酸酶 1(arginase 1,Arg1),分泌TGF-β、IL-4、IL-10、表皮生长因子(epidermal growth factor,EGF)和VEGF等,促进细胞生长和组织修复,促进Th2细胞介导的免疫。依据刺激物和功能不同,M2极化被细分为 M2a、M2b 和 M2c,M2a为Th2样细胞因子诱导,是最早阐述的M2型极化[8]。M2b和M2c被称为M2样极化,Toll样受体(或IL-1受体)信号与免疫复合物诱导M2b极化,而IL-10和TGF-β或糖皮质激素诱导M2c极化[9]。就细胞表面标志而言,巨噬细胞M1极化后CD40、CD80和CD86的表达增强;而M2极化表型通常伴随CD206表达增加[10]。
M1和M2极化受到细胞内复杂信号的复杂调节。体内细胞因子IFN-γ 主要通过激活JAKs-STATs 信号通路而促进巨噬细胞M1极化,IFN-γ主要激活STAT1[11]。外源性诱导因子细菌脂多糖(lipopolysaccharide,LPS)主要通过TLR4-PI3K-NF-κB 信号通路促进M1极化。炎症刺激、细胞应激和营养成分也可通过转录因子NF-κB促进M1极化,其信号经由PI3K、AKT和mTOR激酶转导。AKT/PKB和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是PI3K下游蛋白激酶分子。AKT即蛋白激酶B(proteinkinase B,PKB)家族有3个成员(AKT1、AKT2和AKT3)。单核细胞内AKT1由PI3K通过髓样细胞白血病-1(myeloid cell leukemia-1)激活,维持巨噬细胞存活,AKT1活化强于AKT2时,巨噬偏向于M2极化[12]。AKT1基因敲除引起M1极化;而AKT2基因敲除引起M2极化。丝/苏氨酸蛋白酶mTOR是偶联能量供给、糖酵解和细胞脂类合成的调节点,结节性硬化复合体1和2(tuberous sclerosis complex,TSC1/2) 对其进行负调节。TSC1/2活性下降,则mTOR复合物1(mTOR complex1,mTORC1)活化加强,巨噬细胞释放炎症性细胞因子增加。蛋白激酶JNK是丝裂原激活蛋白激酶(mitogen-activated protein kinases,MAPKs)超家族成员,肥胖者脂肪组织中JNK激酶活性增强,通过激活转录因子AP-1促进M1极化[13]。Notch 受体(Notch1~4)和配体参与巨噬细胞极化调节,Notch1信号通过促进 NF-κB辅助TLR4促进M1极化。IL-4和IL-13 与巨噬细胞的受体 IL-4Rα结合,主要通过JAK-STAT6 信号通路诱导巨噬细胞M2 极化。STAT6 缺失下,IL-4不能抑制 MIG的表达。STAT6 激活过氧化物酶增殖物激活受体-γ (peroxisome proliferator-activated receptor,PPAR-γ)可促进Arg-1等M2特征性标志物表达。TGF-β也可通过JAK/STAT途径促进 M2极化[14]。概括而言,转录因子STAT6对巨噬细胞M2极化至关重要,STAT6 抑制 STAT1,避免向M1型TAMs活化,抑制促炎细胞因子IFN-γ、TNF-α等产生。STAT6磷酸化激活后,促进干扰素调节因4(interferon regulatory factor 4,IRF4) 转位入核,启动M2相关基因表达。
肿瘤组织中募集了大量巨噬细胞,并趋向M2极化。肿瘤微环境中Th2样细胞因子(IL-4、IL-13和IL-10),诱导TAM向M2极化,乳腺癌、卵巢癌肺癌等多种肿瘤细胞也分泌IL-4、IL-10和TGF-β等细胞因子,促进肿瘤组织中TAM向M2极化。研究表明,肿瘤组织中M2型细胞主要富集于缺氧区域,M1 型巨噬细胞则位于常氧区域。低氧诱导因子2α(hypoxia inducible factor 2α,HIF2α)参与实体瘤TAM诱导,TAM具有M2特征,不仅Arg1酶表达增加,NO等自由基减少,且VEGF、EGF和MMP-9表达增加[15]。肿瘤相关的表观遗传学变化和代谢产物参与巨噬细胞极化的调节,在缺氧的TAE中,巨噬细胞和肿瘤可发生代谢重编程,更多地依赖有氧糖酵解将葡萄糖转换为能量。肿瘤细胞的有氧糖酵解可低效提供ATP,并伴随乳酸等代谢产物增加,但代谢产物促进细胞骨架、蛋白和脂质的合成,有利于肿瘤细胞生长[16]。肿瘤微环境中TAM和癌细胞具有相似的表观遗传学变化,糖酵解形成的乳酸等产物可通过多种表观遗传学效应促进M2极化,主要包括DNA甲基化、组蛋白修饰和非编码RNA调控[17]。甲基化转移酶(methyltransferase,DNMT)催化DNA与甲基基团共价结合,肿瘤组织细胞和TAM均发现因DNMT1、DNMT3a和DNMT3b表达下降,而导致DNA低甲基化,进而促进M2极化。组蛋白修饰主要包括其甲基化、泛素化、乙酰化、磷酸化和ADP-核糖基化等,组蛋白甲基化Smyd2通过减少抑制IL-6和TNF-α表达,抑制M1极化;多种组蛋白修饰可通过促进Th2样细胞因子表达使TAM向M2极化。
减少或逆转TAM向M2型极化,对抑制肿瘤侵袭与转移有重要意义。尽管巨噬细胞极化信号转导复杂,TAM向M2极化主要受Th2样细胞因子、代谢重编程和表观遗传机制的影响,理论而言是可逆转和可调节的。有学者提出,M2b和M2c是M1型向M2型转化的过度,通过促进M1极化可减少M2极化。免疫调节是真菌和植物多糖重要的药理学活性。Th2和M2型巨噬细化参与哮喘发病,富含多糖的中药汤剂炙甘草汤和四君子汤等常用于哮喘的治疗,伴随症状缓解,可发现局部组织中STAT6磷酸化减少[18,19]。前期工作中提取并分离不同分子量的水溶性炙甘草多糖,发现水溶性炙甘草的中等分子量多糖(MPRR)具有较强活化巨噬细胞的作用,能促进IFN-γ释放,减少TGF-β释放。为进一步研究MPRR是否可逆转M2极化,本研究采用IL-4诱导小鼠RAW264.7 巨噬细胞,M2极化细胞IFN-γ分泌减少,CD86表达下降;而TNF-β分泌增加,CD206表达增加;将MPRR用于M2极化的巨噬细胞可减少CD206表达,促进CD86表达,增加IFN-γ分泌而减少TNF-β分泌。对STAT6表达和磷酸化分析,IL-4 促进STAT6(pTyr641),而MPRR可减少M2极化细胞内STAT6磷酸化。概括而言,MPRR可逆转IL-4诱导的M2极化。MPRR也参与对巨噬细胞极化后吞噬功能的调节,其单独作用促进巨噬细胞吞噬功能,诱导M2极化细胞再极化后也伴随对其吞噬效应的增强。
肿瘤局部Th2通过释放细胞因子促进癌细胞生长,而M2极化TAM不仅增加Th2样细胞因子来源,并可通过MMP-9和VEGF等促进血管和淋巴管重塑;乳腺癌等肿瘤可释放IL-10和TGF-β,参与肿瘤微环境中Th2偏移和TAM 向M2极化。除免疫细胞外,上皮细胞或乳腺癌等上皮源性肿瘤细胞也表达IL-4、IL-10和TGF-β等细胞因子的受体,Th2和M2极化细胞的旁分泌效应可促进癌细胞的生长[20]。本研究表明,M2极化巨噬细胞的培养上清液可促进小鼠4T1乳腺癌细胞增殖,而MPRR诱导组巨噬细胞的旁分泌作用对其生长有抑制作用;MPRR逆转M2(IL-4诱导)极化后,也减弱其旁分泌促进乳腺癌细胞生长的效应。减少肿瘤微环境中M2型极化对减少炎-癌间的互相促进有重要意义。
概括而言,采用真菌和植物多糖不能直接杀伤肿瘤细胞,提示其可能通过对巨噬细胞 TAM极化的调节而一定程度改变有利肿瘤细胞生存的微环境。体内真实的肿瘤微环境中多种免疫细胞、组织细胞和肿瘤细胞自身均可分泌细胞因子,影响免疫细胞分化和肿瘤细胞表型。在体外研究的基础上,尚需要通过体内研究来证实其免疫调节的活性。
