miR-195-5p靶向调控ELMO2抑制IL-17诱导的胃癌细胞AGS侵袭和迁移
2020-06-06张丽翠朱美意石河子大学医学院第一附属医院普外三科石河子832000
钟 晨 张丽翠 朱美意 (石河子大学医学院第一附属医院普外三科,石河子 832000)
胃癌分子发生机制十分复杂,其与胃癌中异常表达的基因有关,这些基因参与调控胃癌细胞恶性转移,研究胃癌分子发生机制对于胃癌的治疗具有重要意义[1]。IL-17是一种促炎因子,其由多种细胞分泌,在肿瘤进展中发挥关键作用[2]。研究显示,IL-17在肿瘤患者中高表达,IL-17促进肿瘤细胞恶性转移,IL-17是构成肿瘤微环境的重要组成部分[3]。miRNA与细胞的生长、运动以及组织代谢等有关,是一个多功能非编码RNA[4]。miRNA还与肿瘤的发生有关,其在肿瘤组织中异常表达往往与肿瘤患者的淋巴结转移、病理分期等密切相关[5]。miR-195-5p属于miR-15家族,其在多数肿瘤组织中起到抑癌基因的作用,对于骨肉瘤、肺癌、胃癌等肿瘤细胞的侵袭和迁移能力具有抑制作用[6-8]。研究报道显示,miR-195-5p参与IL-17促进子宫内膜癌细胞转移过程,IL-17可以诱导子宫内膜癌细胞中miR-195-5p表达下调[9]。本次实验以胃癌细胞AGS为研究对象,探讨miR-195-5p在IL-17诱导的胃癌细胞侵袭和迁移中的作用和靶向调控机制,以期为胃癌的治疗提供潜在靶点,为研究胃癌分子发生机制提供参考。
1 材料与方法
1.1材料 胃癌细胞AGS购自南京科佰生物科技有限公司;IL-17购自碧云天生物技术研究所;mimics control、miR-195-5p mimics由上海吉玛制药技术有限公司合成;Vimentin抗体购自美国Santa Cruz Biotechnology公司;Lipofectamin 2000、吞噬细胞运动蛋白2(engulfment and cell motility 2,ELMO2)抗体购自美国invitrogen公司;E-cadherin抗体购自美国 Cell Signaling Technology公司;引物由北京优博兰基因技术有限公司合成;pcDNA3.1-ELMO2、pcDNA3.1购自元生物技术(上海)股份有限公司。
1.2方法
1.2.1细胞转染和分组处理 胃癌细胞AGS分成Control、IL-17、IL-17+miR-NC 、IL-17+miR-195-5p共4组,IL-17、IL-17+miR-NC 、IL-17+miR-195-5p组细胞分别用含有100 μg/L的IL-17细胞培养液培养;IL-17+miR-NC、IL-17+miR-195-5p细胞分别为转染mimics control、miR-195-5p mimics的胃癌细胞AGS;Control细胞为不转染正常培养的对照细胞。细胞转染试剂用Lipofectamin 2000,细胞密度为80%时进行细胞转染,转染具体操作同转染试剂说明书。
1.2.2qRT-PCR方法测定细胞中miR-195-5p表达 Control、IL-17、IL-17+miR-NC、IL-17+Anti-195-5p组细胞分别按照1.2.1中方法处理培养24 h以后,用qRT-PCR方法检测miR-195-5p表达。步骤如下:Trizol试剂提取细胞总RNA,去除DNA。配制反转录体系,包含:杂2 μl的RT Enzyme Mix、2 μl的10×Fast RT Buffer、2 μl的FQ-RT Primer Mix,添加Rnase-Free ddH2O至10 μl,放在42℃孵育15 min,然后放在95℃孵育3 min后放在冰上用于qRT-PCR反应。PCR反应体系为:0.4 μl的上下游引物、1 μl的第一链cDNA、10 μl的2×miRcute miRNA premix(with SYBR ROX),添加RNase-Free ddH2O至20 μl。PCR程序为:94℃孵育2 min,94℃孵育20 s,60℃孵育34 s。根据反应得到的CT值采用2-△△CT法分析目的基因miR-195-5p的表达变化。引物序列如下:miR-195-5p上游5′-CGGGATCCACATCTGGGGCCTTGTGA-3′,下游5′-CCCAAGCTTGCTTCGTGCTGTCTGCTT-3′;内参U6上游5′-TCCGATCGTGAAGCGTTC-3′,下游5′-GTGCAGGGTCCGAGGT-3′。
1.2.3Transwell小室测定细胞侵袭和迁移能力变化 收集对数生长期的胃癌细胞,按照Control、IL-17、IL-17+miR-NC 、IL-17+miR-195-5p分组方法处理细胞,然后将细胞用不含血清的细胞培养液悬浮并添加到Transwell小室的上室中,每组细胞添加200 μl,在小室的下室中添加含有血清的细胞培养液,放在37℃,5%CO2培养箱中培养24 h。取出小室,用PBS溶液洗涤,以棉签将没有穿过膜的细胞擦掉,放在95%的甲醇溶液中浸泡20 min,以PBS洗涤3次,0.2%的结晶紫溶液染色20 min。在显微镜下计数穿膜细胞即为细胞迁移数目。细胞侵袭实验前用Matrigel将小室湿化,其余步骤同迁移实验。
1.2.4Western blot测定细胞中E-cadherin、Vimentin蛋白表达水平 收集培养24 h以后的Control、IL-17、IL-17+miR-NC 、IL-17+miR-195-5p组细胞,以预冷后的PBS溶液将细胞洗涤3次,然后用移液器把残留的液体吸弃。添加RIPA蛋白裂解试剂,放在冰上孵育15 min,以细胞刮子收集细胞,4℃,12 000 r/min离心10 min,收集上清,用BCA法测定蛋白浓度。把蛋白样品与1/4体积的5×Loading Buffer混合煮沸5 min后放在冰上备用。分别配制并灌注12%的分离胶以及5%的浓缩胶。在上样孔中分别添加30 μg变性蛋白样品,在80 V恒压条件下电泳40 min以后,观察染料进入到分离胶,然后将电压改为120 V继续电泳至染料跑出凝胶。取PVDF膜于甲醇中孵育1 min,然后放在转移缓冲液中浸泡10 min。于90 V电压条件下转膜50 min。把PVDF膜放在含有5%牛血清白蛋白的封闭液中封闭1 h,然后将PVDF膜放在提前稀释好的一抗溶液中,在4℃条件下孵育过夜。最后将PVDF膜放在辣根过氧化物酶标记后的二抗溶液中,在37℃孵育1 h。用BeyoEcL Plus显色试剂盒显色。用图像分析软件Image J分析条带的灰度值,GAPDH为参照,分析目的蛋白相对表达量。
1.2.5靶基因预测和鉴定 利用TargetScan和DIANA micro T生物信息学软件预测miR-195-5p的靶基因,发现ELMO2的3′UTR端与miR-195-5p有互补结合位点。分别构建荧光素酶报告载体,载体由湖南普拉特泽生物科技有限公司构建。利用Lipofectamin 2000分别把含有ELMO2的3′UTR端结合位点的WT和突变后ELMO2的3′UTR端结合位点的MUT转染到胃癌细胞AGS,细胞培养48 h以后,用荧光素酶活性测定试剂盒检测各细胞荧光素酶活性变化。
1.2.6pcDNA3.1-ELMO2对上调miR-195-5p的细胞侵袭和迁移影响 利用Lipofectamin 2000分别把pcDNA3.1-ELMO2、miR-195-5p mimics和阴性对照载体pcDNA3.1、miR-195-5p mimics共转染到胃癌细胞AGS中,并用含有100 μg/L的IL-17细胞培养液培养,命名为IL-17+miR-195-5p+vector 、IL-17+miR-195-5p+ELMO2组。细胞培养24 h以后,用Transwell小室测定细胞侵袭和迁移数目(步骤参照1.2.3),Western blot测定E-cadherin、Vimentin、ELMO2蛋白表达(步骤参照1.2.4)。

2 结果
2.1miR-195-5p mimics上调IL-17条件下胃癌细胞中miR-195-5p表达水平 IL-17处理后的胃癌细胞中miR-195-5p表达水平下降,转染miR-195-5p mimics后的胃癌细胞经IL-17处理后,细胞中miR-195-5p表达水平升高。见表1。miR-195-5p mimics上调IL-17条件下胃癌细胞中miR-195-5p表达水平。
2.2上调miR-195-5p抑制IL-17诱导的胃癌细胞侵袭和迁移 IL-17处理后的胃癌细胞侵袭数目和迁移数目均升高,细胞中E-cadherin蛋白表达水平下降,Vimentin蛋白表达水平升高;转染miR-195-5p mimics后的胃癌细胞经过IL-17处理以后,细胞侵袭数目和迁移数目下降,细胞中E-cadherin蛋白表达水平升高,Vimentin蛋白表达水平下降,见图1和表2。上调miR-195-5p抑制IL-17诱导的胃癌细胞侵袭和迁移。

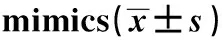

GroupsmiR-195-5pControl1.00±0.09IL-170.64±0.061)IL-17+miR-NC0.65±0.08IL-17+miR-195-5p1.26±0.142)F85.65P<0.001
Note:Compared with Control,1)P<0.05;compared with IL-17+miR-NC,2)P<0.05.
2.3miR-195-5p靶向调控ELMO2 ELMO2的3′UTR端与miR-195-5p有互补结合位点,并且WT和miR-195-5p mimics共转染后的胃癌细胞荧光素酶活性下降,见图2和表3。miR-195-5p靶向调控ELMO2。
2.4上调miR-195-5p降低IL-17条件下胃癌细胞中ELMO2蛋白表达 IL-17处理后的胃癌细胞中ELMO2蛋白表达水平升高;转染miR-195-5p mimics后的胃癌细胞经过IL-17处理以后,细胞ELMO2蛋白表达水平下降,见图3和表4。上调miR-195-5p降低IL-17条件下胃癌细胞中ELMO2蛋白表达水平。

图1 Western blot方法测定上调miR-195-5p对IL-17诱导的胃癌细胞中E-cadherin、Vimentin蛋白表达影响Fig.1 Western blot analysis of effect of up-regulating miR-195-5p on expression of E-cadherin and Vimentin in IL-17-induced gastric cancer cellsNote:1.Control;2.IL-17;3.IL-17+miR-NC;4.IL-17+miR-195-5p.



GroupsInvasionnumberMigrationnumberE-cadherinVimentinControl78.32±7.54 96.47±9.55 0.85±0.080.42±0.05IL-17160.24±13.191)179.24±14.521) 0.55±0.061)0.75±0.071)IL-17+miR-NC159.45±12.08 177.86±15.48 0.56±0.050.74±0.06IL-17+miR-195-5p85.75±6.362)108.77±10.292) 0.78±0.092) 0.50±0.052)F174.49108.3140.8375.09P<0.001<0.001<0.001<0.001
Note:Compared with Control,1)P<0.05;compared with IL-17+miR-NC,2)P<0.05.

图2 ELMO2与miR-195-5p互补结合位点Fig.2 Complementary binding sites of ELMO2 and miR-195-5p
2.5pcDNA3.1-ELMO2促进上调miR-195-5p的胃癌细胞侵袭和迁移 与共转染miR-195-5p mimics和对照载体pcDNA3.1后的胃癌细胞比较,共转染miR-195-5p mimics和pcDNA3.1-ELMO2后的细胞经过IL-17诱导处理以后,细胞侵袭数目和迁移数目增多,细胞中E-cadherin蛋白水平降低,Vimentin、ELMO2蛋白水平升高,见图4和表5。pcDNA3.1-ELMO2促进转染miR-195-5p mimics后的胃癌细胞侵袭和迁移。


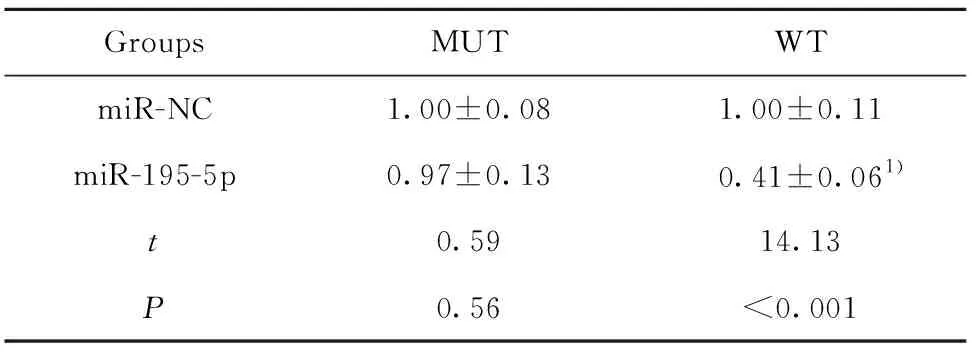
GroupsMUTWTmiR-NC1.00±0.081.00±0.11miR-195-5p0.97±0.130.41±0.061)t0.5914.13P0.56<0.001
Note:Compared with miR-NC,1)P<0.05.

图3 Western blot测定上调miR-195-5p对IL-17诱导的胃癌细胞中ELMO2蛋白表达影响Fig.3 Western blot analysis of effect of miR-195-5p on expression of ELMO2 protein in IL-17-induced gastric cancer cellsNote:1.Control;2.IL-17;3.IL-17+miR-NC;4.IL-17+miR-195-5p.
2.6pcDNA3.1-ELMO2促进上调miR-195-5p的胃癌细胞侵袭和迁移 与共转染miR-195-5p mimics和对照载体pcDNA3.1后的胃癌细胞比较,共转染miR-195-5p mimics和pcDNA3.1-ELMO2后的细胞经过IL-17诱导处理以后,细胞侵袭数目和迁移数目增多,细胞中E-cadherin蛋白水平降低,Vimentin蛋白水平升高,见图5和表6。pcDNA3.1-ELMO2促进转染miR-195-5p mimics后的胃癌细胞侵袭和迁移。


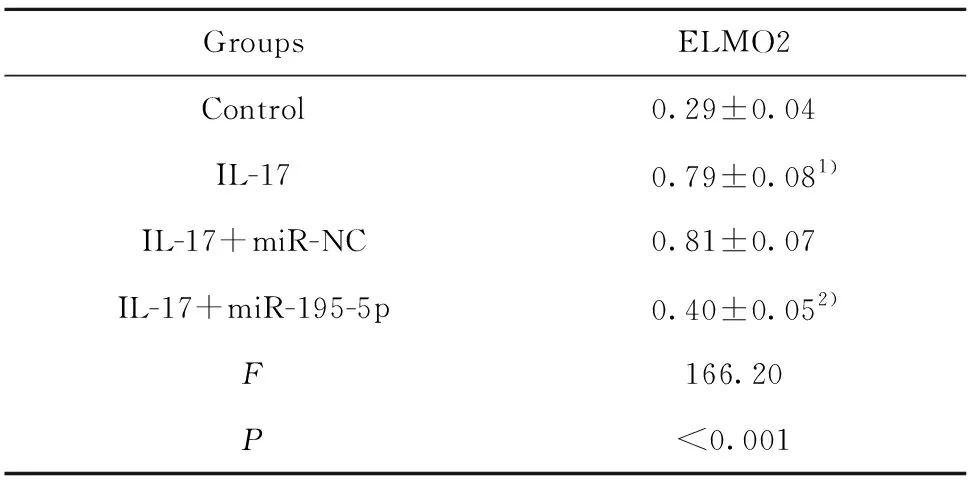
GroupsELMO2Control0.29±0.04IL-170.79±0.081)IL-17+miR-NC0.81±0.07IL-17+miR-195-5p0.40±0.052)F166.20P<0.001
Note:Compared with Control,1)P<0.05;compared with IL-17+miR-NC,2)P<0.05.

图4 Western blot测定pcDNA3.1-ELMO2对上调miR-195-5p的胃癌细胞中E-cadherin、Vimentin、ELMO2表达影响Fig.4 Effect of pcDNA3.1-ELMO2 on expression of E-cadherin,Vimentin and ELMO2 in gastric cancer cells up-regulating miR-195-5p by Western blotNote:1.IL-17+miR-195-5p+vector;2.IL-17+miR-195-5p+ELMO2.

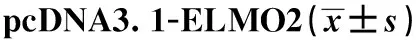

GroupsInvasion numberMigration number E-cadherinVimentinELMO2IL-17+miR-195-5p+vector86.86±7.54110.59±11.230.74±0.080.54±0.070.41±0.06IL-17+miR-195-5p+ELMO2122.79±10.271)166.48±15.201)0.49±0.051)0.89±0.091)0.83±0.071)t8.468.877.959.2113.67P<0.001<0.001<0.001<0.001<0.001
Note:Compared with IL-17+miR-195-5p+vector,1)P<0.05.
3 讨论
IL-17是主要由Th17细胞分泌的促炎因子,其在肿瘤中可以促进血管生成和肿瘤转移[10]。IL-17在肿瘤患者中高表达,肿瘤患者局部产生的IL-17可以调控肿瘤微环境血管形成,阻断IL-17是肿瘤治疗的一种新策略[11]。研究报道证实,IL-17可以明显促进胃癌细胞的迁移和侵袭[12]。实验结果表明,IL-17处理后的胃癌细胞侵袭和迁移能力升高,细胞上皮标志蛋白E-cadherin表达减少,间质标志蛋白Vimentin表达水平升高,说明IL-17可以诱导胃癌细胞转移,这与上述研究结果相一致。
miRNA进化极为保守,属于多功能调控因子,其可以通过影响下游基因或信号的转导参与细胞生长、分化以及胚胎发育、能量代谢等过程[13]。很多研究证实,疾病的发生与miRNA异常表达有关,靶向调控miRNA的表达可能是疾病治疗的途径[14]。miR-195-5p仅在哺乳动物中表达,其基因定位在17pl3.1染色体上,miR-195-5p在不同的组织以及疾病进展中的作用靶点不同,生物学功能也不相同[15]。研究表明,miR-195-5p在前列腺癌、胃癌等肿瘤中表达下调,miR-195-5p表达下降能够促进肿瘤转移[8,16]。在子宫内膜癌中发现,miR-195-5p参与调控IL-17诱导的子宫内膜癌细胞转移过程[9]。我们的实验显示,IL-17处理后的胃癌细胞中miR-195-5p表达水平下调,上调miR-195-5p可以抑制IL-17诱导的肿瘤细胞侵袭和迁移。我们的结果表明,IL-17可以降低胃癌细胞中miR-195-5p表达水平,并且上调miR-195-5p可以降低IL-17诱导的胃癌细胞侵袭和迁移能力,这说明miR-195-5p在IL-17诱导的胃癌细胞侵袭和迁移中扮演抑制作用,这与上述研究结果相符合,说明miR-195-5p参与IL-17诱导的肿瘤细胞转移。
miRNA靶基因有多个,这也是其功能多样的重要原因[17]。不同组织不同生理或病理过程中miRNA的靶基因可能不同,并且同一个miRNA可能同时调控多个靶基因[18-20]。我们的实验显示,miR-195-5p靶向负调控胃癌细胞中ELMO2的表达。ELMO2是ELMO蛋白家族成员,其是由727个氨基酸组成的支架蛋白,可以同多个蛋白质相互结合从而发挥不同的生物学作用[21,22]。ELMO2参与细胞吞噬、侵袭和迁移,与肿瘤发生有关[23]。研究显示,ELMO2在胃癌中表达上调,下调其表达可以抑制胃癌细胞的侵袭和迁移[24]。本实验结果表明,ELMO2可以逆转miR-195-5p对IL-17诱导的胃癌细胞侵袭迁移的抑制作用,提示miR-195-5p通过靶向抑制ELMO2表达发挥抗IL-17诱导的胃癌细胞侵袭和迁移作用。
综上,miR-195-5p参与IL-17诱导的胃癌转移过程,其可以抑制IL-17诱导的胃癌细胞侵袭和迁移,作用机制与靶向调控ELMO2有关。本次实验结果为研究miR-195-5p在胃癌进展和肿瘤微环境中的调控机制提供了参考,为基因治疗胃癌提供了可能。
