肾癌DC-CIK免疫治疗对相关细胞因子的影响①
2020-06-06尹秀艳刘婉露祁丽丽牡丹江医学院附属红旗医院牡丹江157011
李 悦 尹秀艳 刘婉露 祁丽丽 (牡丹江医学院附属红旗医院,牡丹江 157011)
近年来,恶性肿瘤的发病率呈不断上升趋势,每年以2%~3%的速度增长,预计到2020年,全球患恶性肿瘤的人数将高达2 000万,致死率将达60%[1,2]。恶性肿瘤具有生长快、易出血、易复发等特点,目前治疗方式主要是手术切除、化疗、放疗、靶向药物治疗、免疫治疗以及中医中药治疗[3,4]。
肾癌是泌尿系统常见恶性肿瘤,初诊时就有约20%患者发生转移,约30%患者在术后发生转移[5]。肾癌是强免疫性肿瘤,术后干预是重要的辅助治疗手段,免疫治疗是肾癌术后干预的主要手段[6]。研究发现,IFN和IL-2对肾癌的转移有效,但治愈率偏低,并不能有效延长患者的生存期[7]。如何降低肾癌术后复发率,改善患者预后,一直是肾癌治疗的棘手问题[8]。研究发现DC-CIK细胞免疫治疗法对肾癌术后的辅助治疗具有很好的疗效[9]。
树突状细胞(dendritic cells,DCs)是人体内功能最强大的抗原呈递细胞(antigen presenting cells,APC),诱导抗原特异性细胞T淋巴细胞(cytotoxic T lymphocyte,CTL)形成,提高人体免疫力[10]。细胞因子诱导的杀伤细胞(cytokine induced killer cells,CIK)是体外通过多种细胞因子培养人外周血中单个核细胞从而获得的一群异质细胞,具有T淋巴细胞的强大抗肿瘤活性,同时具有非限制性杀伤肿瘤的特点[11]。体内回输免疫活细胞的免疫疗法是肾癌肿瘤治疗中重要的辅助治疗方法[12]。肾癌术后,在患者体内回输DC和CIK细胞,能够产生大量T淋巴细胞,增加机体免疫力,杀伤肿瘤细胞,达到对肾癌的术后干预治疗,抑制肿瘤细胞复发[13]。DC和CIK是免疫治疗的两个部分,前者是通过刺激T淋巴细胞的产生,使机体获得免疫能力,后者是通过自身的细胞毒性和分泌细胞因子杀伤肿瘤细胞,将二者有效结合,能够产生双重免疫疗效[14]。
目前研究认为,抗肿瘤免疫治疗的基础是产生T细胞介导的免疫应答反应,而在控制免疫原性肿瘤细胞的生长中,CD8+T淋巴细胞是产生免疫应答反应的主要细胞,CD4+T细胞主要是通过分泌各种细胞因子来辅助、诱导并激活CD8+CTL细胞,CD3+T细胞是CIK细胞的主要异质细胞群[15]。免疫应答反应中CD8+是抑制性T细胞,抑制免疫应答,CD4+是辅助性T细胞,而CD3+则为成熟T细胞[16]。因此,检测肾癌患者外周血T细胞亚群的变化和体内细胞因子含量的变化对了解机体的免疫功能状况具有重要作用。
1 资料与方法
1.1资料 术后随访我院2016年9月到2018年9月确诊的60例肾癌患者,年龄32~78岁,平均年龄(49.3±7.5)岁,男34例,女26例。其中开放手术30例,腹腔镜手术30例;肾癌根治性切除手术42例,保留肾单位手术18例。按照国际抗癌联盟(UICC)对肿瘤的TNM分期标准,60例患者中T1N0M0期患者38例,T2N0M0期患者22例;左侧肾癌28例,右侧肾癌31例,双侧肾癌1例。对其进行DC-CIK细胞免疫治疗前,对患者的腹部B超、胸部和腹部CT、肝功和肾功检测、血常规和尿常规、外周血淋巴细胞亚群以及外周血相关细胞因子等情况进行评估。在患者身体确定无任何异常后,进行DC-CIK细胞免疫治疗。DC-CIK细胞免疫治疗经医院伦理委员会批准,且患者本人知情同意。
1.2方法
1.2.1采血 对参加免疫疗法的患者进行造血动员,坚持服用GM-CSF(粒细胞-巨噬细胞集落刺激因子,沙格司亭)75 g,2次/d。实时监测外周血白细胞情况,当淋巴细胞和单核细胞数量之和达到2×109/L时采血,采血量约100 ml。
1.2.2DC诱导培养 Ficoll法分离外周血单个核细胞(PBMC),RPMI1640培养基中2×106个/ml重悬。37℃孵育90 min,加入10%的AB血清(100 ng/ml rhGM-CSF和50 ng/ml rhIL-4)并洗去未贴壁细胞。继续培养3 d后,换掉1/3的细胞培养液,及时补充细胞因子。第5天,用10%的AB血清重悬RPMI1640培养基,细胞浓度调整为1×106个/ml,按照DC与抗原浓度比例3∶1 加入肿瘤细胞抗原,共培养24 h,加入细胞因子IL-1β、IL-6、PGE-2和TNF-α,终浓度分别为10 ng/ml、20 ng/ml、0.5 ng/ml、10 ng/ml。诱导24 h。将成熟的DC细胞重悬到2 ml生理盐水中,4℃保存用于后续注射。
1.2.3DC细胞注射 在腹股沟大腿内侧两侧注射1 ml DC细胞悬液,每周1次,连续注射两周。每次注射完成后,观察45 min,无任何异常后方能离开。
1.2.4CIK细胞诱导培养 将外周血中没有贴壁生长的单个核细胞收集后,用10%AB血清重悬到RPMI1640培养基中,细胞浓度为2.5×106个/ml。铺到含有anti-CD3mAb和IFN-γ(1 000 U/ml)的培养瓶中,置于37℃、5%CO2培养箱中孵育。第2天,添加生长因子IL-1α(10 ng/ml)和IL-2(250 U/ml)继续培养。第3天,实时添加RPMI1640培养液并观察细胞状态。
1.2.5CIK回输方案 每次CIK回输前24 h,检测CIK细胞,确定无污染后,将CIK细胞培养7~11 d,离心收集细胞。生理盐水洗涤3次后,用含有患者10%血浆的生理盐水重悬细胞,总体积约100 ml,2 h内通过静脉滴注的方式将其回输给患者,确保每次回输细胞数约(5.0±0.5)×108个,每个患者共滴注5次。
1.2.6相关指标评估 ①相关免疫功能指标检测:在治疗前一周和治疗后两周,采取患者外周血,用流式细胞仪法和酶联免疫吸附法(ELISA法)分别检测患者T淋巴细胞亚群和相关细胞因子的含量。②肝功和肾功指标检测:分别于治疗前和治疗后检测患者肝功和肾功常规指标的变化。③生活质量评估:按照Kamofsky评分标准评估患者治疗前和治疗后的生活质量情况,评分标准为:100分,正常,无症状;90分,基本正常,有轻微症状;80分,勉强正常,有一些症状;70分,生活勉强自理,但是已经无法维持正常生活;60分,生活大部分还可以自理,但是偶尔需要别人帮助;50分,生活大部分都需要别人照顾;40分,生活不能自理,需要别人的照顾和帮助;30分,生活已经严重不能自理;20分,病重,需要住院治疗;10分,病危,接近死亡;0分,死亡。④毒副反应观察:治疗期间密切观察患者是否出现不良反应,包括发热、呕吐、皮疹等。

2 结果
2.1外周血中T淋巴细胞亚群百分比 取患者治疗前一周和治疗后两周外周血,测定外周血中T淋巴细胞亚群的百分比,结果如表1所示,CD3+、CD4+T淋巴细胞百分比及CD4+/CD8+比值增高,CD8+T淋巴细胞百分比下降。
2.2外周血中细胞因子含量 取患者治疗前一周和治疗后两周外周血,测定外周血中细胞因子含量变化,结果如表2所示,细胞因子IL-2和IFN-γ的含量增加,IL-10的含量减少。
2.3患者生活质量评估 治疗前,患者Kampfsky评分为(77.63±11.32)分,治疗后患者Kampfsky评分为(85.28±12.57)分,差异具有统计学意义(P<0.05),治疗后患者的生活质量提高。
2.4患者不良反应 治疗过程中,大部分患者无任何不良反应。7例患者出现低热,且都在4 h内自动退热,无高热患者出现。2例患者出现轻微肌肉酸痛,都在耐受范围内,未作特殊处理。1例患者出现血压升高,处理后恢复正常。没有呕吐、肺水肿等情况。
3 讨论
随着医学的发展,越来越多的肾癌患者在早期诊断时就可以发现,但还有20%~30%的患者在早期诊断时就已发生转移,甚至还有相当一部分患者在手术治疗后出现转移[17]。全球每年新增20万左右肾癌患者,病死率为50%~60%[18]。
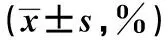


LymphocyteBefore treatmentAfter treatmentP valueCD3+60.2±1.5567.4±0.890.019CD4+26.1±1.2837.6±0.540.026 CD8+25.3±1.7321.6±0.960.031CD4+/CD8+1.04±0.251.74±0.480.012


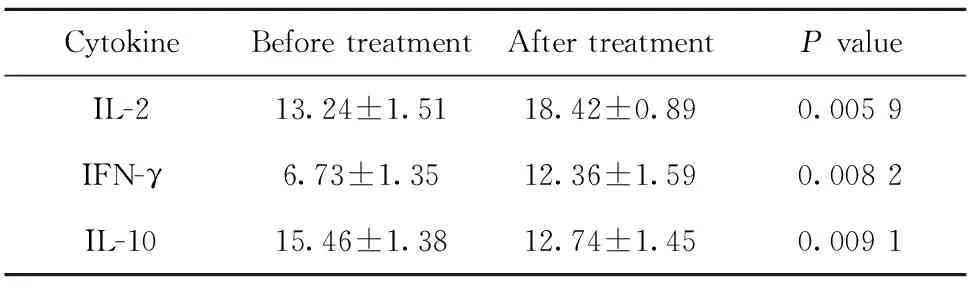
CytokineBefore treatmentAfter treatmentP valueIL-213.24±1.5118.42±0.890.005 9IFN-γ6.73±1.3512.36±1.590.008 2 IL-1015.46±1.3812.74±1.450.009 1
肾癌的治疗主要以外科手术为主,同时,根据进展期肾癌的具体临床特点,再加以细胞因子疗法、放疗、化疗、分子靶向治疗、生物免疫治疗等相应的的辅助治疗[19]。这些方式虽然能够提高患者的存活率,但是副作用大,且复发性强。
DC是指一类具有典型树突状形态,能够移行至淋巴器官并刺激初始型T细胞增殖活化,具有相对特异性表面物质的一类细胞,也是目前体内抗原递呈能力最强的抗原递呈细胞[20]。DC能够分泌多种细胞因子,如IFN-α等,能够诱导CTL,直接或间接影响B淋巴细胞增殖。研究发现DC可能通过以下途径发挥抗肿瘤作用:①吞噬凋亡或坏死细胞;②被活化后的DC,能够表达TNF家族的细胞因子;③直接抑制肿瘤细胞增殖;④增强NK和巨噬细胞杀伤肿瘤细胞的功能[21]。
CIK细胞是由多种细胞因子诱导产生的非特异性杀伤细胞,能够产生大量的细胞因子(如IL-4、IFN等),从而抑制或杀伤肿瘤细胞[22]。CIK细胞还可以促使Fas基因及Fas基因的配体合成[23]。正常情况下,CIK细胞对正常骨髓的细胞毒性小,在机体免疫系统和功能不受到损伤的前提下,CIK细胞还可以直接杀伤肿瘤[24]。
DC和CIK细胞联合培养所产生的细胞群体比单独CIK细胞具有更强的增殖活性,可同时提高DC及CIK细胞的功能[25]。近年来,DC-CIK细胞免疫治疗法应用增多,具有安全、副作用小等优点[26]。
本研究中,患者在输入DC和CIK细胞之前,先采集一份外周血中的单核细胞和淋巴细胞,加入相应的活性因子,分别单独培养扩增,当细胞数量达到相应的数量级后,回输到患者体内;整个治疗期间,DC共注射2次,每周一次,CIK细胞共滴注5次,每隔一天滴注一次;这种输注方式等同于建立了一定量的DC和CIK共培养体系,提高了细胞毒效应,使得机体的先天和后天免疫反应均被启动,提高了杀伤性和特异性,对于肿瘤的转移及复发起到了延缓或阻止作用。因此,本研究中将DC与CIK细胞联合培养应用于肾癌的辅助治疗,发挥协同抗肿瘤作用。本研究结果显示,肾癌患者接受DC-CIK联合细胞疗法后,CD3+、CD4+T细胞增加(P<0.05),CD8+T细胞减少(P<0.05),同时相关的细胞因子IL-2、IFN-γ含量增加(P<0.01),证明DC-CIK细胞免疫疗法能更好地激发机体的免疫应答反应,提高患者免疫力,改善患者生存质量。这种生物免疫疗法毒性低、治疗效果好,是未来抗肿瘤治疗的重要发展方向。
但是,本研究仍然面临很多问题。第一,所有患者都采用同一套实验方法,对于特殊患者来说,有效率可能大大降低。在将来的研究中,应该思考如何根据患者的肿瘤细胞特征,确定个体化免疫治疗方案。第二,对患者生存质量评估,主要是实地观察,患者及患者家属的访谈,带有一定不确定性,具有误差。在将来的研究中,应该设计更为缜密的实验方案,降低误差。
