合成己酸乙酯酯化酶产生菌的鉴定及产酶条件优化
2020-05-24许春艳孙宝国徐友强范光森李秀婷
许春艳 孙宝国 徐友强 范光森 李秀婷*
(1 北京食品营养与人类健康高精尖创新中心 北京工商大学 北京100048 2 北京工商大学食品与健康学院 北京100048 3 北京市食品风味化学重点实验室(北京工商大学)北京100048)
己酸乙酯是浓香型白酒的主体风味物质,是评价白酒质量高、低的重要指标之一[1]。白酒中的己酸乙酯在化学和酶的作用下均可以合成,主要是通过酯化酶催化己酸和乙醇合成[2-3]。酶法合成具有反应条件温和,转化率高,酶可重复利用,产品风味柔和,香醇自然等优点,具有重要的研究意义和应用价值。据报道,细菌、霉菌、酵母的许多种属均能分泌催化合成己酸乙酯的胞外酯化酶[4]。红曲霉和根霉具有较强的己酸乙酯合成能力[5]。红曲霉中的紫色红曲霉和烟色红曲霉酯化己酸和乙醇合成己酸乙酯的能力很强[6-7],有助于缩短白酒的生产周期,提高优质品率。
红曲霉(Monascus purpureus Went)属于真菌界、子囊菌门、真子囊菌纲、散子囊菌目、红曲菌科、红曲菌属的菌种[8],其代谢产物丰富,如:红曲色素,广泛应用于食品着色[9]。Monacolin K,具有降低胆固醇和降血压的功能,广泛应用于医药领域[10]。酯化酶,具有酯化己酸和乙醇合成己酸乙酯的能力,可催化浓香型白酒生产副产物黄水和尾酒中的酸和醇发生酯化反应,得到己酸乙酯含量较高的香酯液,应用于浓香型白酒调香中[6,11-14]。红曲霉还可以产生具有抗氧化作用的代谢物[15]。此外,红曲霉具有明显的嗜酸特性,即利用乳酸为碳源代谢生长,在浓香型白酒的生产中具有降低乳酸和乳酸乙酯,增加己酸乙酯的作用[3,16],是重要的浓香型白酒酿造功能微生物菌种之一。
研究发现,在酯化酶的作用下,己酸与乙醇发生酯化反应生成己酸乙酯,是白酒中己酸乙酯合成的主要途径[17]。由于单体调香调味物质使用的局限性[18],通过现代微生物筛选技术筛选1 株高产己酸乙酯酯化酶的菌株是极其必要的。有研究表明,液态酯化酶比固态酯化酶的活性稳定,然而,目前酯化酶的液态培养还处于试验阶段,能够提供生产用的参数少,因此优化液态培养产酶条件对提高己酸乙酯产量具有十分重要的意义。影响菌株发酵产酯化酶的因素分为3 个部分:培养基成分、培养条件及培养方式[19]。
本试验对1 株合成己酸乙酯性能最高的菌株YJX-8 进行鉴定。利用液态培养技术生产酯化酶,对红曲霉产酯化酶工艺条件进行全面优化[20],确定最佳工艺条件,以期为己酸乙酯酯化酶的生产合成提供理论依据。最后研究酯化酶对乙酸、丁酸、己酸和乳酸的催化生成能力,为后续酯化酶酯化特性的研究奠定基础。
1 材料与方法
1.1 菌株、试剂与培养基
菌 株:红 曲 霉ZSM-9-2、F7302、F7304、F8404、YJX-8、YJX-9-1、YJX-9-3、YJX-12、YJX-13-4、JT-9、JT-10,实验室分离自浓香型酒曲。
试剂:真菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒,OMEGA 公司;ExTaq 酶,NEB 公司;引物的合成,北京奥克鼎盛生物科技有限公司;序列的测定,华大基因。
乙酸、正己酸、丁酸、乳酸、无水乙醇、正己烷均为国产分析纯级;己酸乙酯(99%),源叶生物。
培养基:
①斜面培养基 【马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基】 将去皮马铃薯200 g 切成小块,加1 000 mL 水,煮30 min,双层纱布过滤,滤液中加入20 g 葡萄糖,蒸馏水补充至1 L,pH 值自然,在固体培养基中加入2%琼脂。
②察氏培养基(g/L)葡萄糖30、NaNO33、K2HPO41、KCl 0.5、MgSO4·7H2O 0.5、FeSO40.01、琼脂20,pH 值自然,121 ℃、30 min。
③发酵培养基(g/L)[21]可溶性淀粉70、黄豆饼粉10、酵母浸膏10、MgSO41、NaNO32、NaH2PO41,pH 4.5,121 ℃、20 min。
1.2 仪器与设备
7890B 型气相色谱(gas chromatography,GC)仪,美国安捷伦科技公司;T100-Thermal cycler 聚合酶链式反应(polymerase chain reaction,PCR)仪,美国Bio-Rad 公司;EPS301 琼脂糖凝胶电泳仪,北京六一仪器厂;ImageQuant 300 凝胶成像仪,美国GE 公司;HD-1360 洁净工作台,北京东联哈尔仪器制造有限公司;BXM-30R 立式压力蒸汽灭菌器,上海博迅实业有限公司;LHS-150HC-I恒温恒湿培养箱,上海一恒科学仪器有限公司;IS-RDD3 温振荡器,北京科创百方科技发展有限公司。
1.3 方法
1.3.1 检测方法 根据参考文献[22]~[24],采用气相色谱-外标法检测乙酸乙酯、丁酸乙酯、己酸乙酯和乳酸乙酯的含量。气相色谱条件:色谱柱:DB-Wax 毛细管色谱柱(30 m × 0.32 mm,0.25 μm);氢火焰离子化检测器(flame ionization detector,FID),载气为高纯氮气;进样口温度220 ℃,检测器温度220 ℃,分流比5 ∶1,进样量1 μL;柱温:升温程序:60 ℃保持3 min,以3.5 ℃/min 升至180 ℃,保持10 min;各气体流速:载气(N2):1 mL/min;H2:30 mL/min;空气:400 mL/min;尾吹气:25 mL/min。
1.3.2 红曲霉合成己酸乙酯性能的比较 对实验室已有编号为ZSM-9-2、F7302、F7303、F7304、YJX-8、YJX-9-1、YJX-9-3、YJX-12、YJX-13-1、JT-7、JT-9、JT-10 的12 株红曲霉菌株的己酸乙酯合成性能进行比较,己酸乙酯产量采用1.3.1 节方法检测。通过比较,筛选1 株己酸乙酯合成性能较强的菌株做后续试验。
1.3.3 YJX-8 菌株鉴定
1.3.3.1 菌株形态观察 在PDA、察氏固体培养基中,30 ℃培养7 d,观察其外部形态。采用粘片法,显微镜下观察菌丝体形状、大小,孢子大小、形状、类型、颜色。
1.3.3.2 菌株分子生物学鉴定 按照真菌DNA提取试剂盒提取红曲霉YJX-8 的基因组,采用rDNA 基因序列分析,以提取的真菌的总DNA 为模板,采用ITS 通用引物(ITS1:5′-TCCGTAGGTGAACCT-3′;ITS4:5′-TCCTCCGC TTATTGATATGC-3′)和β-微管蛋白引物(βt2a:5′-GGTAAC CAAATCGGTGCTGCTTTC-3′;βt2b:5′-ACCCTCAGTGTAGTGACCCTTGGC-3′),通过PCR 扩增其ITS 和beta tubulin 序列。反应程序:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,30 个循环;72 ℃再延伸10 min。
PCR 产物送被至北京华大基因测序有限公司测序。将测序结果与美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中核酸序列进行比对,选取同源性高的菌株的ITS r DNA 序列和模式菌株的β-微管蛋白序列,利用MEGA 6.0 软件进行多序列比对,用邻接(Neighbor-Joining)法构建系统发育树。
1.3.4 粗酶液的制备 将红曲霉采用点种法接种于PDA 平板上,培养5 d。
摇瓶培养:采用刮刀切1 块1 cm2菌块接种于装有50 mL 发酵培养基的250 mL 三角瓶中,30℃、180 r/min 条件下培养5 d。
用4 层纱布过滤分离菌丝体和发酵液,将滤液在4 ℃、3 500 r/min 条件下离心15 min,除去沉淀,上清液于4 ℃冰箱中保存备用。
1.3.5 发酵液酶活力的测定 制备酯化液[25-26]:取100 mL 具塞玻璃三角瓶,依次添加粗酶液0.5 mL、pH 6.0、0.2 mol/L Na2HPO4/NaH2PO4缓冲液、无水乙醇1 mL、正己酸0.05 mL,混匀。30 ℃、180 r/min 恒温振荡酯化24 h。以未接种的发酵培养基取代粗酶液作为空白对照。
样品处理:取2 mL 酯化液,加入等体积的正己烷,于漩涡混匀器上萃取30 s,静置,取上层萃取液过滤,用气相色谱检测[13]。
酶活力单位定义(U/mL)[27-28]:以酯化液中1 h合成1 μmol 己酸乙酯所需要的酶量定义为1 个酶活力单位。
1.3.6 红曲霉产酶培养基的优化 将红曲霉YJX-8 接种于PDA 平板上,在30 ℃条件下培养5 d,然后接种于发酵培养基中,于30 ℃、180 r/min条件下振荡培养5 d。依次考察碳源种类(可溶性淀粉、葡萄糖、蔗糖、乳糖、麦芽糖)、碳源质量浓度(50,60,70,80,90,100,110 g/L)、氮源种类(黄豆饼粉、酵母浸膏、牛肉膏、胰蛋白胨、硝酸钠、硫酸铵)、氮源质量浓度(10,15,20,25,30,35,40 g/L)对产酶的影响。检测方法参照1.3.1 节。
1.3.7 红曲霉产酶培养条件的优化 将红曲霉YJX-8 接种于PDA 平板上,在30 ℃条件下培养5 d,然后接种于发酵培养基中,于30 ℃、180 r/min条件下培养5 d。依次考察初始pH 值(3.5,4.0,4.5,5.0,5.5,6.0,6.5)、温 度(24,27,30,33,36,39,42 ℃)、转 速(120,140,160,180,200,220 r/min)对产酶的影响。检测方法参照1.3.1 节。
1.3.8 正交试验 根据单因素试验结果及发酵过程中的实际情况,拟定不同因素水平。考察黄豆饼浓度、初始pH 值、转速对产酶的影响,寻找红曲霉发酵条件的最佳组合。利用最优组合做验证试验。
1.3.9 发酵时间对产酶的影响 利用最优组合做发酵时间试验,考察发酵时间(0,1,2,3,4,5,6,7 d)对产酶的影响。
1.3.10 酯化酶底物特异性研究
1.3.10.1 酯化酶对单一酸的催化能力 取100 mL 具塞玻璃三角瓶,依次添加3.45 mL 磷酸钠缓冲液、0.5 mL 粗酶液、1 mL 无水乙醇,分别添加50 μL 乙酸、丁酸、正己酸、乳酸,混匀。30 ℃、180 r/min 恒温振荡酯化24 h。以高温灭活的粗酶液作为空白对照,考察酯化酶对四大酸的选择性。1.3.10.2 酯化酶对混合酸的催化能力 取100 mL 具塞玻璃三角瓶,依次添加3.45 mL 磷酸钠缓冲液、0.5 mL 粗酶液、1 mL 无水乙醇、四大酸(乙酸、正己酸、丁酸、乳酸)各12.5 μL,混匀。30 ℃、180 r/min 恒温振荡酯化24 h。以高温灭活的粗酶液作为空白对照,考察酯化酶对四大酸的选择性。
2 结果与分析
2.1 己酸乙酯合成性能比较
由图1看出,通过对12 株红曲霉合成己酸乙酯的性能的比较,得出菌株YJX-8 合成己酸乙酯性能最好,己酸乙酯产量最高。选择该菌株为后续试验的对象。

图1 红曲霉己酸乙酯合成性能比较Fig.1 Comparison of the performance of synthesized ethyl hexanoate
2.2 菌种鉴定结果
2.2.1 菌落形态 菌株YJX-8 在两种平板培养基中培养7 d 的菌落形态见表1。
菌落形态特征分析:菌株YJX-8 在PDA 培养基上的生长速度明显优于察氏培养基(见图2),培养初期均为白色小菌落,时间久后颜色变深,菌落呈绒毡状。

表1 菌株YJX-8 的菌落形态Table1 Colonial morphology of strain YJX-8
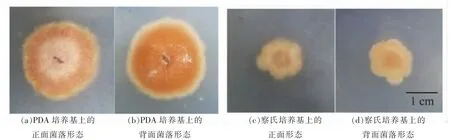
图2 菌株YJX-8 在培养基上的菌落形态Fig.2 Colonial morphology of strain YJX-8 on the medium
2.2.2 个体形态 在显微镜下观察菌株YJX-8的个体形态(见图3),可以看出菌株有闭囊壳,分生孢子,细胞横隔,分杈菌丝。
根据菌株YJX-8 的个体形态特征、菌落形态特征鉴定,比对《菌种保藏手册》,确定该菌株各项特征与曲霉科红曲霉属的特征基本一致,初步判断该菌株可能属于红曲霉属(Monascus)。
2.2.3 分子生物学 为了进一步确定该菌的分类地位,在形态学的基础上进行分子生物学鉴定。采用真菌基因组提取试剂盒提取菌株的总DNA(见图4a),扩增并进行ITS 和β-微管蛋白功能区序列测定。当PCR 扩增得到长度为557 bp的ITS 序列和514 bp 的β-微管蛋白功能区序列(见图4b),将测序结果与NCBI 数据库BLAST 进行比对,选取同源性较高的模式菌株进行系统发育树分析(见图5)。
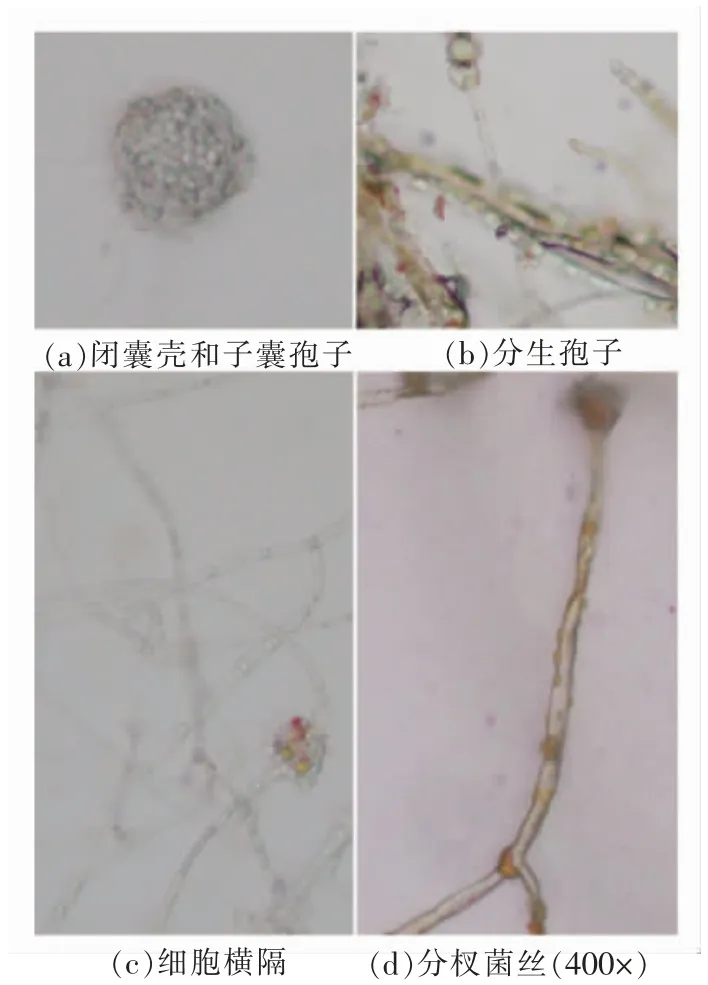
图3 菌株YJX-8 的个体形态Fig.3 Individual forms of strain YJX-8
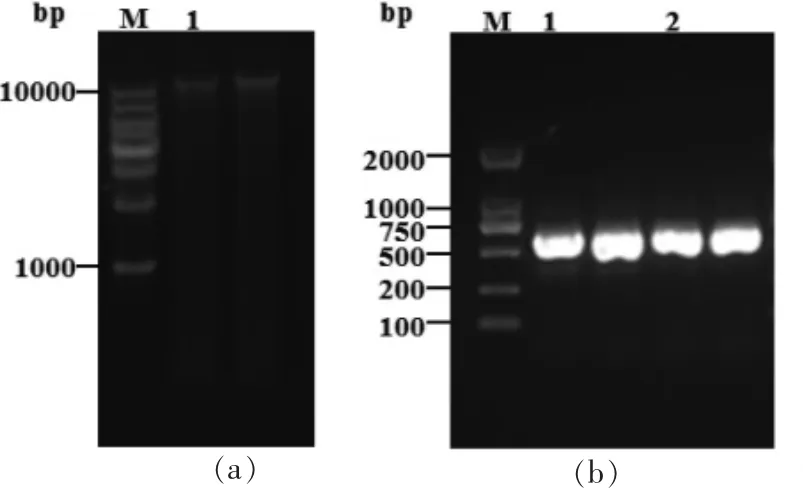
图4 菌株YJX-8 的基因组(a)以及rDNA PCR 扩增产物(b)电泳结果Fig.4 Electrophoresis analysis of genome(a)and rDNA PCR products(b)of strain YJX-8
由图5可以看出,菌株YJX-8 与紫色红曲霉聚于一支,相似度达到99%。结合形态学观察结果,将红曲霉YJX-8 初步鉴定为1 株紫色红曲霉(Monascus purpureus)。
2.3 培养基优化结果
2.3.1 碳源对产酶的影响 由图6a 可以看出,相比于无碳源添加的培养基,碳源有利于红曲霉YJX-8 产酯化酶,且蔗糖为碳源时酯化酶的酶活最高,达(0.515±0.083)U/mL,较可溶性淀粉为碳源时,酶活提高2 倍。其次是麦芽糖,可溶性淀粉、葡萄糖和乳糖作为碳源,YJX-8 所产酯化酶的酶活无显著性差异,乳糖为碳源的最低。任佳明等[2]研究发现紫色红曲霉在以麦芽糖为碳源的培养基中产酯化酶的酶活力最高。潘名志等[29]研究发现葡萄糖和可溶性淀粉作为红色红曲霉液态发酵碳源产酯化酶的能力相当,说明不同来源红曲霉的最佳碳源种类不同。
2.3.2 蔗糖含量对产酶的影响 由图6b 可以看出,酯化酶酶活随着蔗糖添加量的升高呈现先升高后下降趋势,分析原因可能是碳源浓度过低不利于微生物的生长,碳源浓度过高,会导致不适的碳氮比,不利于菌体生长和产酶。蔗糖添加量为90 g/L 时,酯化酶酶活最高为(0.822±0.043)U/mL,较上一步酶活提高1.6 倍。
2.3.3 氮源对产酶的影响 由图6c 可以看出,菌株YJX-8 在无氮源添加的培养基中几乎不产酯化酶,说明氮源是菌株YJX-8 产酯化酶的必要物质。黄豆饼粉作为氮源,酯化酶酶活远远高于其它氮源,其次是牛肉膏、酵母膏、蛋白胨。文献[30]也报道,根霉属H-3 的最适产酶氮源为黄豆饼粉。分析原因可能是黄豆粉与其它氮源比较,黄豆饼粉中的油对红曲霉分泌酯化酶有诱导作用。复合氮源和黄豆粉作为氮源时,YJX-8 所产酯化酶的酶活无显著性差异。考虑到黄豆饼粉较复合氮源简单、廉价,最终选择黄豆粉作为氮源。
2.3.4 黄豆饼粉含量对产酶的影响 由图6d 可以看出,酯化酶的酶活随着黄豆饼粉浓度的升高呈现先升高后下降的趋势,分析原因可能是低于或高于最适碳氮比,不利于产酶。黄豆饼粉质量浓度为25 g/L 时酯化酶酶活最高,酶活为(1.103 ±0.034)U/mL,较上一步提高1.4 倍。
2.4 培养条件的优化结果
2.4.1 初始pH 值对产酶的影响 文献[21]报道,发酵培养基的初始pH 值影响微生物的生长繁殖和产物的合成,不同的微生物对pH 值的要求各不相同,微生物只在一定的pH 范围内生长,并使代谢物产量达到最大。潘志明等[29]研究发现,红色红曲霉(Monascus ruber)ZK 产酯化酶的最优培养基初始pH 值为5.5。李付丽等[21]研究了1 株产酯能力较高的红曲霉菌的最佳发酵培养基的初始pH 值为4.5。王晓丹等[4]研究了红曲霉产己酸乙酯脂肪酶固态发酵培养基的最适初始pH 7,说明不同红曲霉产酯化酶的最适培养基初始pH 值不同。由图7a 可以看出,红曲霉YJX-8 所产酯化酶的酶活随着培养基初始pH 值的升高呈现先升高后下降的趋势,当培养基初始pH 4.5 时,有利于菌体产酶,酯化酶的酶活为(1.050±0.107)U/mL。
2.4.2 培养温度对产酶的影响 培养温度影响红曲霉的生长和酯化酶的分泌量,红曲霉一般适应温度范围为15~42℃,最适宜温度范围为28~35℃[31]。考虑到红曲霉的生长温度范围,选择温度范围24~42 ℃考察培养温度对红曲霉YJX-8 产酶的影响。由图7b 可以看出,酯化酶的酶活随着温度的升高呈现先升高后下降的趋势,当温度为30 ℃时,产酶量最高,酶活为(0.920±0.056)U/mL。当培养温度较低时,菌丝体生长缓慢,产酶量少,温度过高,酯化酶酶活明显降低,分析原因可能是较高或较低温度不仅影响菌株的生长,而且影响酯化酶的分泌[4]。
2.4.3 培养转速对产酶的影响 由图7c 可以看出,转速为180 r/min 时酯化酶的酶活较高,达(0.967±0.010)U/mL。文献[25]报道,转速不仅影响氧的转移速率,而且决定培养液中菌丝球所受机械力的大小。适当的转速可以提高氧的转移率,促进菌丝的生长,使菌丝体受到适当的剪切力,菌丝间缠绕不紧密,菌丝球松散,利于通气。
2.5 正交试验结果
通过SPSS 软件对单因素试验结果进行分析,选取对红曲霉产酯化酶影响显著的因素做正交试验,对其结果进行极差分析,确定最佳的产酯化酶培养条件。采用L9(33)正交表,以培养基中黄豆饼粉含量(A)、初始pH 值(B)、转速(C)作为3 个考察因素,选取3 个水平做试验。
按表2的正交因素水平设计【L9(33)】正交试验,结果见表3。
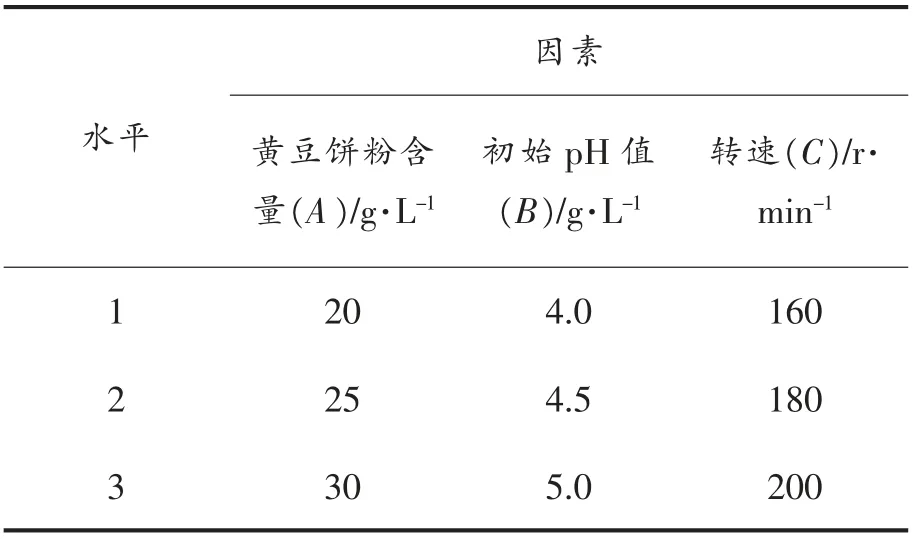
表2 正交因素水平表Table2 Factors and levels of orthogonal tests

表3 L9(33)正交设计及结果Table3 Design and results of L9(33)orthogonal tests

(续表3)
由表3的极差分析结果可以看出,RB>RA>RC,3 个因素对红曲霉产酶的影响依次为:初始pH 值(B)>黄豆饼粉浓度(A)>转速(C),3 个因素的影响较为显著。在试验设计范围内,优化得到红曲霉产酶的最佳培养条件为A2B2C2,即黄豆饼粉质量浓度25 g/L、初始pH 值4.5、转速180 r/min,与单因素试验结果一致。
2.6 发酵时间对产酶的影响
由图8可以看出,红曲霉培养2 d,几乎无酶活,是因为红曲霉在这段时间主要用于菌体的生长,不产酯化酶。培养2 d 后,开始产酯化酶,酶活较低,这是因为红曲霉生长速度慢,产酶量少。培养3 d 后,酶活快速上升,且酯化酶的酶活随着发酵时间的延长而升高。发酵6 d 后,酯化酶的酶活呈平稳趋势,原因可能为随着发酵液中营养物质的消耗,菌体衰老甚至自溶,进而影响产酶。由于发酵第6 天和第7 天,酯化酶的酶活无显著性的差异,因此6 d 为较佳培养时间。
2.7 底物特异性
2.7.1 酯化酶对单一酸的催化能力 红曲霉酯化酶对单一酸乙酸、丁酸、己酸和乳酸的酯化作用结果见表4。红曲霉酯化酶对己酸与乙醇的酯化有很强的促进作用,生成己酸乙酯的量最多,(42.07±0.87)mg/100 mL,其次是乳酸乙酯、乙酸乙酯和丁酸乙酯产量低,说明该红曲霉酯化酶是一类专一性较强的酶。
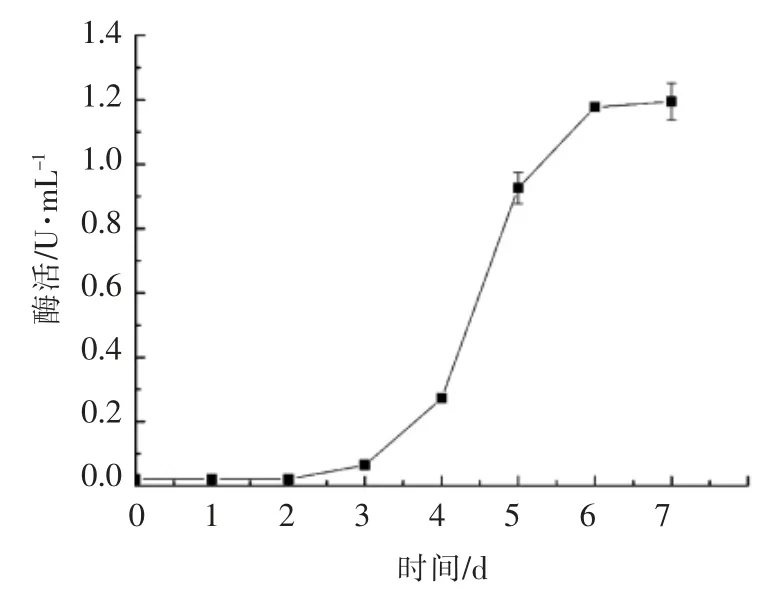
图8 发酵时间对菌株YJX-8 产酶的影响Fig.8 Effect of fermentation time on enzyme production from strain YJX-8
2.7.2 酯化酶对混合酸的催化能力 由表5可以看出,在等量混合酸中,乙醇与四大混合酸在酯化酶的作用下主要生成己酸乙酯,产量为(32.68 ±0.78)mg/100 mL。生成少量的丁酸乙酯、乳酸乙酯,无乙酸乙酯生成,说明红曲霉酯化酶对己酸的选择性最好,与任道群等[32]研究结果一致。其研究表明红曲霉能够促进己酸、丁酸及混合酸和乙醇的酯化作用,生成的酯类物质均为己酸乙酯,且酯化力极强。截止目前,已有水相中酯化酶对底物酸特异性的相关研究。如杜礼泉等[25]研究了红曲霉酯化酶的专一性,该酯化酶对乙酸、丁酸和己酸有较强的酯化作用,能够形成相应的酯类,然而酯化酶专一性低,属于键专一性酶。唐玉明等[28]研究了丛毛红曲霉所产酯化酶的特性,该酯化酶能够催化单一酸乙酸、己酸、乳酸形成相应的酯类,催化丁酸和混合酸形成己酸乙酯。徐前景等[33]研究了烟灰色红曲霉粗酶制剂的酯化特性,该酯化红曲对己酸乙酯具有很强的催化专一性。说明不同种来源红曲霉酯化酶底物特异性不同。
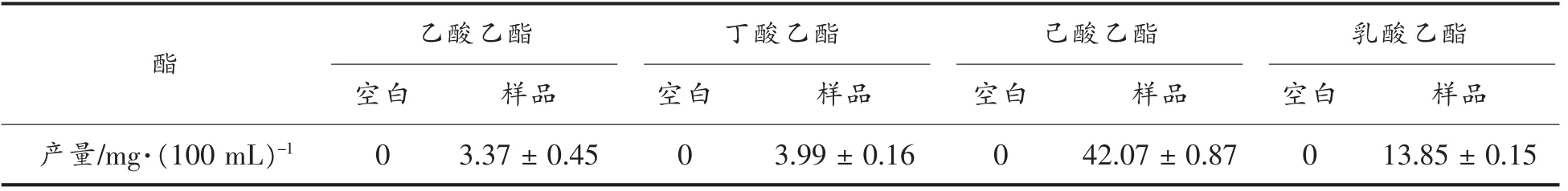
表4 酯化酶对单一酸和乙醇的酯化Table4 Esterification of single acid and ethanol by enzymes

表5 酯化酶对混合酸和乙醇的酯化Table5 Esterification of mixed acids and ethanol by enzymes
3 结论
从12 株红曲霉中筛选到1 株合成己酸乙酯性能较高的红曲霉YJX-8,通过菌落形态、个体形态和分子生物学鉴定为1 株紫色红曲霉。通过单因素和正交法优化,最终确定该紫色红曲霉发酵液最佳产酶条件:蔗糖90 g/L、黄豆饼粉25 g/L、MgSO41 g/L、NaH2PO41 g/L、pH 4.5、30 ℃、180 r/min、6 d。在该条件下,酯化酶的酶活达(1.177 ±0.009)U/mL,较优化前酶活提高4.56 倍。
通过对YJX-8 菌株所产酯化酶底物特异性的研究,得出红曲霉YJX-8 酯化酶是对己酸乙酯的生成有较强促进作用的酶,可缓解浓香型酒中己酸乙酯含量不足的问题。优化提高该红曲霉酯化酶合成己酸乙酯的能力,具有十分重要的意义。
本研究为红曲霉酯化酶液态生产提供工艺参数。对该酯化酶中起作用的酯化酶基因还有待研究。
