玉米肽Tyr-Phe-Cys-Leu-Thr对酒精性HepG2细胞的保护作用
2020-05-24于亚莉宋雪梅刘静波
于亚莉 宋雪梅 关 玉 王 莹 张 婷 刘静波
(吉林大学食品科学与工程学院营养与功能食品研究室 长春130062)
酒是人类生活中的饮料之一,中国制酒历史源远流长。中国不仅是是世界三大酒系的发源地之一,而且也是世界上最早酿造酒的国家之一[1]。酒渗透于整个中华五千年的文明史中,从文学艺术创作、文化娱乐到饮食烹饪、养生保健等各方面,在中国人生活中都占有重要的位置。然而,过量饮酒不仅导致酒精依赖,还会增加人们患病的危险。酒精可对人体带来很多影响,如过量、长期饮酒导致酒精性脂肪肝、肝硬化、酒精性肝炎、消化系统疾病、神经障碍等多种疾病;还会造成一系列社会问题,如饮酒后造成的酒精依赖、交通事故、暴力等违法犯罪行为等[2]。酒精性肝病(alcoholic liver disease,ALD)又称酒精性肝损伤,是因长期或过量摄入酒精而导致的肝脏疾病,发病过程伴随氧化应激、脂肪积累、炎症反应、细胞凋亡等病理生理反应。由于酒精性肝病与遗传因素和外界环境因素有关,所以酒精性肝损伤的发病机制非常复杂,至今没有特异性且效果显著的治疗方法[3]。
玉米肽(Corn peptides,CPS)是以玉米蛋白粉为原料,经蛋白酶酶解或微生物发酵,再经分离、超滤和层析等手段分离纯化的低分子质量的寡肽混合物,其分子质量一般在1 000 u 左右,平均有5~7 个氨基酸[4]。玉米肽不仅能够提供人体所需的营养物质,还具有特殊的生理功能特性,可以降低血脂和胆固醇,延缓衰老,抗氧化,缓解疲劳、增强记忆力等[5],受到消费者的广泛关注。目前,玉米肽作为功能因子已被添加到多种食品中,其加工制品具有很大的市场前景。日本研究者Yamaguchi最先在玉米醒酒肽方面做研究,首先采用碱性蛋白酶水解玉米蛋白粉,获得具有醒酒作用的玉米肽,其次比较玉米肽、小麦肽和豌豆肽的醒酒效果,得到的结果是玉米肽的醒酒效果最好,其通过提高血液中的丙氨酸(Ala)和亮氨酸(Leu)浓度,降低血液中的乙醇浓度[6]。大量研究表明,玉米肽在神经系统、血管疾病、肿瘤等多方面有显著疗效,并且可应用于临床治疗中[7-8]。在肝脏保护方面,将玉米肽应用于大量动物及临床试验,结果表明玉米肽具有一定的保肝护肝作用,研究其保护机制具有重要作用。
前人在玉米肽的护肝活性上开展了大量研究,然而关于玉米肽对酒精性肝损伤的保护作用机制的研究报道较少。本文以从玉米蛋白粉中鉴定得到的玉米肽Tyr-Phe-Cys-Leu-Thr(YFCLT)为研究对象,从氧化应激与脂质代谢两个方面研究对HepG2 细胞酒精性损伤的保护作用机制,以期为玉米肽的进一步应用提供理论依据。
1 材料与方法
1.1 材料
玉米肽Tyr-Phe-Cys-Leu-Thr(YFCLT),吉尔生物有限公司;二苯代苦味肼基(DPPH)、2'-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、荧光素钠、AAPH,美国Sigma-Aldrich 公司;谷草转氨酶(AST/GOT)测定试剂盒、谷丙转氨酶(AST/GPT)测定试剂盒、甘油三酯(TG)测定试剂盒、过氧化氢酶(CAT)测定试剂盒、超氧化物歧化酶(SOD)测定试剂盒、还原型谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒、人肿瘤坏死因子ELISA 测定试剂盒,南京建成生物工程研究所;活性氧检测试剂盒(ROS)、BCA 蛋白浓度测定试剂盒,上海碧云天生物技术公司。
1.2 仪器与设备
6/12/96 孔细胞培养板,美国Corning 公司;BioTek Synergy HT 多功能酶标仪,美国BioTek公司;HF-90 型CO2恒温培养箱,上海力申科学仪器设备有限公司;TS100 倒置显微镜、Ti 荧光倒置显微镜,日本Nikon 公司。
1.3 试验方法
1.3.1 体外抗氧化能力的测定
1.3.1.1 DPPH 自由基清除活性的测定 于96 孔板中,每孔加入160 μL 125 μmol/L DPPH 溶液,40 μL 不同浓度的样品溶液。每组设置3 个复孔,室温避光静置反应30 min 后,在波长517 nm 处测定其吸光度值[9]。DPPH 自由基清除率的计算公式:

式中:A1——试验组的吸光度;A2——对照组的吸光度;A3——空白组吸光度。
1.3.1.2 ABTS 自由基清除活性的测定 每孔加入180 μL ABTS 工作液,20 μL 不同浓度的样品溶液。每组设置3 个复孔,室温避光静置反应30 min 后,在734 nm 处测定其吸光度值[10]。ABTS 自由基清除率的计算公式:

式中:A1——试验组吸光度;A2——对照组吸光度;A3——空白组吸光度。
1.3.1.3 Fe2+螯合能力的测定 将试验分为两组,于96 孔板中进行。试验组每孔加入2 mmol/L FeCl2溶液50 μL,加入50 μL 样品溶液或EDTA溶液,静置反应30 min,加入5 mmol/L 菲洛嗪溶液100 μL,室温避光静置反应10 min,在波长562 nm 处测定其吸光度值,每组设置3 个复孔[11]。亚铁离子螯合率计算公式:
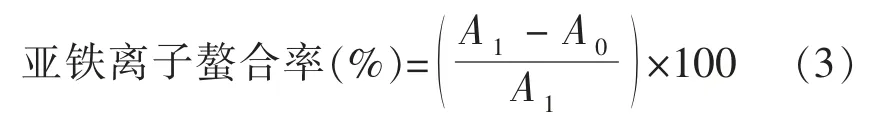
式中:A1——对照组的吸光度;A0——试验组的吸光度。
1.3.1.4 氧自由基吸收能力(ORAC)的测定 取120 μL 荧光素钠工作液和20 μL 样品溶液至黑色96 孔板中混合,在37 ℃下预热2 min。加入60 μL AAPH 溶液,立即将黑色96 孔板放入酶标仪中,在37 ℃下检测。设置酶标仪荧光激发波长为(485±20)nm,发射波长为(528±20)nm,相邻两个测定的时间间隔为2 min,测定前振板2 s,连续测定180 min[12]。
相对荧光强度的计算公式:

式中,n——测定的第n 分钟;fn——第n 个测定时间的相对荧光强度;f0——时间点为0 时的荧光强度。
1.3.2 建立HepG2 肝细胞酒精损伤模型 取对数生长期的HepG2 细胞,调整细胞悬液的含量为1.5×105个/mL,将细胞均匀铺满96 孔底,置于CO2培养箱培养6 h 后,加入不同浓度的无水乙醇溶液,置于培养箱中。培养结束后,采用MTS 法每孔加入20 μL MTS 溶液,继续培养2 h,在波长490 nm 处测定每孔的吸光度值[13]。
1.3.3 YFCLT 对酒精性损伤模型细胞抗氧化应激损伤的作用
1.3.3.1 细胞AST、ALT 的泄漏量 取对数生长期细胞,调节细胞密度为1.5×105个/mL,每孔加入1 mL 细胞悬液于12 孔培养板中,置培养箱内孵育6 h,加入无水乙醇溶液200 μL,孵育2 h,再加入玉米肽溶液200 μL,孵育24 h。收集培养基上清液,按照试剂盒说明书操作,根据标准曲线计算各上清液中ALT、AST 活力值。
1.3.3.2 细胞内SOD、CAT、GSH 的测定 取对数生长期细胞,制成细胞悬液,调节细胞密度为2.0×105个/mL,每孔加入2 mL 细胞悬液于6 孔培养板中。培养结束后,吸弃培养液,用PBS 缓冲液清洗3 次。用细胞刮刀将细胞刮下,收集细胞悬液,5 000 r/min 离心3 min,弃清液,加入200 μL 细胞裂解液(V细胞裂解液∶VPMSF=9∶1),在冰上静置使其裂解约30 min。在事先预冷的4 ℃高速冷冻离心机中离心5 min,转速为14 000 r/min。吸取离心后的上清液用于测定HepG2 细胞中抗氧化酶SOD、CAT、GSH 的活力值[14]。计算公式如下:

式中:A1——对照组的吸光度;A2——试验组的吸光度;b——反应体系的稀释倍数;c——样品蛋白的质量浓度(mg 蛋白/mL)。
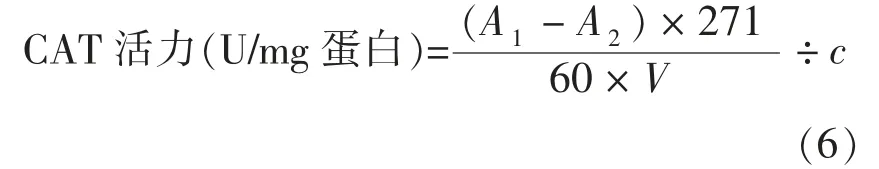
式中:A1——对照组的吸光度;A2——试验组的吸光度;V——样品消耗体积(mL);c——样品蛋白质量浓度(mg 蛋白/mL)。

式中:A0——对照组的吸光度;A1——试验组的吸光度;A2——标准组的吸光度;c——样本蛋白的质量浓度(mg 蛋白/mL)。
1.3.3.3 细胞内ROS 的测定 细胞培养、加药与1.3.3.1 节相同。培养结束后,每孔加入10 μmol/L的DCFH-DA 工作液500 μL,放入培养箱中孵育20 min。收集DCFH-DA 工作液,用PBS 缓冲液冲清洗。用荧光倒置显微镜拍照,该过程需避光。
1.3.3.4 细胞TNF-α 释放量的测定 试验分组、细胞培养、铺板、加药步骤同1.3.3.1 节。采用双抗体夹心法酶联免疫吸附实验(ELISA),收集各组细胞培养液后按照ELISA 试剂盒说明书依次加入抗体,孵育后用PBS 缓冲液洗涤,在450 nm 处测定吸光度,绘制标准曲线,计算细胞培养液中TNF-α含量。
1.3.4 YFCLT 对酒精性损伤模型细胞脂质代谢的影响
1.3.4.1 细胞内甘油三酯的含量 细胞培养、铺板、加药的方法同1.3.3.1 节。将裂解后的HepG2细胞提取液先用BCA 蛋白浓度试剂盒测定蛋白浓度,混合液不离心,使用甘油三酯测试盒测定甘油三酯水平。甘油三酯含量的计算公式:
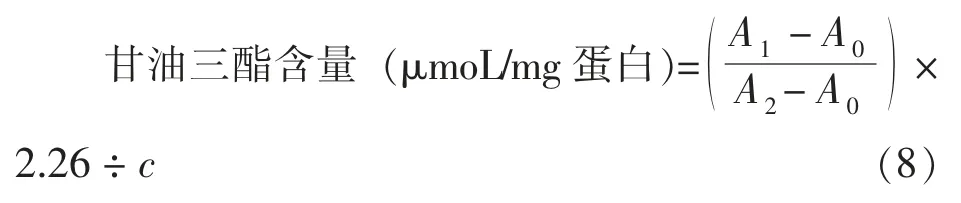
式中:A0——空白组的吸光度;A1——试验组的吸光度;A2——对照组的吸光度;2.26(mmol/L)——标准品浓度;c——试验组蛋白质量浓度(mg蛋白/mL)。
1.3.4.2 细胞内MDA 的测定 采用硫代巴比妥酸法(TBA)测定MDA 含量,试验分组及细胞预处理同1.3.3.1 节,以细胞裂解后离心获得的上清液作为样品,按照测定盒说明书测定。

式中:A0——对照组的吸光度;A1——试验组的吸光度;A2——标准组的吸光度;A3——空白组的吸光度;10——标准品浓度10nmol/mL;c——样本蛋白质量浓度(mg 蛋白/mL)。
1.3.4.3 细胞内脂滴的测定 采用油红O 染色法判断脂滴的积累量。细胞铺板、加药方法同1.3.3.1节,培养结束后用PBS 缓冲液清洗2 遍,加入1 mL 细胞固定液固定30 min,置于37 ℃恒温培养箱中,吸弃固定液。每孔加入800 μL 油红O 工作液染色10 min,置于37 ℃恒温培养箱中,吸弃染色液。用60%异丙醇-PBS 溶液清洗3 遍,直至洗涤液呈无色,以除去多余的染色液。在倒置显微镜下观察、拍照。
1.3.5 数据分析与处理 本章所有数据均以X±SD 表示,画图软件为Origin,使用SPSS 软件进行数据处理,当P<0.05 时,具有显著性差异;当P<0.01 时,具有极显著性差异,具有统计学意义。
2 结果与讨论
2.1 玉米肽的DPPH 自由基清除率
DPPH 作为一种稳定自由基,在一些有机溶剂中表现出紫色,当有供氢能力的抗氧化剂时,其颜色由紫色变浅至无色,根据吸光度的变化程度可反映该抗氧化剂清除DPPH 自由基的能力[15]。由图1可以看出,玉米肽YFCLT 具有一定的DPPH 自由基清除活性,其浓度分别为1,10,100,1 000 μmol/L 时,对DPPH 自由基清除率分别为(13.05 ± 0.82)%,(16.50 ± 0.71)%,(39.75 ±0.55%)%,(65.09 ± 0.15)%。以水溶性维生素E(Trolox)作为阳性参照物,其浓度400 μmol/L 时DPPH 自由基清除率为(96.77±1.19)%,说明玉米肽YFCLT 浓度1 000 μmol/L 时DPPH 自由基清除能力弱于Trolox。从肽的结构上看,YFCLT 具有强DPPH 清除率可能是其氨基酸组成含有半胱氨酸(Cys),Cys 是一种含硫氨基酸,其侧链中含有巯基(-SH)。Cys 的DPPH 清除能力为20 种氨基酸中最高的。
2.2 玉米肽的ABTS 自由基清除能力
ABTS 自由基清除法可以应用于亲脂性和亲水性化合物,是评价细胞、组织、血浆等或植物提取液或各种抗氧化物溶液的抗氧化能力的重要方法[16]。由图2可以看出,玉米肽YFCLT 具有一定的ABTS 自由基清除率,在浓度为1,10,100,1 000 μmol/L 时,其ABTS 自由基清除率分别为(19.38±0.50)%,(32.00±1.02)%,(49.00±1.94)%,(87.46±0.10)%。400 μmol/L Trolox 的ABTS 自由基清除率为(96.93±3.07)%。YFCLT 具有较高的ABTS 自由基清除能力。

图1 玉米肽对DPPH 自由基的清除率Fig.1 DPPH radical scavenging activity of corn peptide

图2 玉米肽对ABTS 自由基清除活性Fig.2 ABTS radical scavenging activity of Corn peptide
2.3 玉米肽的Fe2+螯合能力
Fe2+是生物系统产生的关键金属离子,通过测定样品对Fe2+的螯合能力反映其抗氧化能力。本试验以EDTA 为阳性参照物,采用4 种浓度(1,10,100,1 000 μmol/L)的YFCLT 考察其抗氧化能力。由图3可以看出,五肽YFCLT 在低浓度1 μmol/L 时,仍具有鳌合Fe2+的能力,为(22.78 ±0.90)%;在高浓度1 000 μmol/L 时表现为较高的鳌合Fe2+的能力,即(86.75±0.88)%。
2.4 玉米肽的氧自由基吸收能力
通过测定玉米肽样品的氧自由基吸收能力(ORAC)反映其抗氧化活性,其原理是通过抑制氢质子转移反应,来终止自由基的链式反应。ORAC法是目前国际上评价总抗氧化能力的公认方法,已成为美国食品药品监督管理局(Food and Drug Administration,FDA)评价食品抗氧化能力的重要标准[17]。图4显示:0.1 μmol/L 的玉米肽YFCLT 荧光衰退最早,在100 min 左右相对荧光强度接近0。与阳性对照物10 μmol/L 的Trolox 相比,1,2,10 μmol/L 的玉米肽,分别在160,160,180 min 时相对荧光强度为0,荧光衰退时间晚于10 μmol/L Trolox 的140min,说明1,2,10 μmol/L 的玉米肽YFCLT 氧自由基吸收能力强于10 μmol/L 的Trolox。
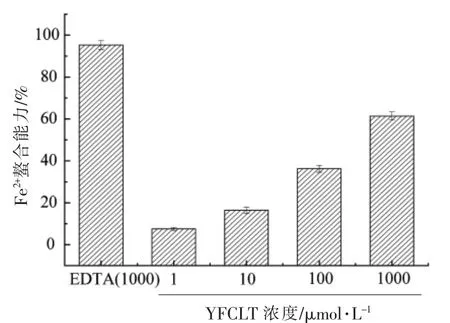
图3 玉米肽的铁螯合能力Fig.3 Fe2+ chelating capability of corn peptide

图4 玉米肽荧光衰退曲线Fig.4 Fluorescence decay curve of corn peptide
2.5 HepG2 肝细胞酒精损伤模型
通过MTS 法,考察不同浓度酒精、不同酒精处理时间对HepG2 细胞存活率的影响。结果表明(表1),在培养基中加入酒精培养12 h 时后,当培养基中酒精终浓度为10~100 mmol/L 时,HepG2细胞存活率与空白组无显著差异;酒精浓度为500 mmol/L 时,细胞增殖活力降至(66.67±7.66)%(P<0.01),表明在该浓度条件下酒精对HepG2 细胞造成损伤。在培养基中加入酒精培养24 h 后,当培养基中酒精终浓度为500 mmol/L 时,细胞增殖活力降至(59.61±6.07)%,与空白组相比具有显著差异(P<0.01),造成HepG2 细胞接近50%损伤;在培养基中加入酒精培养48 h 后,当培养基中酒精终浓度为20 mmol/L 时,细胞增殖活力降至(82.21±15.78)%(P<0.01),表明当酒精作用细胞48 h 时,即使作用浓度低也会对细胞HepG2 的增殖活力产生影响。HepG2 细胞酒精损伤模型建立的适宜酒精终浓度为500 mmol/L,在该浓度酒精作用HepG2 细胞24 h 条件下建立细胞酒精性损伤模型。

表1 不同浓度酒精处理不同时间的HepG2 细胞存活率Table1 Cell viability of HepG2 cells treated with different concentrations and time of alcohol
2.6 ALT、AST 的测定结果
在正常状态下,AST、ALT 只存在于细胞内,当细胞膜受到刺激时AST、ALT 被释放到胞外,使培养液中酶活力升高,因此AST、ALT 两个指标的高低可以反映肝细胞的受损程度[18]。由表2可知,当用酒精诱导HepG2 细胞后,损伤组细胞培养基中ALT 与AST 酶活力相对对照组显著升高,分别达到(10.97 ± 0.34)U/L 及(25.19 ± 1.08)U/L;用不同浓度玉米源活性肽YFCLT 处理损伤模型细胞后,培养液中的ALT 与AST 活力呈现下降趋势,当YFCLT 浓度为100 μmol/L 时,ALT 与AST 达到最低值,分别为(6.43±0.16)U/L 和(13.18±0.34)U/L,与损伤组具有显著差异(P<0.05)。上述结果说明,玉米源活性肽YFCLT 对HepG2 酒精性损伤细胞具有保护作用。

表2 细胞培养基中ALT、AST 的活力Table2 The activity of ALT and AST in cell culture medium
2.7 细胞内抗氧化酶的含量
超氧化物歧化酶(SOD)是机体内重要的酶类抗氧化剂,能清除超氧阴离子自由基对细胞的损伤,对机体的氧化与抗氧化平衡起重要作用,SOD数值的高低反映机体清除氧自由基的能力。还原型谷胱甘肽(GSH)是机体中重要的非酶类抗氧化物,能防止血红蛋白及其它因子受到氧化损伤,GSH 含量与机体抗氧化能力密切相关;细胞中产生的CAT 能在一定条件下分解H2O2,达到抗氧化的效果[19-20]。

表3 细胞内抗氧化酶含量Table3 Enzyme system in cells
T-SOD 活性在加入500 mmol/L 酒精后降至(4.27 ± 0.74)U/mg 蛋白。用1 μmol/L 玉米源肽YFCLT 预处理,酶的活力均提至(8.28 ± 0.73)U/mg 蛋白,与损伤组相比具有显著差异(P<0.01)。经100 μmol/L 玉米源肽YFCLT预处理,T-SOD活力达到(16.38±0.37)U/mg 蛋白,与损伤组相比具有显著差异(P<0.01),与对照组相比无显著差异(P>0.05)并呈现剂量-依赖关系。
CAT 活性在加入酒精后降至(36.07±0.34)U/mg 蛋白,使用1~100 μmol/L 玉米源肽YFCLT预处理后,酶的活力均显著提升并呈剂量依赖关系,与损伤组相比有显著差异(P<0.01)。在加入1 μmol/L YFCLT 预处理时,CAT 活性升至(23.73±1.36)U/mg 蛋白;在加入100 μmol/L 玉米源肽YFCLT 预处理时,CAT 活性升至(35.65±0.73)U/mg 蛋白,与对照组无显著性差异(P>0.05)。
酒精诱导后损伤组的GSH 含量降至(43.23±0.44)个活力单位,加入YFCLT 预处理后,GSH 活力升高。如加入100 μmol/L 玉米源肽YFCLT 预处理时,GSH 活力升至(64.61±0.35)个活力单位,与对照组相比无显著差异(P>0.05)。
上述结果表明,酒精处理后损伤细胞内抗氧化酶系T-SOD、CAT、GSH 含量显著下降,加入玉米源肽YFCLT 预处理损伤细胞,各抗氧化酶含量相对损伤组显著升高,且均呈现剂量-依赖关系,进一步表明玉米肽YFCLT 能有效保护酒精性损伤的HepG2 细胞,其可能的机制是通过提高细胞内抗氧化酶系T-SOD、CAT、GSH 活性,从而提高细胞的抗氧化能力有关。
2.8 TNF-α 释放量
如图5所示,损伤组培养基中TNF-α 水平是空白对照组的1.71 倍,而不同浓度的玉米肽YFCLT 处理酒精性损伤细胞后,细胞释放的TNF-α水平显著降低,且呈剂量-浓度关系。
当加入低浓度(1 μmol/L)的YFCLT 时,培养基中TNF-α 水平与损伤组无显著差异(P>0.05)。随着浓度的增大,当达到50 μmol/L 时,培养基中TNF-α 水平显著下降,与损伤组相比具有极显著差异(P<0.01)。结果表明,一定浓度的玉米肽YFCLT 可有效降低酒精性损伤细胞培养基上清液中TNF-α 水平。
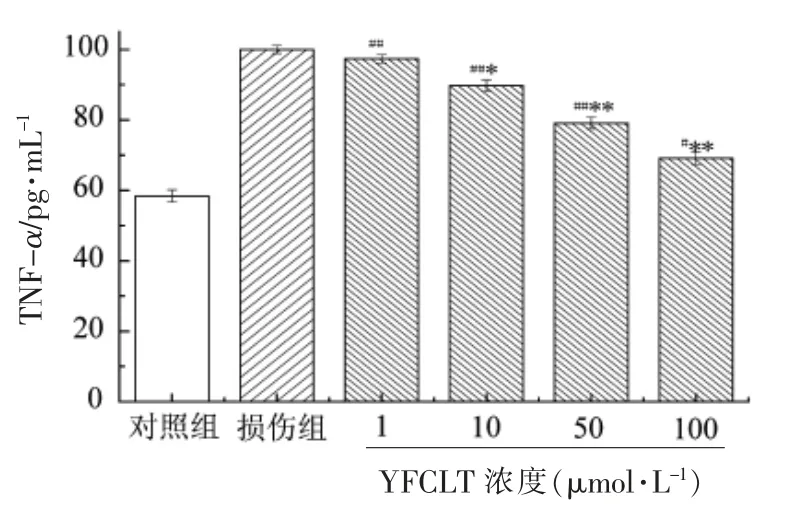
图5 YFCLT 对细胞培养基内TNF-α 的影响Fig.5 Effects of the YFCLT on TNF-α in cultured media
2.9 玉米源肽对HepG2 细胞中ROS 水平变化
活性氧(ROS)是指机体内或者自然环境中由氧组成,含氧并且性质活泼的物质的总称。ROS 的测定常用DCFA-DA 探针,其可穿过细胞膜,被催化为DCFH,然后与细胞内的ROS 形成具有荧光强度的DCF,通过测定DCF 的荧光强度,反应细胞内ROS 的水平[21]。
如图6所示,荧光倒置显微镜照片中荧光的强弱反映各组内ROS 水平的高低。对照组图6a荧光很弱,说明正常细胞内ROS 含量较少,未发生活性氧的累积;损伤组细胞图6b 与对照组图6a 相比,荧光显著增强,说明损伤组细胞内ROS水平显著升高。加入玉米肽YFCLT 后,YFCLT 组(图6c-6f)的荧光强度逐渐减弱,说明添加玉米肽YFCLT 可抑制酒精引起的HepG2 细胞内的ROS水平升高。


图6 荧光倒置显微镜拍摄照片Fig.6 The figure by fluorescence inversion microscope system
2.10 HepG2 细胞内TG、MDA 含量
丙二醛(MDA)是细胞内脂质过氧化的产物,是判断生物膜脂质过氧化的重要指标,其数值的高低反映机体细胞受到自由基攻击的程度。酒精作用细胞后会导致细胞自由基含量升高,进而产生大量的MDA。由表4可看出,酒精作用HepG2细胞后,MDA 含量、TG 含量均增加。当不同浓度的玉米源肽YFCLT 作用酒精性损伤细胞后,细胞中的MDA 含量、TG 含量逐渐下降,且呈剂量效应关系,说明玉米肽YFCLT 具有抑制TG 生成及脂质过氧化的作用。
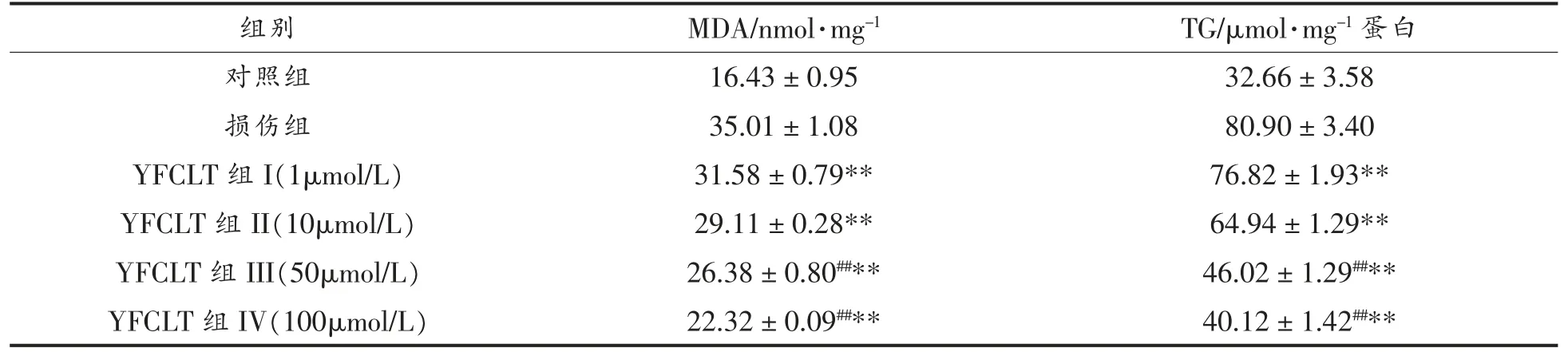
表4 细胞内MDA、TG 含量Table4 MDA and TG in cells
2.11 HepG2 细胞内的脂滴
细胞中的脂肪主要以脂滴的形式存在于细胞胞浆中。油红O 是一种脂溶性染料,染色后其溶于组织内的脂质中,使脂滴呈红色,胞内脂肪累积量越大,染色后呈现的红色越明显,且会大片密集[22]。由油红O 染色照片图7可知,空白组(a)HepG2 细胞正常生长,无明显的脂滴积累;酒精诱导后的损伤组(图7b)中,细胞出现大量的脂滴积累,存在于细胞间隙及胞内,说明酒精诱导后对细胞产生严重的脂肪累积。利用不同浓度的玉米肽YFCLT(1,10,50,100 μmol/L)分别作用于损伤细胞(图7c,7d,7e,7f),可观察到随着YFCLT 浓度的提高,红色脂滴密集程度下降,即脂滴逐渐减少;当YFCLT 浓度达到100 μmol/L 时(图7f),脂滴积累明显少于损伤组(图7b)。这表明一定浓度的玉米肽YFCLT 能够有效降低损伤细胞中脂肪的累积,具有潜在抑制脂肪堆积的作用。
3 结论

图7 油红O 染色照片Fig.7 The photo of oil red O staining
玉米肽Tyr-Phe-Cys-Leu-Thr(YFCLT)具有一定的DPPH 自由基清除能力、ABTS 自由基清除能力、铁螯合能力和氧自由基吸收能力(ORAC),其在低浓度1 μmol/L 时仍有较强的清除能力,在10.0 μmol/L 时氧自由基吸收能力强于阳性对照物Trolox。通过酒精诱导建立的酒精性肝细胞损伤模型,当酒精浓度为500 mmol/L 时,其细胞增殖活力与细胞形态可满足模型细胞需求。酒精作用细胞后会影响细胞内抗氧化酶系的活力,玉米肽YFCLT 预处理酒精性损伤细胞后,细胞内SOD、CAT、GSH-Px 活力下降被抑制,恢复正常水平,表明玉米肽YFCLT 具有抑制氧化应激的作用。玉米肽YFCLT 还可降低酒精性损伤细胞的ROS 水平,以及TNF-α 的释放,表明其通过抗炎作用,达到保护细胞免受酒精性损伤的作用。同时,玉米源肽YFCLT 能够有效降低酒精性损伤细胞的甘油三酯含量及MDA 含量,可以减少脂肪液滴的累积。综上,玉米肽YFCLT 在氧化应激和脂质代谢方面具有对肝细胞酒精性损伤的保护作用。
