红参对乳酸菌体外增菌的影响
2020-05-24邹美娟孙永胜康红艳王妙姝田洪涛
邹美娟 孙永胜 李 晨 康红艳 王妙姝 田洪涛,2*
(1 河北农业大学食品科技学院 河北保定071001 2 国家北方山区农业工程技术研究中心 河北保定071001 3 河北新希望天香乳业有限公司 河北保定071001)
越来越多的研究表明,肠道微生物群快速、高精确地对饮食、抗生素、环境、精神压力等外界刺激产生反应,与人体肥胖、精神类、代谢类和免疫类等疾病息息相关[1]。食用益生菌和益生元能增强肠道中有益的共生群体,达到增强人体免疫力的效果[2],然而益生菌进入消化道,需要克服胃酸消化、定植力以及存活率等棘手问题[3]。比较而言,益生元是不可消化的膳食多糖,当外部供应时可以促进遗传性肠道微生物或益生菌的生长[4],因此对益生元的研究非常有意义。Ramirez-Farias 等[5]研究发现,菊粉的摄入刺激了青春双歧杆菌的生长;Cani 等[6-7]发现,向HFD 小鼠喂养低聚果糖导致双歧杆菌数量大大增加,从而减少LPS 产生的炎症标志物;Joossens 等[8]报道17 名志愿者摄入富含低聚果糖的菊粉,导致双歧杆菌和青春双歧杆菌物种的显著增加。益生元的种类有很多,主要包括低聚糖类、多元醇、蛋白质水解物以及天然植物提取物等。目前研究和应用较多的是功能性低聚糖类,如低聚木糖和低聚果糖。植物提取物作为天然食品的来源具有更好的发展优势和前景,符合人们对健康饮食潮流的追求。
人参是天然植物资源的一种,其药用历史已有4 000 余年[9]。根据《中华人民共和国食品安全法》和《新资源食品管理方法》的规定,2012年8月29日批准人参(人工种植)为新资源食品,由此人参作为药食兼用植物进入日常生活中[10]。红参是人参蒸制干燥后的熟制品,富含人参皂苷、多糖[11]、多肽、微量元素和氨基酸等多种营养物质,具有补气、补血,复脉固脱、安神定魂和止惊悸等功效,又因其具有提高免疫力,抗肿瘤、抗辐射以及抗衰老等生理功能而被广泛应用于医药和化妆品领域等。目前对红参多糖的研究不多,主要集中在提取、纯化和鉴定以及药理与临床应用等方面,其作为益生元的益生功能方面的研究几乎没有[12]。仅本实验室丁硕[13]曾研究红参等9 种健脾胃天然植物对益生菌体外生长的影响。对红参作为益生元研究的缺乏,限制了红参的应用。有必要研究红参对乳酸菌的体外增菌效果。
本试验中以红参为主要材料,以典型益生元低聚木糖和低聚果糖[14-15]为参照,研究红参对典型益生菌鼠李糖乳杆菌AS 1.2466T和传统发酵菌保加利亚乳杆菌ATCC 11842 两株菌体外生长的影响,为红参调节小鼠肠道菌群失调的体内试验奠定基础,也为发掘功能性食品与饲料奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 菌种 鼠李糖乳杆菌(Lactobacillus rhamnosus)AS 1.2466T、德式乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp.bulgaricus)ATCC 11842,中国普通微生物菌种保藏中心。
1.1.2 原材料 红参片,保定市普康大药房提供;低聚果糖(FOS)和低聚木糖(XOS),保龄宝生物股份有限公司。
1.1.3 发酵培养基
1)基础培养基 蛋白胨10 g,牛肉膏3 g,氯化钠5 g,蒸馏水定容1 L,121 ℃,15 min 灭菌。
2)菊芋汁基础培养基 菊芋→清洗称重→加水(m料∶m水=1∶1)→加热灭酶(100 ℃,5 min)→加水捣碎(补加适量 80 ℃水)→过滤(100 目滤布)→滤渣加水压榨→加水定容100 mL→调配(糖度约10 Brix,pH 6.5~7.0)→加热灭菌(121 ℃15 min)→冷却,备用。
1.1.4 主要设备与仪器 FLC-3 超净台,哈尔滨市东联公司;YXQG02 型电热式蒸汽消毒器,山东新华医疗器械厂;SPX-150B-Z 型生化培养箱,上海博迅实业有限公司;TGL16M 型离心机,长沙市易达科贸公司;GR-206SVQ 型LG 冰箱,泰州乐金电子冷机有限公司;TU-1810 紫外分光光度计,北京普析通用仪器有限责任公司。
1.2 试验方法
1.2.1 菌株生长曲线的绘制 鼠李糖乳杆菌AS 1.2466T/保加利亚乳杆菌ATCC 11842 经MRS 液体培养基活化至109CFU/mL/108CFU/mL,以1%的接种量接种于基础培养基/菊芋汁基础培养基和液MRS 中,37 ℃/42 ℃培养,每隔2 h 取样测定OD600值。以培养时间为横坐标,OD600值为纵坐标,绘制两株菌在不同培养基中的生长曲线。
1.2.2 红参多糖含量的测定
1)红参提取液制备 称取红参100 g,加水200 mL 浸泡过夜,置于95 ℃水浴3 h,过滤,取滤渣加水200 mL 继续水浴,最后合并滤液浓缩至100 mL,按照药液质量分数100 g 红参∶100 g 水定义为100%原药液。
2)红参酸水解物制备[16]模拟人体胃环境,将红参提取液pH 值调为3.0,37 ℃培养箱恒温4 h,制成红参酸水解物。
3)红参多糖含量测定 采用苯酚硫酸法[12]测定红参提取液多糖含量。分别取葡萄糖标准溶液0,0.2,0.4,0.6,0.8,1.0 mL,补水至2 mL,摇匀。各加入1 mL 的5%苯酚溶液,摇匀后迅速加入5.0 mL 浓硫酸,混匀,静置10 min 后40 ℃水浴15 min,冷却至室温,测定OD490值。以OD490值为纵坐标,葡萄糖标准液浓度为纵坐标,绘制葡萄糖标准曲线。吸取红参提取液1 mL,稀释到合适倍数,以1 mL 蒸馏水为空白对照,按照上述操作测定红参提取液的多糖含量。
1.2.3 3 种益生元对两株乳酸菌体外生长的影响
向基础培养基/菊芋汁基础培养基中添加质量分数为0%,3.125%,6.25%,12.50%,25%和50%的红参提取液及其酸水解物以及0%,0.4%,0.8%,1.2%,1.6%和2.0%的低聚果糖和低聚木糖。将活化好的鼠李糖乳杆菌AS 1.2466T/保加利亚乳杆菌ATCC 11842 以1%接种量接种于基础培养基/菊芋汁基础培养基及其添加不同量益生元的基础培养基/菊芋汁基础培养基中,37 ℃/42℃恒温培养至对数生长末期,取菌,测定其吸光度OD600和活菌数。根据OD600值和活菌数比较红参提取液及其酸水解物和两种低聚糖对鼠李糖乳杆菌AS 1.2466T和保加利亚乳杆菌ATCC 11842 体外生长的作用。
2 结果与分析
2.1 菌株生长曲线的测定
鼠李糖乳杆菌AS 1.2466T和保加利亚乳杆菌ATCC 11842 生长曲线测定结果见图1、2。
由图1可知,鼠李糖乳杆菌AS 1.2466T在MRS 和基础培养基中均在14 h 达到对数生长末期,此时的OD600值分别为1.634 和0.357,相对应活菌数分别为1.45×109CFU/mL 和7.75×107CFU/mL。

图1 鼠李糖乳杆菌AS 1.2466T 在MRS和基础培养基中的生长曲线Fig.1 The growth curve of Lactobacillus rhamnosus AS 1.2466T in MRS medium and basic culture medium

图2 保加利亚乳杆菌ATCC 11842 在MRS和菊芋汁培养基中的生长曲线Fig.2 The growth curve of Lactobacillus delbrueckii subsp.bulgaricus ATCC 11842 in MRS medium and Jerusalem artichoke juice base medium
由图2可见,保加利亚乳杆菌ATCC 11842在MRS 培养基中16 h 时进入对数生长末期,此时OD600值为1.272,对应活菌数为3.25×108CFU/mL。在菊芋汁基础培养基中18 h 达到对数生长末期,此时OD600值为0.331,对应活菌数为1.48×107CFU/mL。
以上结果表明,鼠李糖乳杆菌AS 1.2466T和保加利亚乳杆菌ATCC 11842 均可在相应基础培养基中生长,并且生长趋势没有明显变化。最终确定两种基础培养基的可应用性以及两株菌的取菌时间分别为14 h 和16 h。
2.2 红参提取液多糖浓度的测定
葡萄糖标准曲线见图3。通过葡萄糖标准曲线来计算红参提取液中的多糖浓度。红参提取液多糖质量浓度为(1.0605×105±0.0367)μg/mL。
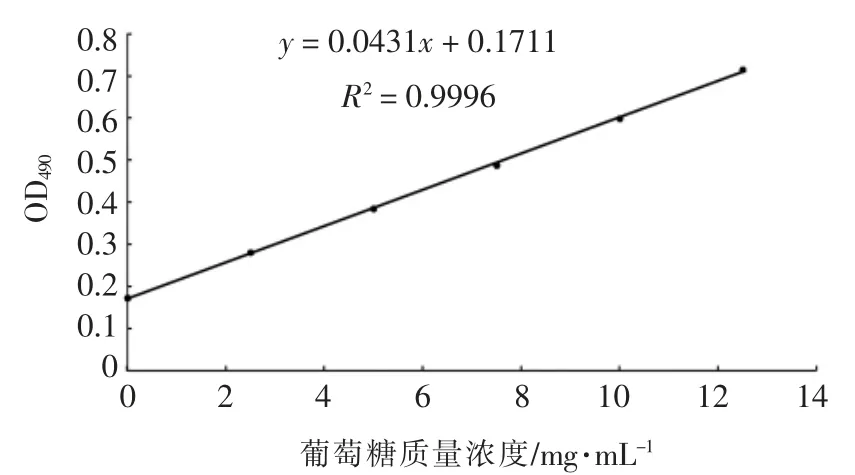
图3 葡萄糖标准曲线Fig.3 Standard curve of glucose
2.3 不同益生元对乳酸菌体外生长的影响
低聚木糖和低聚果糖对鼠李糖乳杆菌AS 1.2466T和保加利亚乳杆菌ATCC 11842 的增菌效果如图4所示。
由图4可知,对两株菌增菌效果较优的均为低聚木糖,其添加量为0.8%时鼠李糖乳杆菌AS 1.2466T的OD600值最大为0.986,活菌数为1.03×108CFU/mL,相较于基础培养基中最大活菌数7.75×107CFU/mL 增加1 个数量级。低聚果糖的增菌效果虽弱于低聚木糖,但其OD600值和活菌数均比基础培养基的高,其最适添加量为1.2%时OD600值最大值为0.659,活菌数为9.65×107CFU/mL。此结果和Zhao P L 等[17]的研究结果相似。
低聚木糖添加量为0.4%时保加利亚乳杆菌ATCC 11842 的最大OD600值为0.586,活菌数为2.13×108CFU/mL,比菊芋汁基础培养基中最大活菌数1.48×107CFU/mL 增加1 个数量级。随着低聚木糖浓度的增加,增菌效果呈明显的下降趋势,在其添加量为2.0%时出现抑制菌株生长的现象。低聚果糖的增菌效果不明显,当添加量为1.2%时OD600值为0.444,活菌数相较于菊芋汁基础培养基并没有数量级增加,和舒国伟等[18]的研究结果不一致,这是因为益生元对益生菌的促生长作用具有菌株差异性[19]。此外,低聚木糖和低聚果糖对菌株生长的影响均表现为低浓度促进,高浓度抑制现象[20],这和文宇婷等[21]的研究结果相一致。
红参作为药食兼用植物在进入机体后,经过pH 3.0 的胃液消化1~2 h[22]。将红参提取液在人工胃环境中消化2 h 制成红参酸水解物。红参提取液及其酸水解物对鼠李糖乳杆菌AS 1.2466T和保加利亚乳杆菌ATCC 11842 的增菌效果如图5所示。
由图5可知,红参提取液及其酸水解物对鼠李糖乳杆菌AS 1.2466T和保加利亚乳杆菌ATCC 11842 均有促生长作用。当红参提取液添加量为12.50%时,鼠李糖乳杆菌AS 1.2466T最大OD600值为1.172,此时活菌数为1.17×108CFU/mL,比基础培养基中最大活菌数7.75×107CFU/ mL 增加1个数量级;当红参提取液添加量为6.25%时,保加利亚乳杆菌ATCC 11842 最大OD600值为0.627,此时活菌数为4.43×108CFU/mL,比菊芋汁基础培养基中最大活菌数1.48×107CFU/mL 增加1 个数量级。
当红参酸水解物添加量为3.125%时,鼠李糖乳杆菌AS 1.2466T和保加利亚乳杆菌ATCC 11842均达到最大OD600值,分别为1.048 和0.678,此时最大活菌数分别为1.05×108CFU/mL和1.03×108CFU/mL,均比对应基础培养基中的活菌数增加1 个数量级。
此外,红参提取液及其酸水解物的添加量并非越高越好。当红参提取液添加量为25%时开始抑制保加利亚乳杆菌ATCC 11842 的生长,其对鼠李糖乳杆菌AS 1.2466T的促生长作用也随着红参提取液浓度的增加而逐渐下降。两株菌的OD600值和红参酸水解物的添加量呈负相关,当红参酸水解物添加量为12.50%时开始抑制保加利亚乳杆菌ATCC 11842 的生长,当其添加量为50%时抑制鼠李糖乳杆菌AS 1.2466T的生长,这可能是因为红参多糖经酸水解后分解为小分子多糖,可以更好地被菌株吸收利用,然而多糖浓度过高诱导菌体因高渗透环境而脱水,抑制其生长,甚至死亡[11],说明益生元的添加量并非越高越好。
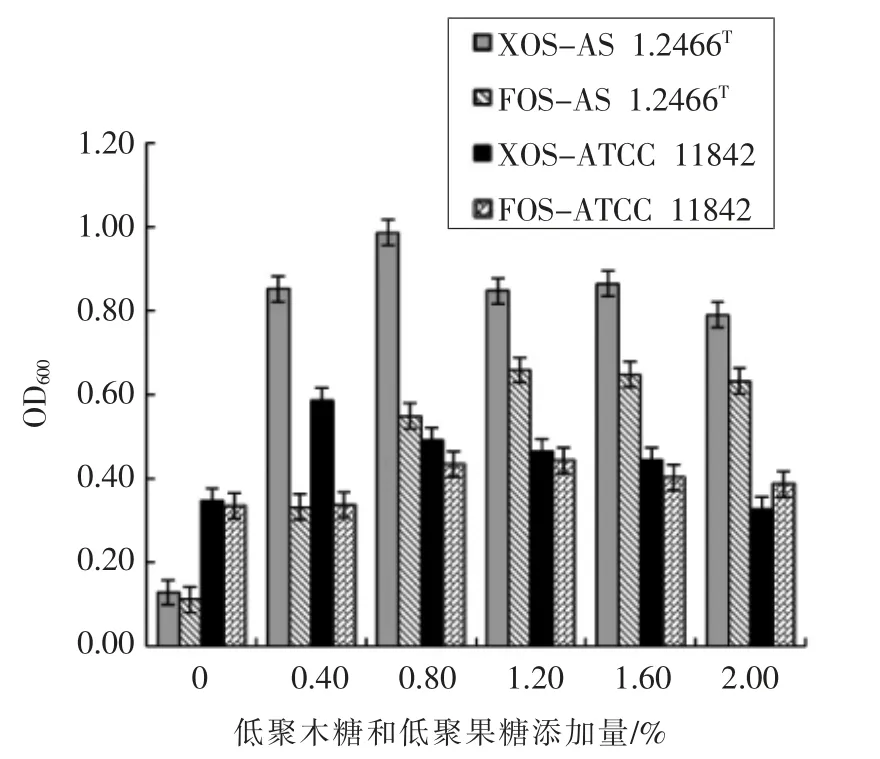
图4 低聚木糖和低聚果糖对鼠李糖乳杆菌AS 1.2466T和保加利亚乳杆菌ATCC 11842 体外生长的影响Fig.4 The effect of XOS and FOS on the growth of Lactobacillus rhamnose AS 1.2466T and Lactobacillus bulgaricus ATCC 11842 in vitro
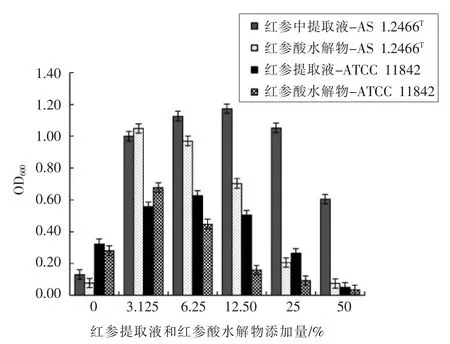
图5 红参提取液和红参酸水解物对鼠李糖乳杆菌AS 1.2466T和保加利亚乳杆菌ATCC 11842 体外生长的影响Fig.5 The effect of Red ginseng liquid medicine and its acid hydrolyzate on the growth of Lactobacillus rhamnose AS 1.2466T and Lactobacillus bulgaricus ATCC 11842 in vitro
3 讨论
功能性低聚糖是传统、公认、被研究最多的益生元,虽不被人体消化吸收但被肠道菌群利用,对宿主产生有益影响。本试验通过体外培养的方法,得到红参提取液对保加利亚乳杆菌ATCC 11842和鼠李糖乳杆菌AS 1.2466T的增菌效果显著优于低聚木糖和低聚果糖,表明红参作为一种新型天然植物益生元,具有较好的研究价值和发展前景。
乳酸菌在乳制品发酵和储藏过程中的活菌数决定着该乳制品益生功效的高、低[23]。乳酸菌活菌数的增加对解决乳制品发酵和储藏期间活菌数低的问题具有重要意义。保加利亚乳杆菌是发酵乳制品中最常用的乳酸菌,也是最具商业价值的乳酸菌之一,被广泛应用于酸奶的发酵[24]。鼠李糖乳杆菌是典型的益生菌,可以耐受胃酸和胆盐而长时间地定植在人体肠道中[25],具有调节宿主肠道微生态和免疫力的功能,其在发酵期间只产生1种L-乳酸,不会产生对产品口感和安全性有影响的其它酸类物质而被广泛应用于保健品和功能性乳品中[26]。本试验用这两株菌为试验菌株,研究发现,在菊芋汁基础培养基/基础培养基中添加红参提取液或红参酸水解物,均可使保加利亚乳杆菌ATCC 11842/鼠李糖乳杆菌AS 1.2466T的活菌数增加1 个数量级,红参提取液对保加利亚乳杆菌的增菌效果是低聚木糖的两倍。实际应用本研究结果,有助于乳制品企业合理设计添加红参的发酵乳制品,这对于生产营养保健功能的发酵乳制品具有重要意义。刘彦亮等[27]研究表明,桠胡芦和芦根可分别促进双歧杆菌活菌数达到3.2×108CFU/mL 和1.7×108CFU/mL。本研究显示红参可以促进保加利亚乳杆菌活菌数达到4.43×108CFU/mL,此结果与文献[6]至[8]报道的低聚果糖促进双歧杆菌物种增加的结果相似,红参也具有较好的促保加利亚乳杆菌和鼠李糖乳杆菌生长作用。与丁硕[13]的研究结果相似,红参不仅对双歧杆菌和鼠李糖乳杆菌具有促生长作用,对保加利亚乳杆菌ATCC 11842 也有促生长作用。李艳丽等[28]研究表明,低聚木糖可使枯草芽孢杆菌增殖183%。陈虹等[29]研究表明新琼寡糖可使保加利亚乳杆菌增殖77.6%。本研究结果:红参对保加利亚乳杆菌的增殖作用高达299%,红参的增殖作用远远高于低聚木糖和新琼寡糖,表明红参具有较好的益生元特性。
4 结论
低聚木糖增菌效果优于低聚果糖,添加量分别为0.8%和0.4%时鼠李糖乳杆菌AS 1.2466T和保加利亚乳杆菌ATCC 11842 增菌效果最佳。红参提取液及其酸水解物对鼠李糖乳杆菌AS 1.2466T和保加利亚乳杆菌ATCC 11842 均有更好的促生长作用。当红参提取液添加量分别为12.50%和6.25%时,鼠李糖乳杆菌AS 1.2466T和保加利亚乳杆菌ATCC 11842 增菌效果最佳。不同添加物对鼠李糖乳杆菌AS 1.2466T的增菌效果为红参提取液>红参酸水解物>低聚木糖>低聚果糖。对保加利亚乳杆菌ATCC 11842 的增菌效果为红参提取液>低聚木糖>红参酸水解物>低聚果糖。红参显示出优良的益生元特性。
