母乳婴儿源乳杆菌的筛选及其免疫调节能力研究
2020-05-24赵丽娜王妙姝康红艳田洪涛罗云波
张 娜 张 波 赵丽娜 王妙姝 康红艳 田洪涛* 罗云波
(1 河北农业大学食品科技学院 河北保定071000 2 保定学院生物化工与环境工程学院 河北保定071000 3 国家北方山区农业工程技术研究中心 河北保定071000 4 河北新希望天香乳业有限公司 河北保定071000 5 中国农业大学食品科技与营养工程学院 北京100083)
肠道菌群由数万亿微生物、数百万功能基因组成,在人体发育、肠道屏障、物质代谢、营养吸收等方面发挥着巨大的作用。婴儿时期是机体肠道菌群建立的关键时期,最初的肠道组分可显著影响免疫系统的发育,甚至对健康产生长期影响[1]。母乳是婴儿最理想的天然食品,可为婴儿持续提供能够定植于肠道的益生菌, 从而促进婴儿肠道发育与免疫系统的成熟[2]。据报道[3]:中国中西部地区纯母乳喂养率为76.8%,超过6 个月者仅为16.4%,与《中国儿童发展纲要(2011—2020)》[4]提出的0~6 个月婴儿纯母乳喂养率达到50%以上的要求相差甚远。为了解决不能接受母乳喂养或母乳喂养不足婴儿的营养支持问题,人们开始在配方奶中添加益生菌来模仿母乳的成分。母乳喂养与配方食品喂养婴儿之间的显著差别是肠道微生物,母乳喂养婴儿粪便中微生物以双歧杆菌(Bifidobacteria)为主,乳杆菌(Lactobacillus)次之,而在配方食品喂养的婴儿粪便中,占主导的是拟杆菌属(Bacteroides),约为40%[5]。母乳喂养婴儿粪便中的双歧杆菌和乳杆菌属菌株可作为筛选益生菌的备选菌株。
乳杆菌属细菌作为肠道主要益生菌之一,不仅可以增强非特异性免疫(增强吞噬功能和自然杀伤细胞活力),而且对特异性免疫(增强抗体的产生,增强细胞因子的表达)也发挥重要作用[6]。目前,提高机体免疫力的益生菌在国际市场上方兴未艾,母乳婴儿源具有免疫调节功能益生菌的筛选与研究也在世界范围如火如荼地进行。例如:Plaza[7]以体外粘附肠黏液能力,对抗生素敏感性以及对胆盐和低pH 值的耐受性为标准,从婴儿粪便中筛选出副干酪乳杆菌CNCM I-4034 和鼠李糖乳杆菌CNCM I-4036,并通过志愿者双盲实验评价菌株的免疫调节能力。Pan[8]从婴儿粪便中分离到的嗜酸乳杆菌NIT 能够耐受低pH 值和胆盐环境,并可在Caco-2 细胞上粘附,具有免疫调节的潜能。妥彦峰[9]通过模拟胃、肠液对HT-29 的粘附能力,与人外周血单核细胞共同培养,从健康婴儿粪便中筛选出1 株具有免疫调节能力的菌株:鼠李糖乳杆菌IN1ANL。研究表明:同一种属的益生乳酸菌,其生理功能可能差别很大[10]。菌株OR-1 和LGG 均为鼠李糖乳杆菌,OR-1 适于防治女性阴道炎,而LGG 适于缓解婴儿湿疹。我国民族众多,具有丰富的婴幼儿源益生乳酸菌资源,筛选具有自主知识产权的婴幼儿源益生乳酸菌优良菌种,开发婴幼儿益生乳酸菌新食品,势在必行。
本研究以母乳喂养婴儿粪便中分离出的4 株乳杆菌为出发菌株,通过体外试验筛选具有一定抗逆性的潜在益生菌,对其免疫调节活性作初步评价,为开发模拟母乳婴幼儿配方奶粉及其益生菌产品提供菌种资源与技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株 鼠李糖乳杆菌BF-1、植物乳杆菌BF-15、唾液乳杆菌BF-29、干酪乳杆菌BF-55 分离自母乳源婴儿粪便,由本实验室保藏;鼠李糖乳杆菌GG(ATCC53103),购自中国微生物菌种保藏管理委员会普通微生物中心;指示菌金黄色葡萄球菌(Staphylococcus aureus)ATCC 25923,购自中科院微生物研究所。
1.1.2 细胞株 Caco-2 细胞来自中国科学院上海生命科学研究院细胞资源中心。
1.1.3 培养基和试剂 RPMI-1640 培养液、0.25%胰酶〔含0.02%乙二胺四乙酸(EDTA)〕、二甲基亚砜(DMSO)、4-甲基偶氮唑盐(MTT)、刀豆球蛋白(ConA),北京索莱宝科技有限公司;胎牛血清,杭州四季青生物工程材料有限公司;标准药敏纸片,北京天坛药物生物技术开发公司;酵母浸出粉、蛋白胨和牛肉膏等均为分析纯级。
1.2 试验动物
昆明系6 周龄雌性小鼠,体重(20 ± 2)g,北京维通利华实验动物技术有限公司提供。
1.3 主要仪器和设备
酶标仪,美国Thermo 公司;DL-CJ-1N 型超净工作台,哈尔滨东联电子技术开发有限公司;立式压力蒸汽灭菌器,上海博迅实业有限公司;SHP-250 型生化培养箱,上海精宏实验设备有限公司;HF90 型二氧化碳培养箱,HealForce 公司;5417R高速冷冻离心机,德国Eppendorf。
1.4 试验方法
1.4.1 供试菌株的生理特性
1.4.1.1 菌悬液的制备 将供试菌株按1%接种量接种于MRS 液体培养基中,待菌体生长至稳定期(16~18 h),离心(6 000 r/min,7 min,4 ℃),收集,用PBS 洗涤2 次。洗涤后的菌体悬浮于PBS中,调整菌体含量为(1~2)×109CFU/mL,备用。
1.4.1.2 菌株对人工胃液和胰液的耐受性 人工胃液和胰液参照Usman[11]的方法制备。准确吸取1.0 mL 供试菌液加到9 mL 人工胃液(pH 3.0)中,于37 ℃消化3 h,然后再吸取1.0 mL 消化3 h pH 3.0 的人工含菌胃液,加到9 mL 人工肠液(pH 8.0)中,37 ℃放置4 h,分别对人工消化液处理0 h和7 h 的菌液进行活菌计数,计算存活率[12]。

1.4.1.3 供试菌株对胆盐的耐受性 耐胆盐基础液参照Jaya Prasad[13]的方法制备。将调整好浓度的供试菌悬液以体积分数1%的接种量接种到上述处理过的培养基中,37 ℃恒温培养,分别于0,4 h 取样,用平板计数法测定活菌数。计算存活率[11]。

1.4.1.4 供试菌株对Caco-2 细胞粘附能力的测定 参照熊涛等[14]的方法制备Caco-2 细胞和菌悬液,采用血球计数板计算细胞浓度,平板计数法计算黏附的细菌数,计算获得单个细胞黏附菌株的数量。

1.4.2 供试菌株的安全性研究
1.4.2.1 药敏性试验 采用药敏纸片琼脂扩散法[15],按使用说明书将药敏片均匀放在各涂布均匀的培养基上,37 ℃培养48 h,记录各药敏纸片的抑菌圈直径。以标准菌株金黄色葡萄球菌ATCC25923作为对照。
1.4.2.2 质粒的提取 用质粒小量抽提试剂盒(康为世纪)提取,将提取的质粒进行1%的琼脂糖凝胶电泳检测。
1.4.3 供试菌株体外免疫调节活性研究
1.4.3.1 小鼠脾淋巴细胞悬液及菌悬液的制备参照李艾黎等[16]的方法制备小鼠脾淋巴细胞悬液及菌悬液。
1.4.3.2 供试菌株体外对脾淋巴细胞增殖的影响
参照李艾黎等[16]的方法,用酶标仪在波长570 nm 处测定OD 值,计算淋巴细胞增殖指数(PI)。

式中:OD1——试验组OD 值;OD2——阴性对照组OD 值;OD3——乳酸菌OD 值;PI >1 时促进增殖;PI <1 时抑制增殖。
1.4.4 统计学分析 所有试验均重复3 次,数据处理采用Excel2003 软件,结果以平均值±标准差表示。显著性(P<0.05)分析采用SPSS17.0 软件,多重比较采用Duncan 新复极差法。
2 结果与分析
2.1 供试菌株的生理特性
2.1.1 菌株对人工胃液和胰液的耐受性 采取连续培养方式测定供试菌株对人工消化液的耐受情况,结果见表1。
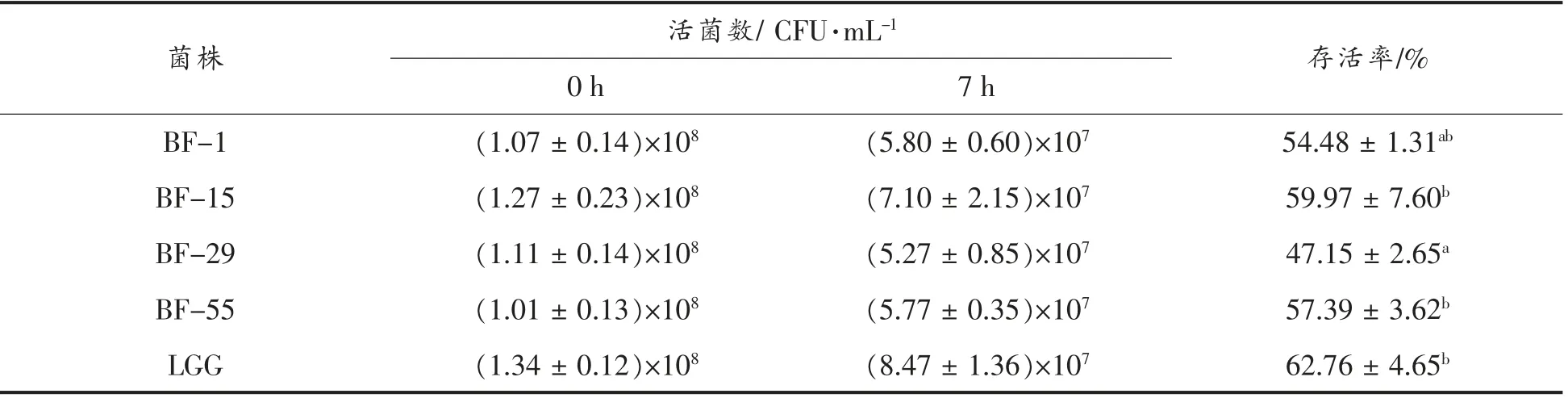
表1 供试菌株对模拟消化液的耐受性Table1 The artificial digestive fluid-tolerant of the tested strains
表1可见:经人工消化液处理7 h,供试菌株的存活率分别为(54.48±1.31)%,(59.97±7.60)%,(47.15±2.65)%,(57.39±3.62)%,其中以植物乳杆菌BF-15 的存活率最高,略低于阳性对照菌株LGG(62.76 ±4.65)%,差异不显著(P>0.05),表明供试菌株在较低pH(3.0)的人工胃液环境下能够较好地存活并生长,这与Mcdonaldm 等[17]发现在植物乳杆菌中存在酸耐受反应系统相符。
2.1.2 菌株对胆盐的耐受性 将供试菌株于胆盐质量浓度为0.3 g/100 mL 的MRS 液体培养基中作用4 h,测定其活菌数的变化情况,结果见表2。

表2 供试菌株的耐胆盐试验结果Table2 Bile salt tolerance test result of the tested strains
表2可见:植物乳杆菌BF-15 的存活率高达(77.69±0.29)%,而其余供试菌株和阳性对照菌株LGG 在0.3%胆盐含量下作用3 h 后生长完全被抑制,表明植物乳杆菌BF-15 在一定程度上可有效消除胆盐胁迫所带来的不利影响,在人体胆盐生理浓度范围保持较高的活性,较好的胆盐耐受性。
2.1.3 菌株对细胞的黏附性能 利用Caco-2 细胞培养物对4 株乳杆菌的黏附能力进行评价,结果见表3。
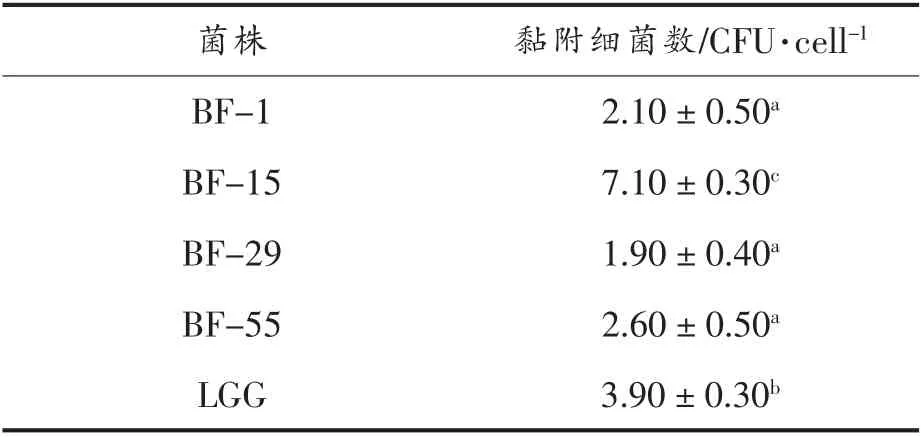
表3 供试菌株对Caco-2 细胞的黏附作用Table3 Adhesion of the tested strains to Caco-2
表3所示:黏附率依次为植物乳杆菌BF-15>鼠李糖乳杆菌LGG>干酪乳杆菌BF-55>唾液乳杆菌BF-1>鼠李糖乳杆菌BF-29,其中BF-15 的黏附能力最强(7.10±0.30)CFU/cell,显著高于阳性对照菌株LGG:(3.90±0.30)CFU/cell(P<0.05),表明供试菌株具有肠道定植的潜力。综合考虑2.1 节和2.2 节试验结果,筛选具有较强抗逆性和粘附性菌株——植物乳杆菌BF-15 为候选菌株。
2.2 候选菌株的安全性
候选菌株对常用8 大类21 种抗生素的敏感性见表4,质粒提取结果见图1。
表4可见:受试植物乳杆菌BF-15 对氨苄西林、青霉素G、头孢哌酮、头孢他啶、红霉素、乙酰螺旋霉素、阿奇霉素、麦迪霉素、四环素、米诺环素、阿莫西林、哌拉西林、氯霉素、利福平均敏感,对苯唑西林、头孢噻吩、庆大霉素、卡那霉素、链霉素、新霉素、万古霉素均耐药。与LGG 相比,对头孢他啶、卡那霉素、哌拉西林表现出不同的耐药性。图1可见:植物乳杆菌BF-15 不含质粒。由此表明BF-15 虽对部分抗生素耐受,但不含有耐药性质粒,具有一定的安全性。
2.3 活性和热致死菌株体外对小鼠脾细胞的增殖作用
植物乳杆菌BF-15 和鼠李糖乳杆菌LGG 体外对小鼠脾细胞增殖作用见图2。
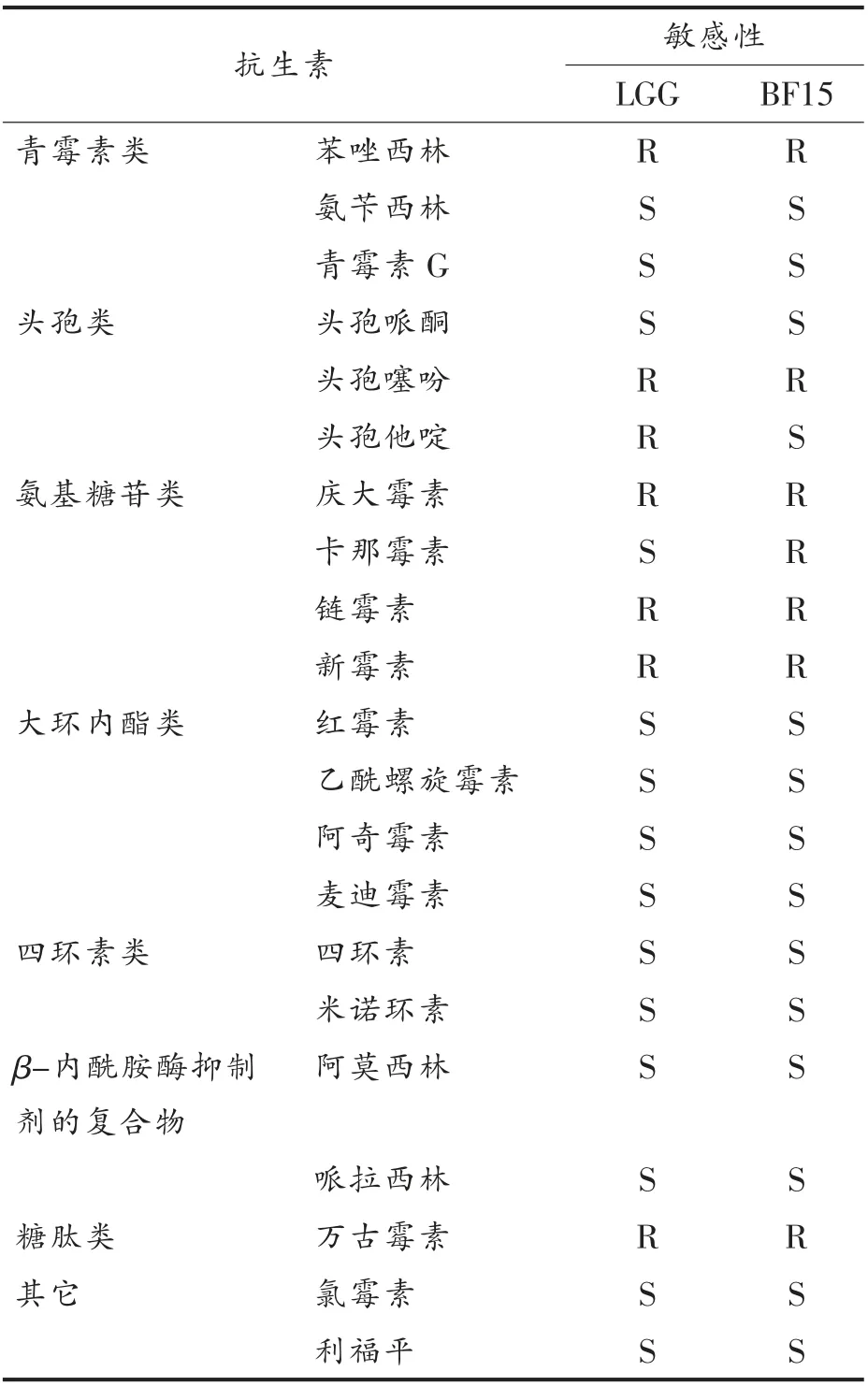
表4 植物乳杆菌BF-15 和鼠李糖乳杆菌GG对常见抗生素的敏感性Table4 Sensitivity of L.plantarum BF-15 and L.rhamnosus GG to common antibiotics

图1 BF-15 质粒提取电泳图Fig.1 Electrophoresis strip map of plasmid
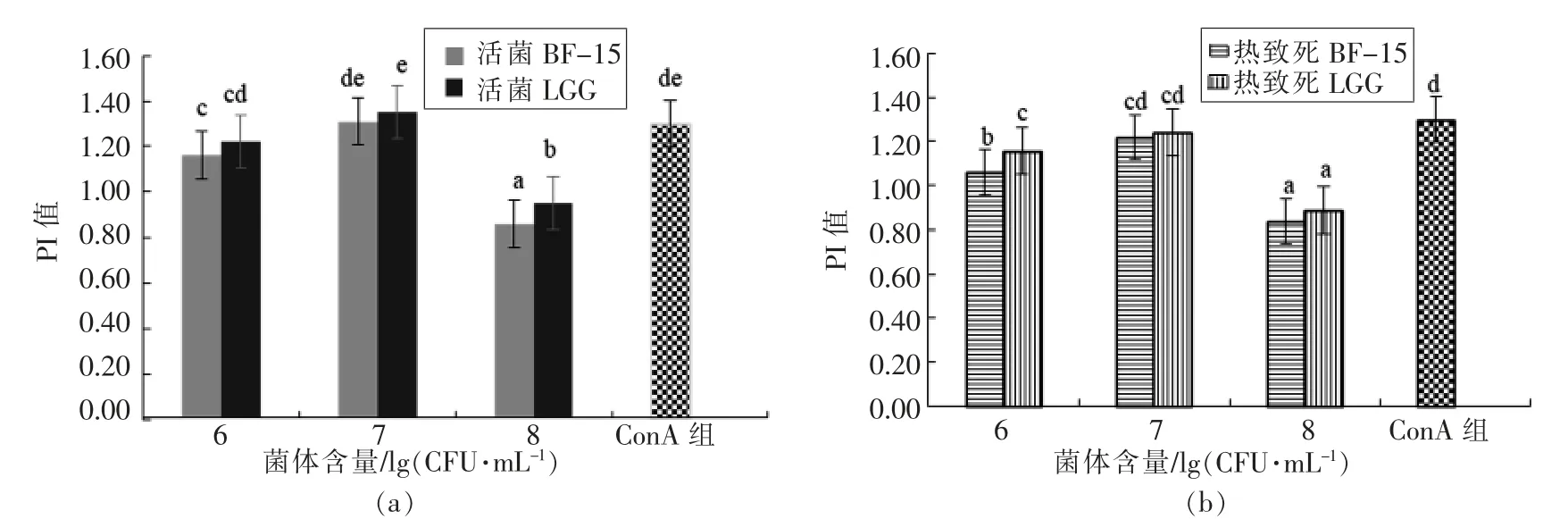
图2 不同种属、剂量的活菌和热致死乳杆菌对淋巴细胞增值指数的影响Fig.2 Effect of active/heat-killed Lactobacillus strains of different species and concentrations on lymphocyte proliferation index of spleen cells
图2所示:对于活菌而言,菌含量为107CFU/mL 时,BF-15 和LGG 对脾淋巴细胞的增值效果与ConA 组没有显著差异(P>0.05),而菌终含量为106CFU/mL 时,BF-15 和LGG 的促增殖效果显著低于ConA 组(P<0.05)。对于死菌而言,在菌含量为107CFU/mL 时,BF-15 和LGG 对脾细胞的增值效果低于ConA 组,差异不显著(P>0.05);在菌含量为106CFU/mL 时,BF-15 对脾细胞的增值效果显著低于ConA 组(P<0.05)。无论活菌还是死菌,在相同菌浓条件下,BF-15 和LGG 的促增殖效果没有显著差异(P>0.05),表明植物乳杆菌BF-15或其代谢产物对小鼠淋巴细胞增殖作用有促进效果,具有一定的免疫调节能力。
3 讨论
益生乳酸菌除经胃消化外,还须经小肠消化转运才能到达目的地,定殖并发挥益生作用。对肠道上皮细胞的黏附作用有助于其在肠道定植,增强与肠道细胞之间的信号交流和提高机体的免疫力[18]。对消化液和胆盐的耐受及其黏附能力是评价能否作为益生菌的重要标准[19]。Crociaco[20]研究发现不同双歧杆菌在体外对Caco-2 细胞的黏附能力与其体内黏附肠上皮细胞能力基本保持一致,从而明确了应用Caco-2 细胞作为体外模型评价益生菌黏附性能的有效性。张莉等[21]从健康婴儿粪便中分离的植物乳杆菌FA6,在pH 2.5 条件下存活率在70%以上,在0.3%胆盐中的存活率在90%以上,而对Caco-2 细胞的黏附率仅2%,即2 CFU/cell。李晓颖[22]从婴儿源分离的植物乳杆菌PBIL1-018 和PBIL1-027,在pH 3.0 人工消化液的存活率分别为95.83%和97.03%,在0.3%胆盐中的存活率分别为21.17%和51.20%。与之相比,本研究从婴儿源乳杆菌中筛选出的植物乳杆菌BF-15 具有较强综合性能,在pH 3.0 人工消化液中存活率为59.97%,0.3%胆盐中存活率为77.69%,对Caco-2 细胞的黏附率为7.10 CFU/cell,高于阳性对照菌株LGG。Argyri 等[23]认为通过模拟胃、肠道条件对乳杆菌进行体外筛选,只能预测菌株在无食物保护条件下的体内存活状况,与菌株在机体肠道中的真实存活能力存在一定偏差。在实际应用中,菌株的抗逆性还需通过体内试验来进一步验证。
益生菌安全性评价指导原则将益生菌的耐药性评价放在首位[24]。K-B 纸片扩散法因操作简单、耗时短、成本小等优点而成为目前应用最广泛的药敏测定方法。据报道乳酸杆菌对万古霉素、氨基糖苷类、糖肽类抗生素为固有耐药[25~26],而固有耐药是由细菌染色体上的抗性基因操控着天然耐药性状是否表达,一般不具有传递性。本研究中植物乳杆菌BF-15 除具备固有耐药性外,还对苯唑西林、头孢噻吩有耐药性,与李平兰[27]报道的植物乳杆菌除对氨基糖苷类耐受/中度敏感外,还对苯唑西林耐受,对头孢噻吩中度敏感相似。同时BF-15中不存在抗性质粒,即不存在耐药因子传递的危险,具备一定的安全性和潜在的应用价值。
目前,常采用动物实验方法筛选具有免疫活性的乳酸菌,因其周期长、耗费大、效率低,故实际应用受到极大限制。细胞模型也是快速筛选功能性成分的重要方法之一。淋巴细胞是机体最重要的免疫细胞,可在许多非特异性物质(包括菌体成分)的刺激下发生转化、增殖或产生某些生物活性物质(如细胞因子)等,通过检测这些刺激效应,筛选出具有直接刺激效应的免疫活性物质[28]。2010年李艾黎[16]通过体外评估7 种乳杆菌的免疫作用,在国内首次证明正常离体小鼠脾脏淋巴细胞可用于体外初步筛选具有潜在免疫活性的乳杆菌。本研究参照李艾黎[16]的方法对植物乳杆菌BF-15 进行体外免疫评价,结果与其一致,即:活性和热致死乳杆菌对小鼠脾脏淋巴细胞增殖均有不同程度的影响,活菌制剂的免疫调节作用优于热致死菌体制剂(P<0.05),并且在相同剂量条件下,与阳性对照菌株LGG 没有显著性差异(P>0.05),表明植物乳杆菌BF-15 具有一定的免疫调节活性。
本文通过体外试验对母乳婴儿源乳杆菌的生物学特性、安全性及免疫活性进行评价,最终筛选出1 株具有潜在免疫调节功能的菌株——植物乳杆菌BF-15。该菌株具备顺利通过婴儿胃、肠道并在肠道中定殖、繁殖及免疫调节的潜质,可缓解因配方奶粉喂养而导致的婴儿肠道内乳杆菌数量衰减及免疫功能低下的症状,为今后开发用于婴幼儿/免疫低下人群的益生菌产品提供优质的菌种资源。体外实验虽然影响因素小,可控性好,效率高,但是是否能够真正模拟体内环境,还需设计体内实验加以印证。
