Dach1表达下调促进结肠癌细胞SW480侵袭和迁移的机制研究*
2020-05-21王金泗蔡少鑫程雪飞刘立航林孟波
王金泗,蔡少鑫,曾 伟,程雪飞,刘立航,林孟波
福建医科大学省立临床医学院,福建省立医院肿瘤外科,福州 350001
Dachshund家族转录因子1(Dach1)是RDGN网络通路上的重要抑癌基因,已有报道称Dach1在结直肠癌中低表达,其机制可能与其启动子甲基化有关,但Dach1对结直肠癌侵袭转移功能的影响尚未见报道。低表达Dach1可以通过影响TGF-β通路而抑制多种实体瘤如乳腺癌、前列腺癌的侵袭转移,因此存在潜在的影响结直肠癌侵袭转移的功能。本研究通过下调结肠癌细胞系SW480的Dach1表达后,进一步研究其对SW480细胞迁移、侵袭的作用变化,并研究其可能的分子生物学机制。
1 材料与方法
1.1 主要细胞、试剂和培养液
SW480细胞购自ATCC;DMEM培养液及新生小牛血清购自Hyclone公司;转染用无血清Opti-MEMI购自Sigma公司;荧光素酶实验试剂盒购买于Promega公司;Zeb1、GAPDH的荧光定量PCR引物由上海英骏生物有限公司合成;miR-200b,miR-200c,U6引物,miR-200c mimics及对照,si-Dach1,RNA逆转录试剂盒及转染试剂盒购买于锐博公司。序列为:si-Dach1正义链:5′-GCCUCCUAAGAGGACUCAATT-3′,反义链:5′-UUGAGUCCUCUUAGGAGGCTT-3′);RNAi阴性对照正义链:5′-UUCUCCGAACGUGUCACGUTT-3′,反义链:5′-ACGUGACACGUUCGGAGAATT-3′);GAPDH正义链:5′-GGAGCGAGATCCCTCCAAAAT-3′,反义链:5′-GGCTGTTGTCATACTTCTCATGG-3′;Zeb1正义链:5′-GAACAGGACTCAAGACATCTCAGTGT-3′,反义链:5′-GGTTTATTCTCTATCTTTTGCCGTATCT-3′。单克隆抗体Dach1、E-cadherin、β-catenin、Zeb1购自Santa Cruz公司,GAPDH抗体以及HRP标记的羊抗兔、羊抗鼠二抗及羊抗鼠荧光二抗购于武汉博士德公司。
1.2 细胞培养和转染
细胞培养于含10%新生小牛血清的DMEM培养液中。转染前6孔板中每孔接种约5×105个细胞,培养24 h后进行转染,按照转染试剂盒使用说明,实验分组为:对照组(SW480con组,转染siRNA对照序列),低表达Dach1组(SW480si-Dach1组,转染si-Dach1),低表达Dach1同时高表达miR-200c组(SW480si-Dach1+miR-200c组,转染si-Dach1+miR-200c mimics)。
1.3 Real-time PCR检测miR-200b、miR-200c水平
使用Trizol提取各细胞中的RNA(步骤按照产品说明书),运用逆转录试剂盒使RNA逆转录为cDNA。应用ABI 7300 Real-time PCR检测仪检测miR-200b、miR-200c、Zeb1和GAPDH的mRNA水平。
1.4 Western blot法检测蛋白水平
参照Santa Cruz公司所提供的蛋白提取方法,应用蛋白裂解缓冲液(150 mmol/L氯化钠,1%NP-40,1%去氧胆酸钠,0.1%十二烷基磺酸钠,1 mmol/L正钒酸钠,1 mmol/L苯甲磺酰氟)裂解细胞得到总蛋白。以BSA(胎牛血清)作为标准品,根据蛋白定量试剂盒(Bio Rad公司产品)绘制蛋白定量标准曲线,分光光度计测570 nm波长处吸光度值,计算提取液的蛋白浓度。取50 μg蛋白进行SDS-PAGE电泳。然后电转膜到硝酸纤维素膜上。转膜成功后,含5%脱脂奶粉的TBST封闭液封闭30 min。加一抗(1∶1000)在4 ℃下过夜。TBST洗涤3次,二抗(1∶5000)振荡孵育2 h。采用化学发光法(ECL)显影。
1.5 Transwell检测低表达Dach1对SW480细胞迁移和侵袭的影响
按照上述实验分组后,将转染48 h后已长满的SW480细胞消化后制成悬液,迁移实验用含10%新生小牛血清的DMEM培养液调整细胞浓度为5×105个/mL,侵袭实验将细胞浓度调节为5×106个/mL。每孔加入200 μL细胞悬液,37℃培养箱培养48 h后取上室,以棉签拭去小室滤膜上的细胞。PBS洗后将小室置于95%乙醇中固定10 min,PBS洗5 min×2次,苏木精染色2~5 min,水洗后倒置于普通显微镜下随机计数13个视野(×100)内的膜下细胞数。将4℃的DMEM培养液加入液化的基质胶中,使基质胶浓度稀释至200 μg/mL,将200 μL枪头的尖端剪掉,取稀释液200 μL均匀涂抹在8 μm孔径的Transwell聚碳酸酯膜上,重复上述实验以检测细胞的侵袭能力。
1.6 细胞划痕实验检测低表达Dach1对SW480细胞迁移能力的影响
按照上述实验分组后,转染48 h后将细胞制成悬液,以每孔4×105的密度接种到6孔培养板上,37℃温箱中培养过夜后取出细胞,用200μL枪头,使枪头垂直于孔表面作垂直于背面标记线的垂线做划痕。吸净旧的培养液,用无菌PBS洗细胞面3次,去除划下的细胞,加入无血清培养液,置入37℃温箱中培养,分别取划痕后0、24 h培养板于镜下观察划痕弥合情况并拍照,并测量标记位点的划痕宽度。
1.7 统计学分析
2 结果
2.1 Dach1低表达增强SW480细胞侵袭和迁移能力
在SW480细胞中通过脂质体转染si-Dach1后,蛋白水平验证SW480si-Dach1组较SW480con组Dach1低表达。
Transwell小室实验检测细胞侵袭和迁移能力,得到如图1所示结果。Transwell迁移实验中,SW480si-Dach1组迁移的细胞数多于SW480con组[(102.33±1.53)vs. (44.67±2.52)],差异有统计学意义(P<0.01)。Transwell侵袭实验中,培养48 h后SW480si-Dach1组穿透基质胶的细胞数多于SW480con组[(45.33±2.52)vs. (17.33±0.58)],差异有统计学意义(P<0.01)。划痕实验结果如图2所示,24 h时SW480si-Dach1组细胞迁移的平均距离大于SW480con组[(111.67±5.86)μmvs. (42.21±3.11)μm],差异有统计学意义(P<0.01)。
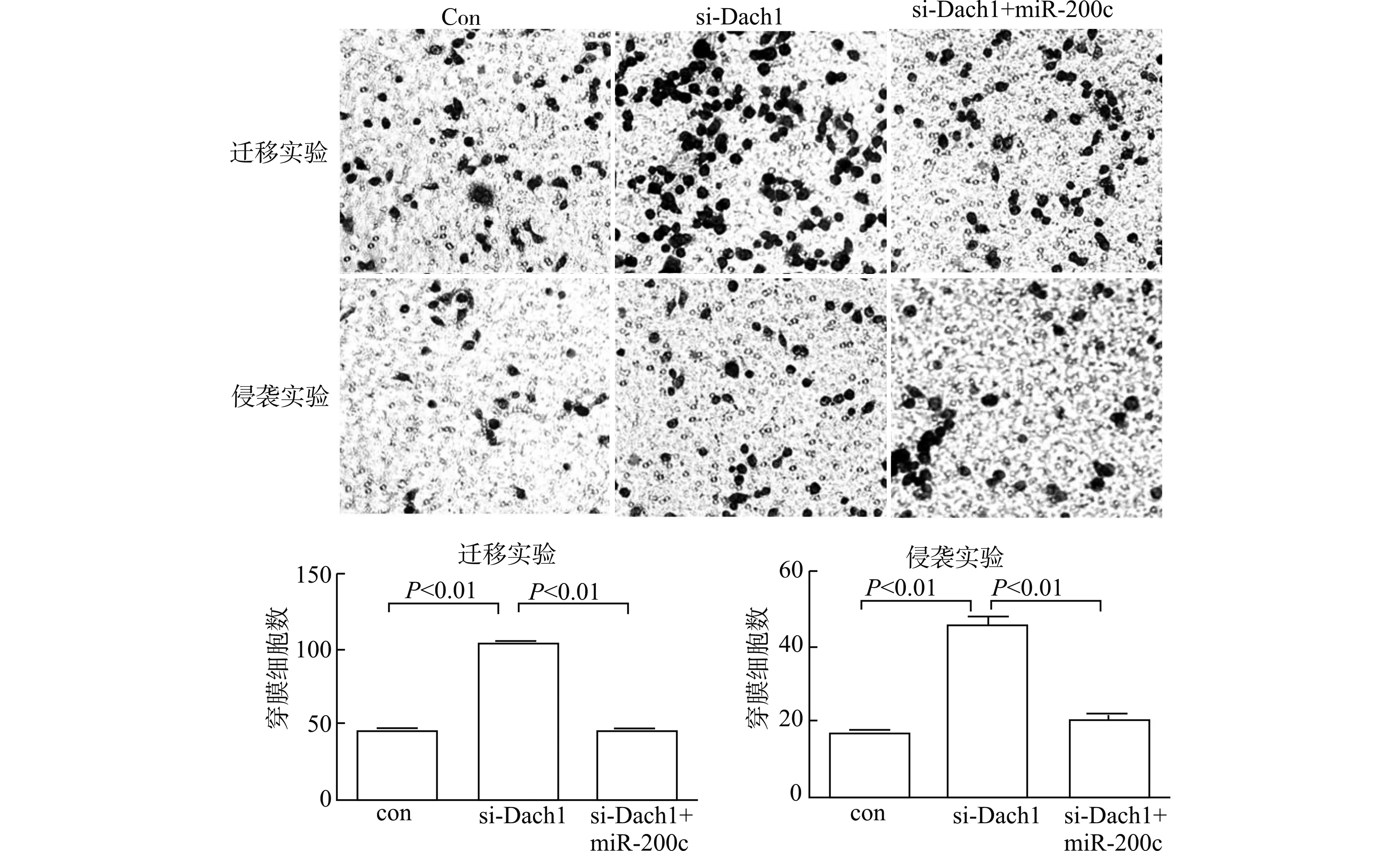
图1 SW480con 组、SW480si-Dach1组与SW480si-Dach1+miR-200c组细胞迁移和侵袭实验穿膜细胞数的比较Fig.1 Comparison of the number of penetrating cells in cell migration and invasion experiments in SW480con group,SW480si-Dach1 group and SW480si-Dach1+miR-200c group

图2 SW480con 组、SW480si-Dach1组与SW480si-Dach1+miR-200c组细胞迁移距离的比较Fig.2 Comparison of migration distances of SW480 cells in SW480con,SW480si-Dach1 and SW480si-Dach1+miR-200c groups in wound healing assay
2.2 Dach1低表达促进SW480细胞上皮间质转化
上皮间质转化(epithelial-mesenchymal transition,EMT)是肿瘤细胞侵袭转移能力发生改变的重要机制。我们检测EMT通路相关蛋白表达量后发现,SW480si-Dach1组中上皮相关指标E-cadherin表达较SW480con组降低,而间质相关指标β-catenin表达较SW480con组升高。SW480si-Dach1组中Zeb1表达较SW480con组增高(图3),这与Real-time PCR的检测结果相一致(图4)。Zeb1为E-cadherin、β-catenin等蛋白的上游,由上述结果我们可以知道,低表达Dach1后,Zeb1表达升高,由此引起E-cadherin表达下降,β-catenin表达升高,SW480细胞发生EMT。
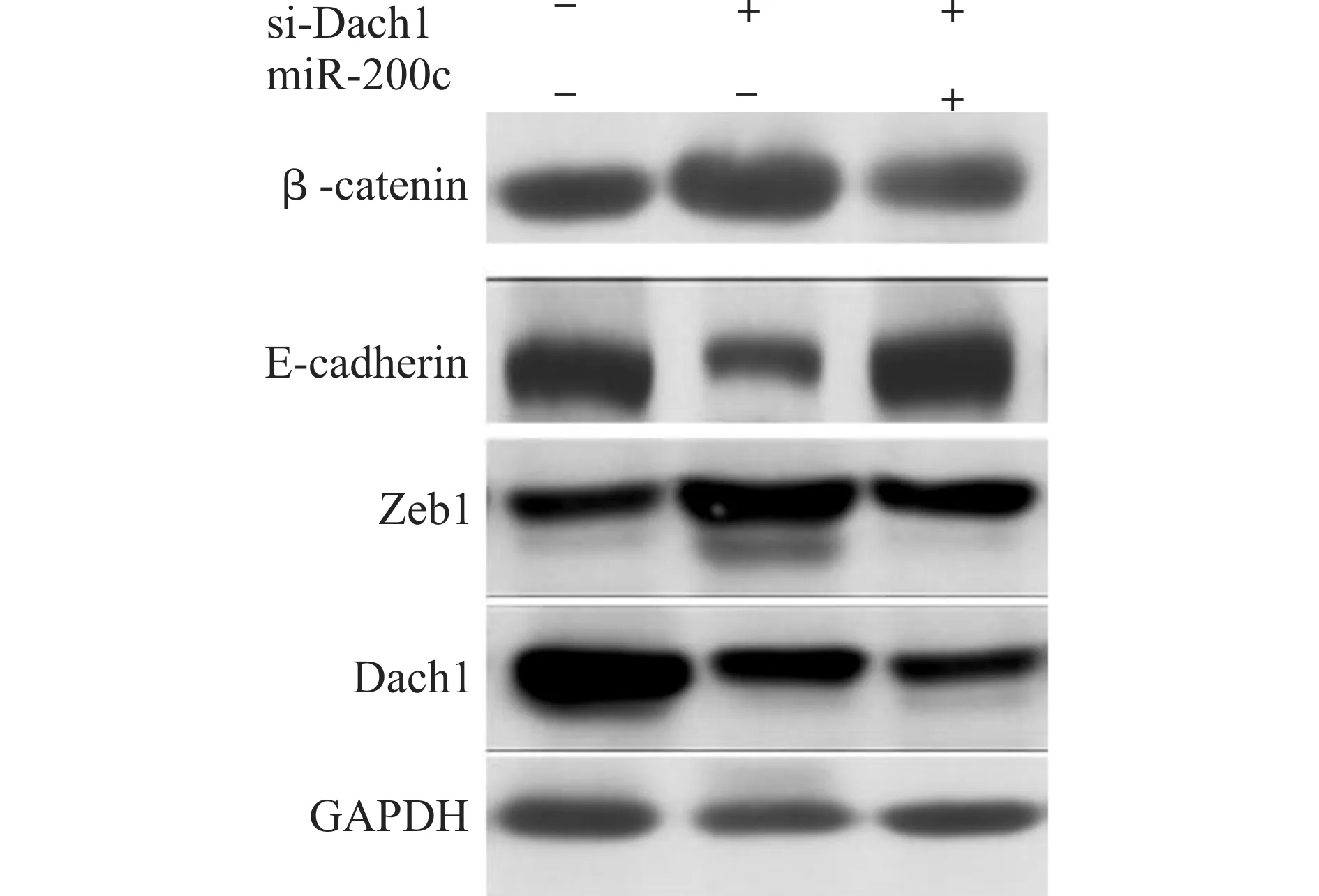
图3 SW480con 组、SW480si-Dach1组与SW480si-Dach1+miR-200c组上皮间质转化细胞信号通路变化Fig.3 Signaling pathway changes of epithelial-mesenchymal transition in SW480con,SW480si-Dach1 and SW480si-Dach1+miR-200c groups
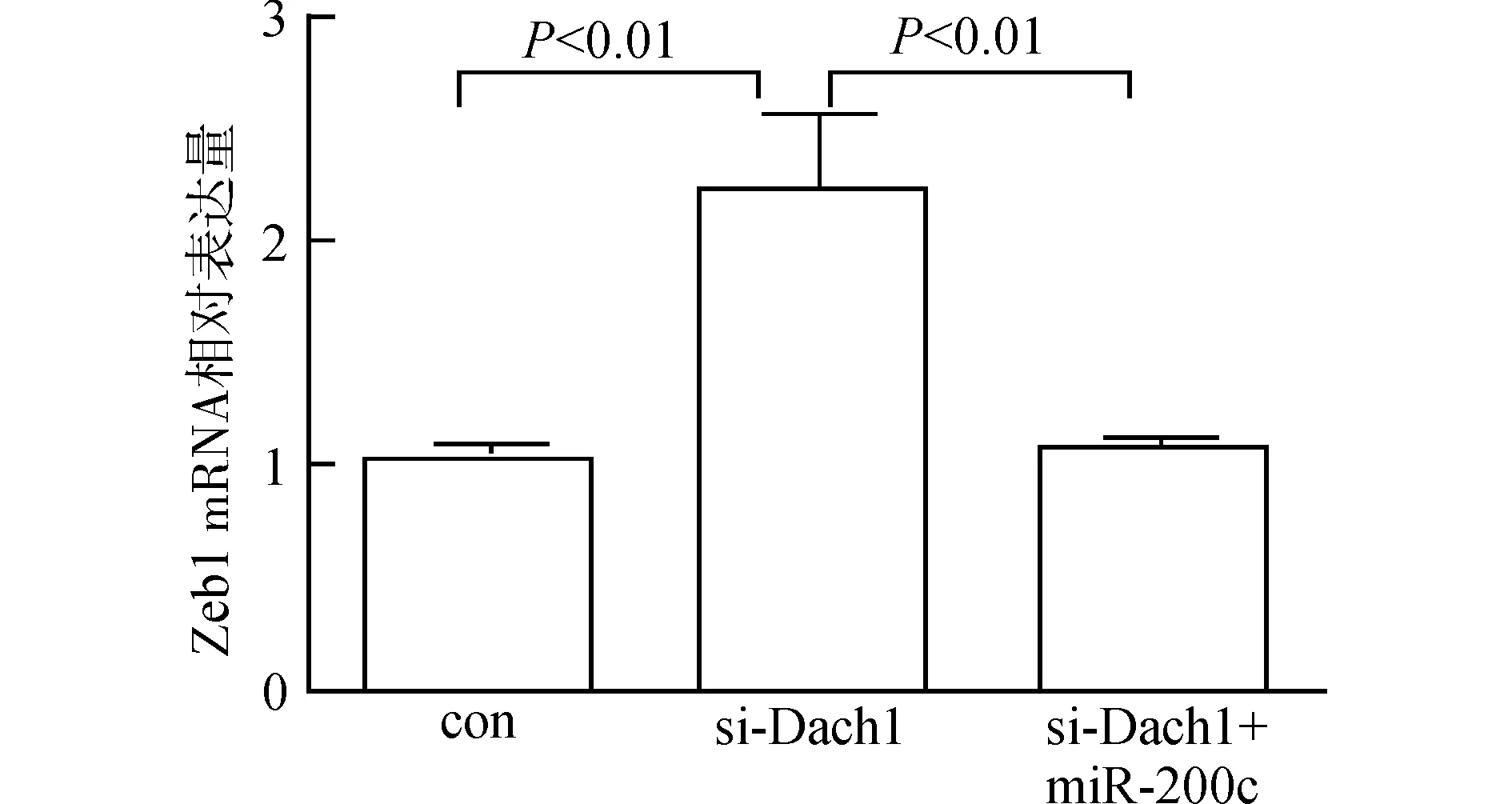
图4 SW480con 组、SW480si-Dach1组与SW480si-Dach1+miR-200c组细胞Zeb1 mRNA表达水平变化Fig.4 Zeb1 mRNA expression in SW480con,SW480si-Dach1 and SW480si-Dach1+miR-200cgroups
2.3 Dach1低表达通过抑制miR-200c表达促进SW480细胞EMT、侵袭和迁移
已有报道miR-200家族功能与肿瘤细胞的EMT相关,且miR-200与Zeb1互相抑制,因此我们猜测低表达Dach1是否通过miR-200来影响Zeb1从而影响SW480细胞的EMT。
首先,我们在SW480细胞中转染si-Dach1并在蛋白水平验证Dach1低表达后,检测miR-200家族的miR-200b和miR-200c的表达变化,miR-200b在Dach1低表达前后分别为(1.000±0.168)和(0.875±0.203),差异无统计学意义。miR-200c在Dach1低表达前后分别为(1.000±0.219)和(0.531±0.213)(P<0.05),见图5,因此我们挑选miR-200c作为我们的研究对象。

图5 低表达Dach1后miR-200家族的表达变化Fig.5 Relative expression changes of microRNA-200 family after down-regulation of Dach1
接下来,我们在低表达Dach1的同时高表达miR-200c后,SW480si-Dach1+miR-200c组中的Zeb1在mRNA水平的表达较SW480si-Dach1组下降,差异具有统计学意义(P<0.01),这与文献报道的miR-200c对Zeb1的抑制作用相一致。
在Transwell迁移实验中,SW480si-Dach1+miR-200c组细胞少于SW480si-Dach1组(44.67±2.52)vs. (102.33±1.53),差异具有统计学意义(P<0.01)。在侵袭实验中48 h后SW480si-Dach1+miR-200c组细胞亦少于SW480si-Dach1组(20.33±1.53)vs. (45.33±2.52),差异亦具有统计学意义(P<0.01)。细胞划痕实验中24 h后SW480si-Dach1+miR-200c组迁移的距离小于SW480con组[(44.21±3.11)μmvs. (111.67±5.86)μm],差异亦具有统计学意义(P<0.01)(图1、2)。
在EMT通路的蛋白表达中,SW480Si-Dach1+miR-200c组较SW480Si-Dach1组E-cadherin表达升高,β-catenin及Zeb1表达降低(图3)。
从上述结果我们可以看出,当Dach1低表达时,miR-200c表达下降,此时Zeb1表达升高,从而引起EMT相关通路激活(E-cadherin表达下降,β-catenin表达升高),SW480细胞的侵袭和迁移能力增强。而当我们在低表达Dach1的同时高表达miR-200c时,Zeb1的表达下降,SW480细胞的侵袭和迁移能力下降,提示Dach1低表达时SW480细胞的侵袭和迁移能力增强可能通过低表达miR-200c来实现。
3 讨论
Dach1全称Dachshund家族转录因子1,该基因在物种之间保持着高度的保守性,并在乳腺癌、前列腺癌、肺癌等肿瘤的发生发展中起到重要作用。已经知道Dach1能够通过TGF-β抑制多种实体瘤的侵袭转移[1-3],但Dach1对于结直肠癌侵袭转移的影响尚未见报道。Dach1在结直肠癌中由于启动子的甲基化致低表达,且高表达Dach1可以抑制结直肠癌细胞系的增殖,提示Dach1潜在的抑癌基因性质[4]。结合上述我们思考:Dach1的表达是否影响结肠癌的侵袭转移呢?为了研究这个问题,我们选择Dach1表达较高的SW480细胞,我们应用si-RNA技术下调SW480细胞系的Dach1表达,验证Dach1蛋白水平低表达后进行Transwell、细胞划痕等实验,检测了SW480中si-Dach1组相较于SW480对照组在迁移、侵袭等生物学功能的变化,初步说明了低表达Dach1的促肿瘤转移作用。
我们发现低表达Dach1可以通过影响EMT促进SW480的侵袭转移。EMT是一种高度保守的过程,其主要的过程为具有极性的上皮细胞如结肠癌细胞系,失去贴壁紧密连接,成为迁移能力较强的间充质细胞[5]。由于结肠癌细胞系在转化为间充质细胞后,失去了上皮的特征,更易于脱落并沿着血管转移到远处,因此EMT广泛参与了结肠癌的侵袭、转移过程[6]。由上述可知在EMT发生中伴随着上皮标记分子,如:细胞黏附分子(E-钙黏蛋白即E-cadherin)等表达的降低,以及间充质标记分子,如:Vimentin、N-钙黏蛋白、波形蛋白、β-catenin表达的升高。在我们的实验中观察到了上述的分子表达变化:低表达Dach1后,SW480细胞中的E-cadherin表达降低,而β-catenin等间质特性的标记分子表达升高,说明此时SW480细胞慢慢失去上皮的特征,增加了间质细胞的特性,此时的细胞更容易从原位脱落,转移到其他部位。与上述分子表达变化相呼应的是,在低表达Dach1后,SW480细胞的侵袭和迁移能力的增强。低表达Dach1后,Zeb1的蛋白表达增加,同时也发现Zeb1在转录水平上表达增加,说明低表达Dach1可以在转录水平高表达Zeb1后激活下游的EMT通路进而影响SW480细胞的侵袭转移能力。
我们还发现低表达Dach1通过抑制miR-200c的表达促进Zeb1的转录表达。MicroRNAs(miRNAs)是目前研究基因转录后调控的热点之一,它可以结合到转录因子的3′端非编码区影响基因的表达[7]。已经证实miR-200家族在结直肠癌的侵袭转移过程中扮演重要角色[8],且已知miR-200与Zeb1之间相互抑制[9],我们发现低表达Dach1后miR-200c表达降低,Zeb1转录升高,高表达miR-200c后,SW480细胞的侵袭和迁移能力变化被逆转。因此我们认为低表达Dach1后,通过低表达miR-200c从而在转录水平高表达Zeb1,进而激活EMT通路促进SW480细胞的侵袭和迁移能力。
