骨桥蛋白介导PI3K/AKT通路促进非小细胞肺癌顺铂耐药*
2020-05-21裴登科
刘 迪, 龙 谦,罗 猛,胡 剑,陈 臣,裴登科
贵州省人民医院胸外科,贵阳 550002
肺癌是来源于支气管黏膜上皮的恶性肿瘤,非小细胞肺癌(non-small cell lung cancer,NSCLC),约占全部肺癌的85%左右[1]。尽管近年来NSCLC的靶向治疗取得了很大进步,但以含铂药物为主的联合化疗仍然是中晚期NSCLC的主要治疗手段[2],然而,由于肿瘤对铂类等化疗药物产生耐药,NSCLC患者5年总生存率不超过15%[3]。
NSCLC对顺铂耐药的具体机制目前尚不十分明确。PI3K/AKT信号转导通路的过度激活,可导致NSCLC对抗化疗药物诱导的肿瘤细胞凋亡作用,从而产生耐药效应[4]。此外,ERK1/2信号通路可介导抗凋亡作用[5],从而在以铂类药物为主的肿瘤耐药发展过程中起到至关重要的作用[6]。顺铂造成的DNA损伤,可通过核苷酸切除修复途径来修复,而切除修复交叉互补基因1(excision repair cross-complementation group 1,ERCC1)是DNA修复系统中的一个关键基因,Newton等[7]研究发现ERCC1的过表达与NSCLC的顺铂耐药有关。
骨桥蛋白(osteopontin,OPN)是一种分泌型磷酸化糖蛋白,OPN通过激活肿瘤细胞中PI3K/AKT和ERK1/2信号通路上调NF-κB的表达,促进肿瘤细胞侵袭、生长与转移[8]。目前尚不清楚OPN是否参与调控NSCLC对顺铂的耐药。此外,ERCC1的表达受内源和外源的多种因素影响,OPN是否能通过上调ERCC1基因的表达而增加NSCLC对顺铂的耐药值得进一步研究。本研究选用NSCLC A549细胞系,构建OPN过表达细胞及OPN沉默细胞,探讨OPN是否能够通过PI3K/AKT及ERK1/2信号通路促进NSCLC对顺铂的耐药。
1 材料与方法
1.1 实验材料
NSCLC A549细胞购于中科院上海细胞库,胎牛血清购自美国BI公司,Opti-MEM培养液购自美国Gibco公司,U0126购自美国MedChem Express公司,LY294002购自美国Sigma公司,循环测序试剂盒购自美国ABI公司,逆转录试剂盒购自美国Thermo-Fisher公司,20× Lumiglo Reagen购自美国CST公司,Lipofectamine 3000转染试剂盒购自美国Invitrogen公司,Ultrapure RNA超纯RNA提取试剂盒、HiFiScript cDNA第一链合成试剂盒、UltraSYBR Mixture购自北京康为世纪公司,Annexin Ⅴ-FITC/PI凋亡检测试剂盒购自杭州联科生物公司,细胞裂解液购自北京普利莱公司,PMSF购自北京Solarbio公司,PVDF膜购自美国Sigma公司。Western blot用抗体如下:ERK1/ERK2(ab17942)、PI3K(ab191606)、ERCC1(ab129267)购自美国ABCAM公司,GAPDH(TA-08)、羊抗鼠IgG(ZB-2305)、羊抗兔IgG(ZB-2301)购自北京中杉金桥公司。实验主要仪器为ABI PCR仪,BD FACS流式细胞仪,BIO-RAD超高灵敏度化学发光成像系统。
1.2 实验方法
1.2.1 OPN过表达载体及沉默载体的构建 根据OPN基因的CDS序列,引入酶切位点(XhoⅠ/BamHⅠ),合成基因片段(克隆至plvxpuro载体上),构建OPN过表达载体OPN-plvxpuro。设计shRNA靶序列:正义链引入BamHⅠ酶切位点,反义链引入EcoRⅠ酶切位点,退火形成双链,与载体pGreenpuro连接,构建慢病毒重组载体shOPN-pGreenpuro,转化感受态细胞,对质粒给予电泳验证。使用Opti-MEM培养液稀释Lipofectamine 3000试剂,充分混匀,制备得到脂质体-DNA混合物及脂质体-shRNA混合物,室温避光孵育1 h后将脂质体-DNA复合物、脂质体-shRNA混合物体积加入对应孔的细胞中,在37℃,5%CO2培养箱孵育细胞2 d后取出检测。MTT法,RT-PCR法鉴定OPN过表达载体和沉默载体的构建,详细步骤见参考文献[9-10]。
1.2.2 流式细胞术检测细胞凋亡 6孔培养板每孔接种1×105个细胞,待培养板中细胞贴壁后加入相关药物处理,37℃,5%CO2培养箱孵育细胞2 d,收集细胞以Annexin Ⅴ-FITC和PI双染,室温避光孵育10 min后上机检测。
1.2.3 荧光实时定量PCR法检测ERCC1基因表达 6孔培养板每孔接种1×105个细胞,待培养板中细胞贴壁后加入相关药物处理,37℃,5%CO2培养箱孵育细胞2 d,弃去培养板中细胞培养液,使用RNA提取试剂盒提取细胞总RNA,计算RNA纯度及浓度,使用1%琼脂糖凝胶电泳鉴定RNA质量,通过逆转录HiFiScript cDNA第一链合成试剂盒合成cDNA,设计引物序列:ERCC1上游引物:5′-CCGCCAGCAAGGAAGAA-3′,ERCC1下游引物:5′-TGCCGAGGGCTCACAAT-3′。GAPDH上游引物:5′-GAAGGTCGGAGTCAACGGAT-3′,GAPDH下游引物:5′-CCTGGAAGATGGTGATGGG-3′。设置PCR程序进行反应,每个样品均设置3个复孔,使用2-ΔΔCt方法分析mRNA表达的相对差异。
1.2.4 Western blot法检测 6孔板中细胞经相关药物处理后,吸弃6孔板中的细胞培养液,提取细胞蛋白,BCA法测定蛋白裂解液浓度,配置SDS-PAGE凝胶,上样后电泳,待样品中溴酚蓝带接近胶的底部时,停止电泳。将蛋白转移至PVDF膜,洗膜后加一抗,4℃缓摇孵育过夜,洗膜后加二抗,室温缓摇1 h孵育,洗膜后加显影液检测,对于目的条带的分子量及吸光度值采用图像处理软件分析。
1.3 统计学分析
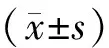
2 结果
2.1 OPN过表达载体和沉默载体的构建
在过夜培养的sh-OPN-pGreenpuro平板上挑取单菌落进行菌落PCR验证,将扩增后的PCR产物进行1%琼脂糖凝胶电泳检测条带,结果表明,有阳性点,且条带与理论值相符,证明载体构建正确,详见图1A、1B。进一步采用RT-PCR法检测OPN基因mRNA表达水平,结果表明,与对照组相比,过表达组的OPN基因表达明显升高,详见图1C;沉默组的OPN基因表达明显下降,详见图1D;差异具有统计学意义(均P<0.05)。

A:过表达载体的验证,M:DL2000 marker,1:pGreenpuro,2:sh-OPN-pGreenpuro;B:过表达载体的验证,M:DL15000 marker,1:OPN-plvxpuro质粒,2:OPN-plvxpuro/XhoⅠ/BamHⅠ;C:OPN过表达载体OPN mRNA表达水平;D:OPN沉默载体OPN mRNA表达水平图1 OPN过表达载体和沉默载体的验证Fig.1 Validation of plasmids with OPN overexpression and OPN silent plasmids
2.2 OPN对NSCLC细胞顺铂耐药的影响
根据半数抑制率实验,采用顺铂(DDP)4 μmol/L、U0126 5 μmol/L、LY294002 5 μmol/L处理随后实验,详见图2A。DDP处理细胞,设对照组(Control+DDP),OPN沉默组(shRNA-OPN+DDP),OPN过表达组(OPN+DDP),MTT法检测细胞增殖活性,结果表明,与对照组相比,OPN过表达组的细胞增殖活性明显升高,OPN沉默组的细胞增殖活性明显下降,差异具有统计学意义(均P<0.05),详见图2B。进一步采用流式细胞术检测细胞凋亡,结果表明与对照组相比,OPN沉默组的细胞凋亡率未见明显变化,OPN过表达组的细胞凋亡率明显下降,差异具有统计学意义(P<0.05),详见图2C、2D。
2.3 PI3K及ERK1/2通路介导OPN促进NSCLC顺铂耐药
采用Western blot法检测PI3K及ERK通路是否介导OPN从而促进NSCLC顺铂耐药,设对照组(Control),OPN沉默组(shRNA-OPN),OPN过表达组(OPN),对照+顺铂组(Control+DDP),OPN沉默+顺铂组(shRNA-OPN+DDP),OPN过表达+顺铂组(OPN+DDP),顺铂处理浓度为4 μmol/L。结果表明,与对照组相比,OPN过表达组的PI3K蛋白表达水平升高,OPN沉默组的PI3K蛋白表达水平下降,顺铂处理后OPN过表达组的PI3K、p-PI3K蛋白表达水平较OPN沉默组高,而ERK1/2、p-ERK1/2蛋白表达水平,各组无明显差异,详见图3A、3B。
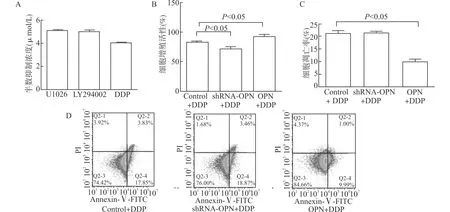
A:不同药物半数抑制浓度;B:OPN沉默载体组及过表达载体组细胞增殖活性;C:OPN沉默载体组及过表达载体组细胞凋亡率;D:流式细胞术检测OPN沉默载体组及过表达载体组细胞凋亡情况图2 OPN与NSCLC细胞在顺铂作用下的增殖和凋亡Fig.2 Correlation between OPN and cisplatin resistance in NSCLC

1:Control,2:shRNA-OPN,3:OPN,4:Control+DDP,5:shRNA-OPN+DDP,6:OPN+DDP;A:各组细胞PI3K和ERK1/2蛋白的表达水平;B:各组细胞PI3K和ERK1/2蛋白磷酸化水平图3 各组细胞PI3K和ERK1/2蛋白表达及其磷酸化的水平Fig.3 Expression levels of PI3K and ERK1/2 proteins and their phosphorylation in each group
2.4 阻断ERK1/2信号通路对OPN调节NSCLC顺铂耐药的影响
使用ERK1/2信号通路抑制剂U0126,阻断OPN下游ERK1/2信号通路,顺铂处理浓度为4 μmol/L,设对照+顺铂组(Control+DDP),OPN沉默+顺铂组(shRNA-OPN+DDP),OPN过表达+顺铂组(OPN+DDP),设U0126+顺铂组(U0126+DDP),OPN沉默+U0126 +顺铂组(shRNA-OPN+U0126+DDP),OPN过表达+U0126+顺铂组(OPN+U0126+DDP),对照+U0126+顺铂组(Control+U0126+DPP)进行对比研究,U0126处理浓度为5 μmol/L。通过MTT及流式细胞术观察肿瘤细胞的增殖及凋亡,结果表明各组间细胞增殖活性的差异不具有统计学意义(P>0.05),详见图4A,各组细胞凋亡率比较,差异不具有统计学意义(P>0.05),详见图4B、4C。
2.5 阻断PI3K通路对OPN调节NSCLC顺铂耐药的影响
使用PI3K通路LY294002,阻断OPN下游PI3K通路,顺铂处理浓度为4 μmol/L,设对照+顺铂组(Control+DDP),对照+LY294002+顺铂组(Control+LY294002+DDP),OPN过表达+顺铂组(OPN+DDP),OPN过表达+LY294002+顺铂组(OPN+LY294002+DDP)、OPN沉默+顺铂组(shRNA-OPN+DDP),OPN沉默+LY294002 +顺铂组(shRNA-OPN+LY294002+DDP),进行对比研究,LY294002处理浓度为5 μmol/L。通过MTT及流式细胞术观察肿瘤细胞的增殖及凋亡,结果表明:细胞增殖活性比较,对照+LY294002+顺铂组增殖率较对照+顺铂组低,差异具有统计学意义(P<0.05),其余各组与对照+顺铂组比较,差异不具有统计学意义(均P>0.05),详见图5A。细胞凋亡率比较,对照+LY294002+顺铂组、shRNA-OPN+LY294002+顺铂组凋亡率较对照+顺铂组高,差异具有统计学意义(均P<0.05),其余各组与对照+顺铂组比较,差异不具有统计学意义(均P>0.05),详见图5B、5C。
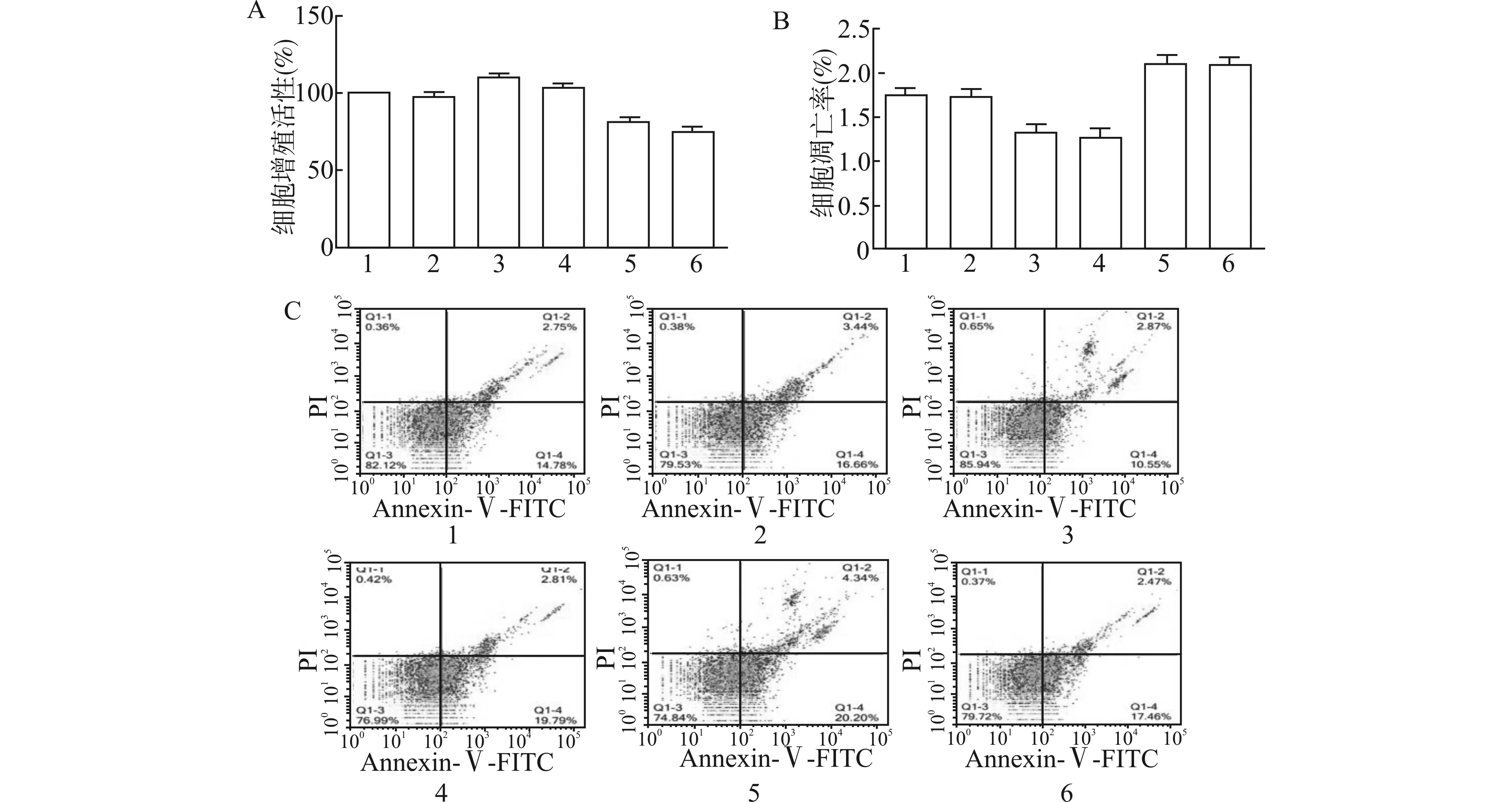
1:Control+DDP,2:shRNA-OPN+DDP,3:OPN+DDP,4:U0126+DDP,5:shRNA-OPN+U0126+DDP,6:OPN+U0126+DDP;A:U0126处理后各组细胞增殖活性;B:U0126处理后各组细胞凋亡率;C:流式细胞术检测U0126处理后各组细胞凋亡情况图4 U0126对OPN调节NSCLC顺铂耐药的影响Fig.4 Effects of U0126 on OPN regulation of cisplatin resistance in NSCLC
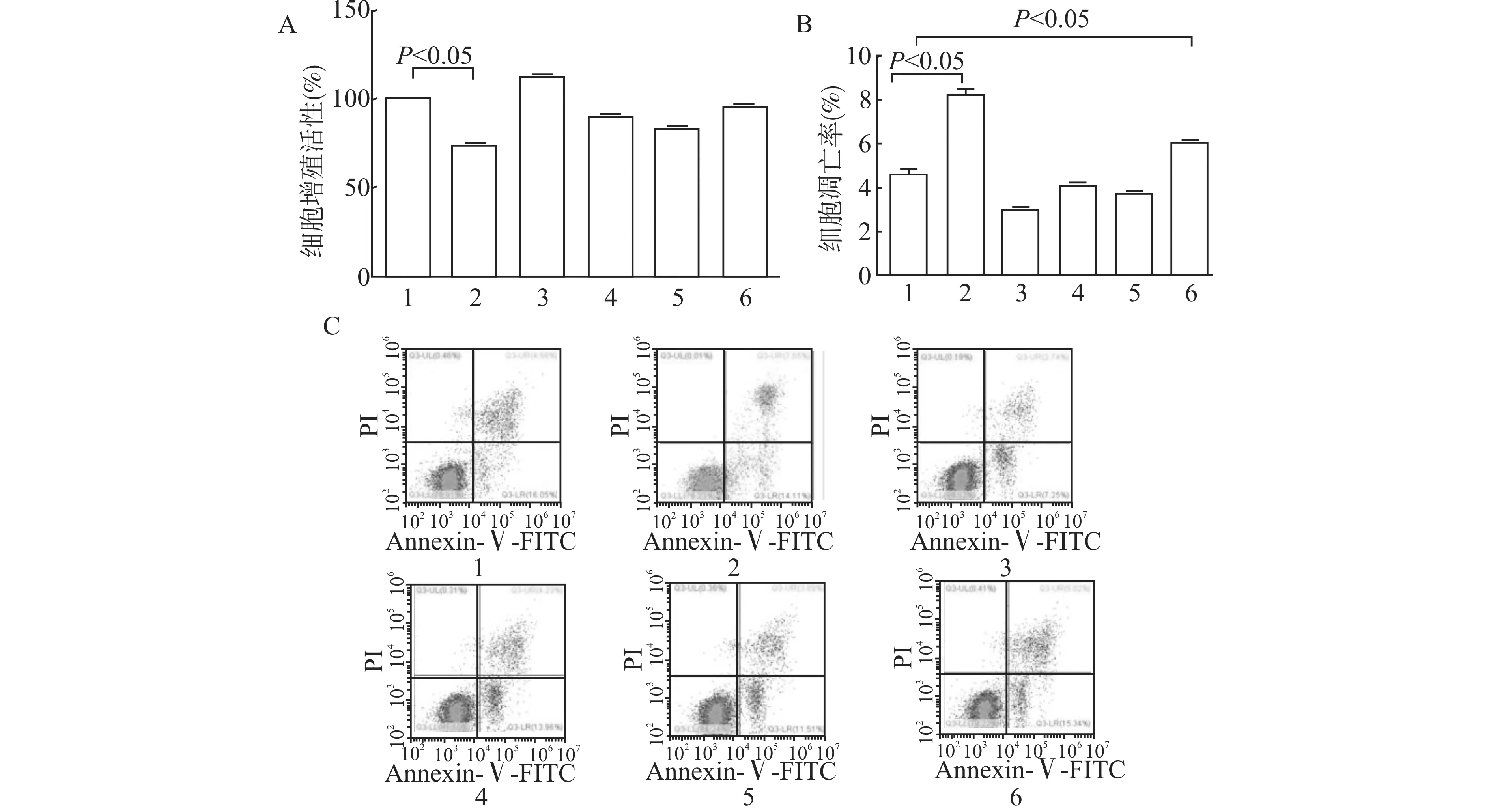
1:Control+DDP,2:Control+LY294002+DDP,3:OPN+DDP,4:OPN+LY294002+DDP,5:shRNA-OPN+DDP,6:shRNA-OPN+LY294002+DDP;A:LY294002处理后各组细胞增殖活性;B:LY294002处理后各组细胞凋亡率;C:流式细胞术检测LY294002处理后各组细胞凋亡情况图5 LY294002对OPN调节NSCLC顺铂耐药的影响Fig.5 Effects of LY294002 on OPN regulation of cisplatin resistance in NSCLC
2.6 ERCC1表达在OPN促进NSCLC顺铂耐药中的作用
采用RT-PCR法检测ERCC1基因,设对照组(Control),OPN沉默组(shRNA-OPN),OPN过表达组(OPN),对照+顺铂组(Control+DDP),OPN沉默+顺铂组(shRNA-OPN+DDP),OPN过表达+顺铂组(OPN+DDP),顺铂处理浓度为4 μmol/L。结果表明,OPN过表达组的ERCC1 mRNA表达明显升高,OPN沉默组的细胞ERCC1 mRNA表达明显下降,与对照+顺铂组相比,OPN过表达+顺铂组的ERCC1 mRNA表达明显升高,OPN沉默+顺铂组的细胞ERCC1 mRNA表达明显下降,差异具有统计学意义(均P<0.05),详见图6A。进一步采用Western blot法检测ERCC1蛋白表达水平,结果表明,与对照组相比,OPN过表达组的ERCC1蛋白表达水平升高,OPN沉默组的ERCC1蛋白表达水平下降,顺铂处理后,OPN过表达组的ERCC1蛋白表达水平较OPN沉默组高,详见图6B。

1:Control;2:shRNA-OPN;3:OPN;4:Control+DDP;5:shRNA-OPN+DDP;6:OPN+DDP;A:各组细胞ERCC1 mRNA表达水平;B:各组细胞ERCC1蛋白表达水平图6 ERCC1 mRNA与蛋白在各组细胞的表达水平Fig.6 Expression levels of ERCC1 mRNA and ERCC1 protein in each group
3 讨论
顺铂是一种细胞周期非特异性的细胞毒性药物,目前临床治疗NSCLC仍采用以顺铂为主的联合化疗方案。然而NSCLC在使用顺铂治疗时,易产生耐药,肿瘤发生复发或转移,导致患者预后较差。OPN是具有分泌功能的磷酸化糖蛋白,与多种肿瘤的发生、发展密切相关[11]。OPN在肺癌、肝癌、乳腺癌等多种肿瘤中表达水平增高。研究表明,OPN表达水平增高能够促进NSCLC的侵袭、迁移和生长,OPN能够通过Bcl-2蛋白增强NSCLC的抗凋亡作用[12],此外通过抗体抑制OPN的表达水平能够促进顺铂诱导的肿瘤细胞凋亡[13]。本项研究中,我们采用脂质体质粒转染,构建OPN过表达细胞及OPN沉默细胞,研究OPN与NSCLC顺铂耐药的相关性,结果发现顺铂处理后,OPN过表达组细胞增殖活性明显升高,细胞凋亡率明显下降,提示OPN过表达增强了NSCLC细胞在顺铂处理时的抗凋亡活性及增殖能力,降低NSCLC细胞对顺铂的敏感性。
尽管高表达OPN能够促进肺癌细胞对顺铂的耐药,但是其信号通路及分子机制尚不明确。研究发现,ανβ3整合素、CD44受体能够与OPN相互作用,进而激活多条信号通路,发挥影响肿瘤细胞间粘附、抑制细胞凋亡、重构肿瘤细胞骨架等作用[14],而PI3K/AKT、ERK1/2信号通路为OPN下游整合素的主要下游通路。此外肺癌患者EGFR、AKT1、KRAS等基因发生突变进一步导致患者PI3K/AKT信号通路过度活化,致使肺癌细胞对顺铂产生耐药,PI3K/AKT信号通路过度活化的早期NSCLC患者通常预后较差[15]。而ERK1/2通路异常激活能够调节肺癌细胞的增殖及迁移,进一步激活其下游NF-κB信号通路,抑制肿瘤细胞凋亡促进肺癌细胞对铂类药物的耐药[16]。因此我们推测,OPN有可能通过激活PI3K/Akt、ERK1/2信号通路引起NSCLC对顺铂的耐药。我们发现转染OPN表达载体组的PI3K蛋白表达水平升高,OPN沉默组的PI3K蛋白表达水平下降,顺铂处理后OPN过表达组的PI3K蛋白表达水平较OPN沉默组高,而ERK1/2蛋白表达水平各组细胞无显著差异。为此我们使用ERK1/2信号通路抑制剂U0126,阻断OPN下游ERK1/2信号通路,结果发现,阻断ERK1/2信号通路后,各组细胞的增殖及凋亡与对照组比较无显著差异,提示OPN促进NSCLC对顺铂耐药的机制与ERK1/2通路无明显相关。我们进一步使用PI3K通路抑制剂LY294002,结果发现对照+LY294002+顺铂组增殖率较对照组低,对照+LY294002+顺铂组、shRNA-OPN+LY294002+DDP组凋亡率较对照组高,差异具有统计学意义(均P<0.05),提示OPN促进NSCLC对顺铂耐药的机制可能与激活PI3K信号通路相关。
多个研究显示核苷酸切除修复途径中的ERCC1与肺癌铂类耐药密切相关[17],而ERCC1的表达受内源和外源的多种因素影响。研究发现,PI3K通路的活化可受Klotho蛋白影响导致NSCLC细胞对顺铂的耐药,而Klotho蛋白能够调控ERCC1表达水平,介导DNA修复,影响NSCLC细胞对顺铂的耐药[18]。因此我们推测,OPN过表达促进NSCLC顺铂耐药的机制中,除了激活PI3K/AKT信号通路外,是否同时存在上调ERCC1基因的表达。为此,我们采用PCR及Western blot分别检测ERCC1的表达情况。结果发现OPN沉默导致NSCLC细胞中的ERCC1 mRNA和蛋白表达下降,顺铂处理后OPN过表达可上调ERCC1 mRNA和蛋白表达水平,提示OPN可能通过上调ERCC1促进NSCLC对顺铂的耐药。
综上所述,我们的研究证明了OPN过表达可促进NSCLC对顺铂耐药,OPN在促进NSCLC顺铂耐药过程中扮演着关键角色;明确OPN促进NSCLC对顺铂耐药的机制可能是通过激活PI3K/AKT信号通路引起,与ERK1/2通路活化无明显相关;揭示了OPN过表达可上调ERCC1,OPN可能通过PI3K/AKT信号通路上调ERCC1促进NSCLC对顺铂的耐药。但是OPN通过激活PI3K/AKT信号通路上调ERCC1表达的具体机制,有待于我们进一步的研究。
