沉默IL-17基因对裸鼠人上皮性卵巢癌移植瘤生长的抑制作用*
2020-05-21吴美琴徐元萍宋晓婕李玉霞刘智慧王燕萍廖红玉
吴美琴,徐元萍,王 勇,宋晓婕,李玉霞,刘智慧,王燕萍,廖红玉
1华中科技大学同济医学院附属武汉儿童医院(武汉市妇幼保健院)妇科,武汉 4300152武汉市第三医院(武汉大学附属同仁医院)妇产科,武汉 4300743武汉大学动物实验中心,武汉 4300724湖北省中医院妇产科,湖北省中医药研究院,武汉 430074
卵巢恶性肿瘤是女性常见的生殖系统恶性肿瘤[1]。卵巢癌在妇科生殖系统恶性肿瘤中的发病率为第3位,却是死亡率最高的妇科肿瘤,严重威胁着妇女的健康与生命[2-3]。上皮性卵巢癌是最常见的卵巢恶性肿瘤,由于缺乏有效的筛查手段以及发病初期症状、体征较为隐蔽,大多数患者在确诊时已属晚期。如何改善卵巢癌患者的预后、延长其生存期是临床医生面临的困难之一,因此,寻找新的治疗靶点是我们亟须解决的问题。本研究以人上皮性卵巢癌细胞株SKOV3细胞建立裸鼠皮下移植瘤模型,敲降IL-17后,观察其对肿瘤生长的影响。
1 材料与方法
1.1 裸鼠成瘤及分组
选取对数生长期的人上皮性卵巢癌细胞株SKOV3细胞(来自中科院细胞库),用0.1%的胰酶进行消化至镜下细胞呈椭圆形至球形时,用含10%新生牛血清的RPMI 1640培养液终止消化,吸管轻轻吹打至细胞完全悬浮后收集至离心管,以1000 r/min离心5 min,弃上清,加入RPMI 1640培养液,稀释至2.5×107个/mL,吹打混匀配置成单细胞悬液。取单细胞混悬液,于无菌环境中在裸鼠背侧近右前肢处进行皮下接种,每只裸鼠接种0.2 mL(约5×106个/只),每日观察瘤体生长情况,于接种后5 d,测量移植瘤直径,选取直径在3~5 mm的入组,随机将其分成空白组和IL-17-siRNA组,每组6只。采用瘤体皮下注射300 μL慢病毒(购于上海吉玛基因公司)的方式干预IL-17表达,浓度滴度为1×109TU/mL。每隔2天测量肿瘤体积,计算公式为:V=0.5236×L(长度)×W2(宽度)。3周后颈椎脱臼法处死裸鼠,分离肿瘤组织,测量肿瘤的体积。取每组均数制作肿瘤生长曲线。实验末,统一以10%水合氯醛3 mL/kg麻醉小鼠,剥离皮下肿瘤结节称瘤重。
1.2 ELISA法测量血清炎症因子的含量
取血清,以ELISA试剂盒检测其炎症因子的含量。根据试剂盒(购于南京建成生物科技有限公司)的说明书稀释标准品。绘制标准曲线。在酶标包被板上依次加入50 μL的梯度浓度标准品。设置空白孔和样品孔,其中空白孔不加样品和抗体。在待测样品孔中加入血清样品40 μL,然后再加10 μL生物素标记的抗体。每孔加入酶标试剂50 μL,但空白孔不加。封板后于37℃中静置30 min。将浓缩洗涤液用双蒸水稀释后备用。揭掉封板膜,倒掉液体,甩干后加满洗涤液,静置30 s后倒掉,重复洗涤5次,拍干。每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻振荡混匀,37℃避光显色10 min后,迅速向每孔滴加50 μL终止液,用酶标仪读取吸光度值。
1.3 TUNEL法检测细胞凋亡水平
常规石蜡切片脱蜡,梯度乙醇水化,PBS冲洗2 min×3次,采用蛋白酶K(0.02 g/L,10 mmol/L Tris/HCl,pH=7.4~8.0),21 ℃~37 ℃消化15~30 min,PBS冲洗2 min×3次,加入25 μL TUNEL反应液,37℃作用60 min,PBS冲洗3 min×3次,滴加25~50 μL的AP抗体,37℃作用30 min,PBS冲洗3 min×3次,滴加BCIP/NBT,37℃作用20 min,PBS冲洗3 min×3次,复染,封片,烘干。镜下观察切片,细胞核染成深棕色的细胞为凋亡细胞。
1.4 Western blot检测相关蛋白含量
按照蛋白提取试剂盒(购于南京建成生物科技有限公司)说明书,提取肿瘤组织总蛋白检测IL-17、信号转导因子和转录激活因子3(signal transducer and activator of transcription 3,STAT3)的表达水平。BCA蛋白定量后上样,60 V,10% SDS-PAGE凝胶电泳1.5 h,在转膜缓冲液中转膜30 min,TBS封闭液封闭1 h,5%脱脂奶粉25℃封闭1 h,4℃下分别孵育IL-17、STAT3、p-STAT3一抗过夜,TBST洗10 min×3次,25℃孵育二抗1 h,TBST洗10 min×3次,曝光显影,采用BIO-RAD Image Lab软件对条带进行灰度值分析。
1.5 免疫组化染色
将玻片置于500 mL的柠檬酸钠缓冲液(0.01 mol/L,pH6.0)中,加热至持续沸腾10 min,冷却后,PBS洗涤5 min,重复洗涤3次。H2O2灭活内源性过氧化氢酶15 min,PBS冲洗。加0.2%的Triton X-100通透10 min。滴加10%山羊血清封闭,室温孵育20 min。然后滴加抗血管内皮生长因子A(vascular endothelial growth factor A,VEGF-A)抗体和CD34抗体(稀释比例1∶500),阴性对照滴加PBS,4℃过夜。PBS洗涤3次,每次5 min。滴加VEGF和CD34二抗试剂,室温孵育20 min,PBS洗涤3次,每次5 min。滴加DAB显色,在镜下观察,当显色发生变化时,立即将玻片浸泡在去离子水中。下一步进行核染。在苏木精溶液中染色4 min,在去离子水中浸泡1 min。室温晾干载玻片,浸泡二甲苯透明,中性树胶封片。晾干后在显微镜下观察并拍照。
1.6 统计学方法
应用SPSS 22.0统计软件对数据进行统计分析,两组均数比较采用t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 IL-17-siRNA抑制肿瘤的生长
测量所得肿瘤的体积见图1。两组的肿瘤体积均随时间逐渐增加。和对照组比较,IL-17-siRNA组的肿瘤体积在第5、7、9、11天时无显著性变化(均P>0.05),在第17、19、21天时,IL-17-siRNA组的肿瘤体积均显著小于对照组(均P<0.05),见图1A。在第21天时,两组的肿瘤体积见图1B。
2.2 IL-17-siRNA促进细胞凋亡
通过TUNEL实验检测并分析两组肿瘤组织中细胞的凋亡率,见图2。和对照组比较,IL-17-siRNA组肿瘤组织中棕黄色明显增加,细胞凋亡率显著升高(P<0.05)。
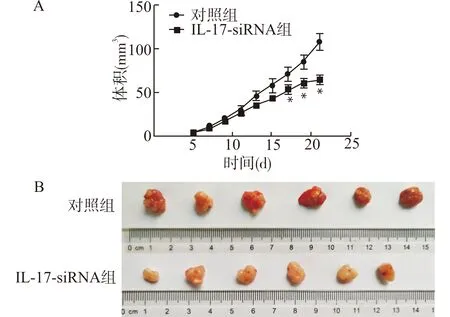
与对照组比较,*P<0.05图1 两组肿瘤体积及其增长曲线Fig.1 Tumor volume and its growth curve in two groups

A:对照组;B:IL-17-siRNA组;与对照组比较,*P<0.05图2 TUNEL法检测IL-17对肿瘤细胞凋亡的影响Fig.2 Effect of IL-17 on apoptosis of tumor cells
2.3 IL-17-siRNA对炎症因子的影响
通过ELISA检测血清中IL-4、IL-17、IFN-γ和TNF-α等炎症因子的水平,见图3。和对照组比较,IL-17-siRNA组的血清IL-4、IL-17、IFN-γ、TNF-α水平显著降低,均P<0.05。
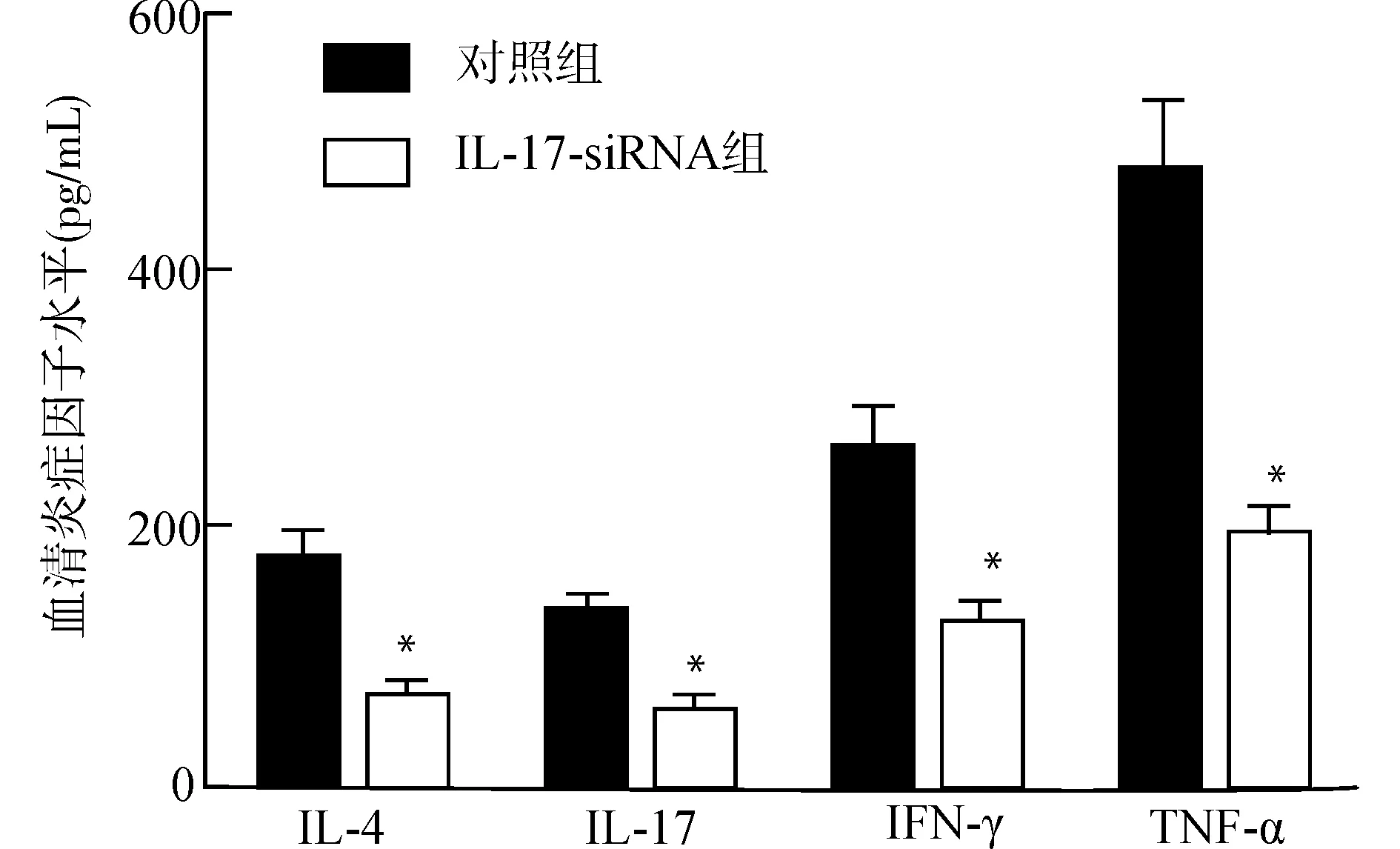
与对照组比较,*P<0.05图3 各组血清中炎症因子的表达变化Fig.3 Expression of inflammatory factors in serum of the two groups
2.4 IL-17-siRNA相关蛋白表达水平的影响
Western blot检测肿瘤组织中p-JAK、JAK、p-STAT3、STAT3、Caspase-3、Caspase-8、Caspase-9蛋白的表达,见图4。和对照组比较,IL-17-siRNA组肿瘤组织中p-JAK和p-STAT3蛋白表达显著降低,Caspase-3,Caspase-8,Caspase-9的表达显著升高(均P<0.05);JAK和STAT3的蛋白表达无显著差异(均P>0.05)。

A:Western blot印迹图;B:Western blot统计结果;与对照组比较,*P<0.05图4 IL-17对肿瘤组织中p-JAK、JAK、p-STAT3、STAT3、Caspase-3、Caspase-8、Caspase-9蛋白表达的影响Fig.4 Effect of IL-17 on protein p-JAK,JAK,p-STAT3,STAT3,Caspase-3,Caspase-8,Caspase-9 in tumor tissues
2.5 IL-17-siRNA抑制VEGF-A和CD34的表达
通过免疫组化实验检测两组肿瘤组织中VEGF-A和CD34的表达情况,见图5。和对照组比较,IL-17-siRNA组肿瘤组织中棕黄色信号减弱,VEGF-A和CD34表达降低。

图5 IL-17对肿瘤组织中VEGF-A和CD34表达的影响Fig.5 Effect of IL-17 on VEGF-A and CD34 expression in tumor tissues
3 讨论
IL-17是一种具有多种生物学效应的细胞因子,由T细胞、中性粒细胞等产生,其靶细胞分布广泛。IL-17具有强大的招募中性粒细胞、促进多种细胞释放炎性因子、促进细胞增殖的作用,被认为参与了机体多种炎症疾病、自身免疫性疾病和肿瘤等的发生。目前多项临床研究显示,在胃癌、卵巢癌、结肠癌等患者外周血或肿瘤组织中可检测出IL-17表达水平增高,且其水平与肿瘤的恶性程度相关,但其促进肿瘤发生的机制尚未明确[4-6]。近年来随着基础研究的深入,发现IL-17可能通过促进肿瘤血管生成及干扰肿瘤免疫等机制发挥了促瘤作用。Rafa等[7]研究证明,在卵巢癌组织中,IL-17 mRNA的表达显著高于正常组织,且IL-17阳性表达的肿瘤组织微血管密度显著高于IL-17阴性表达的正常组织;在接种了含IL-17 cDNA的重组肿瘤细胞后,发现该肿瘤组织的血管密度明显增多[8-10];而肿瘤血管密度增高是血管生成活化的显著表现,从而证明IL-17是通过促进血管生成作用达到促瘤作用的;且可能是通过促进VEGF的高表达来促进血管的生成[11]。本研究通过移植人上皮性卵巢癌细胞株SKOV3细胞建立裸鼠皮下成瘤模型,敲降IL-17后,结果显示IL-17-siRNA组的肿瘤体积增加速率显著低于对照组,且细胞凋亡率显著升高,Caspase-3、Caspase-8、Caspase-9的表达显著升高,这表明敲降IL-17对裸鼠卵巢肿瘤的生长产生一定的抑制作用。
肿瘤侵袭和转移是卵巢癌患者死亡的重要原因,血管新生为侵袭和转移提供基础,在此过程中起关键作用,VEGF是目前已知最强的血管通透剂,它能导致癌性腹水或肿瘤间质水肿,而且导致血浆、纤维等蛋白向血管外渗出,导致细胞外基质的改变,从而促进血管的形成,是与恶性肿瘤侵袭、转移和腹水形成相关的重要生长因子之一[4,12]。IL-17-siRNA组的VEGF-A表达显著降低,提示敲降IL-17基因可能抑制VEGF-A的表达,抑制血管的生成,减缓卵巢癌细胞的迁移。
STAT3是STATs家族成员之一,定位于细胞质内,被激活后转入核内和相应DNA结合,引发靶基因转录,调控信号转导和转录。STAT3信号转导通路被激活后,作用于特异的DNA片段,调控靶基因的转录[13-15]。STAT3信号转导通路参与了细胞的增殖、分化和凋亡的过程。STAT3的异常活化可引起细胞异常分化和增殖,并抑制细胞凋亡,导致恶性转化,促进肿瘤的形成。且有研究发现,STAT3在许多恶性肿瘤中呈现高表达,如胰腺癌、乳腺癌、卵巢癌、肺癌、前列腺癌等常见肿瘤[16-20]。STAT3参与肿瘤的侵袭和转移,也参与调控肿瘤细胞的凋亡和增殖活动。和对照组比较,IL-17-siRNA组的p-STAT3表达显著降低,提示敲降IL-17基因可能抑制STAT3的磷酸化,减缓卵巢癌的发展。
综上,敲降IL-17基因可能通过抑制IL-17-STAT3信号通路,抑制VEGF-A的表达,抑制卵巢肿瘤细胞的迁移,促进肿瘤组织细胞凋亡,减缓卵巢癌的发展。
