重组UK114蛋白对宰后牛肉calpain-1及肌原纤维蛋白特性的影响
2020-04-28宋彩丽尹淑琴张晓红常泓
宋彩丽,尹淑琴,张晓红,常泓
(1.山西农业大学 生命科学学院,山西 太谷 030801;2.山西农业大学 期刊社,山西 太谷 030801)
肉的色泽、风味、嫩度、持水性是决定肉品质的主要因素,决定了对视觉的吸引力和感官的可接受性。肌原纤维蛋白作为肉类蛋白的主要成分之一,决定着肉类的风味特性和营养价值等,其在加工、贮藏过程中会受到多种因素的影响发生降解,导致功能特性受到影响,进而影响肉类品质[1, 2],大多数的研究报道认为钙蛋白酶是引起宰后肌原纤维蛋白降解的最主要内源酶[3]。
钙蛋白酶系统,尤其calpain-1在调节一些肌纤维蛋白水解过程中起着重要的作用,激活的calpain-1主要通过影响蛋白质水解的速率和程度,对肉的嫩度和持水性起主要作用[4]。
马逸峤等[5]研究表明,calpain-1参与了羊肉成熟过程中肌原纤维蛋白的降解,尤其是对肌原纤维蛋白中肌间线蛋白(Desmin)和肌钙蛋白-T(Troponin-T)有降解作用。Pomponio等[6]研究表明,在猪肉宰后成熟过程中,calpain-1活性与肌原纤维蛋白的水解程度成正比。UK114蛋白作为calpain-1的激活蛋白,是由137个氨基酸组成的小蛋白质[7],具有多种生物学功能,它参与肿瘤生长的抑制、介导细胞溶解、细胞生长的调节及嘌呤代谢、伴侣等过程[8~11]。DeMartino和Blumenthal等人[12]的研究表明UK114作为calpain-1的激活剂时,calpain首先与Ca2+结合,然后UK114再作用于这个复合体。
肌原纤维蛋白的降解是影响宰后贮藏过程中肉类品质变化的主要因素,据报道对肌原纤维蛋白凝胶影响因素研究较多,如pH、离子强度、添加剂、氧化等方面[13, 14],在不同物种中也有一些钙蛋白酶对肌原纤维蛋白降解的研究,但在牛肉中添加钙蛋白酶激活剂对肌原纤维蛋白降解的研究报道较少。本研究主要通过添加钙蛋白酶激活剂UK114蛋白,研究UK114蛋白对calpain-1和calpastatin介导的肉样肌原纤维蛋白特性的影响,以促进宰后肌肉calpain-1的激活,为牛肉宰后成熟提供一种新方法。
1 材料与方法
1.1 试验材料
由文水保贤庄彤辉肉牛养殖场提供体格良好、体重均匀、生理成熟指标相似的3~4岁的西门塔尔公肉牛,屠宰后30 min内,迅速取背最长肌在4 ℃条件下切割成0.3 cm左右的均匀薄片,锡箔纸包装置于液氮中运回实验室,-80 ℃贮藏备用。
1.2 主要试剂与仪器
标准蛋白Marker:美国 Thermo 公司,calpain-1、calpastatin:德国Merck公司,过硫酸铵(APS)和N, N′-甲叉双丙烯酰胺(Bis):美国 Sigma 公司,考马斯亮蓝R-250、丙烯酰胺(Acr)、溴酚蓝、牛血清蛋白、乙二胺四乙酸(EDTA)、Tris和TEMED等均购自北京索莱宝科技有限公司。
Centrifuge cm型小型高速离心机,Eppenddorf;PY-80 A/S型脱色摇床,江苏省津塘市荣华仪器有限公司;Testo 206型pH计,得图(亚洲)有限公司;HB120-S金属浴,北京大龙兴创实验仪器有限公司;DYCZ-24DN型垂直电泳槽,北京六一生物科技有限公司;Alpha mini型凝胶成像仪,美国阿尔发。
1.3 试验方法
1.3.1 试验设计
取牛背最长肌,切成0.3 cm左右的均匀薄片置于自封袋,作为对照组,试验组1、2、3、4分别注射12 μg的 6 g·L-1calpain-1、UK114+calpainv1、calpastatin、UK114+calpastatin,每组重复注射3个样品,在4 ℃冰箱分别孵育1,12,24,48,72,120,168 h,然后测定各项理化指标。
1.3.2 肌肉中calpain-1活性测定
参考Melody等[15]测定calpain-1活性的方法并作调整。称取2 g肉样(去除结缔组织),加6 mL预冷提取液(pH 8.3、100 mmol·L-1Tris-HCl,0.05% β-巯基乙醇,10 mmol·L-1EDTA),4 ℃高速匀浆充分,8 000×g冷冻离心30 min,取上清,考马斯亮蓝法测定钙蛋白酶浓度。加入等体积的样品处理液(pH 6.8、150 mmol·L-1Tris-HCl,0.02%溴酚蓝,0.75% β-巯基乙醇,20%甘油),置于-80 ℃冰箱备用。采用4%的浓缩胶和12.5%的分离胶,蛋白上样量为30 μg。电泳完成后,将胶置于孵育液(pH 7.5、50 mmol·L-1Tris-HCl,5 mmol·L-1氯化钙,0.1%MCE)反应1 h,期间更换3次反应液,继续孵育16 h,考马斯亮蓝染色,过夜脱色。
1.3.3 提取肌原纤维蛋白
参考Doerscher等[16]的方法并略作修改。将剔除脂肪和结缔组织的肉样绞碎,加入4倍体积的提取缓冲液(100 mmol·L-1Tris,10 mmol·L-1EDTA,pH 8.3),匀浆捣碎,1000×g离心20 min。沉淀用4倍体积的标准盐溶液(standard salt solution,SSS)(100 mmol·L-1KCl,20 mmol·L-1K2HPO4/KH2PO4,pH 7.0,2 mmol·L-1MgCl2,1 mmol·L-1EGTA)悬浮冲洗3次,1 500×g离心10 min。沉淀溶解于100 mmol·L-1KCl和5 mmol·L-1Tris溶液,置于-20 ℃冰箱备用。
1.3.4 肌原纤维小片化指数(MFI)的测定
参考Culler等[17]的方法并稍作改进。取4 g肉样,加入40 mL预冷MFI缓冲液(100 mmol·L-1KCl, 8.8 mmol·L-1KH2PO4, 1 mmol·L-1EGTA, 11.2 mmol·L-1K2HPO4,1 mmol·L-1MgCl2, 1 mmol·L-1NaN3),冰浴20 s,2 ℃ 4 000 r·min-1匀浆离心15 min,去上清,加5×体积的MFI缓冲液悬浮沉淀,过滤去除结缔组织和脂肪,用双缩脲法测定蛋白浓度,将蛋白浓度调节到0.5 g·L-1,分光光度计测定540 nm波长吸光度值A540,通过下列公式计算MFI值:
MFI=A540×200
1.3.5 肌原纤维蛋白表面疏水性的测定
参考Chelh等[18]的方法并稍加改进。在试验组1、2、3、4孵育的肌原纤维蛋白中加入pH 6.0、20 mmol·L-1的磷酸盐溶液,稀释蛋白浓度为5 g·L-1。取2 mL蛋白溶液加入1 g·L-1的溴酚蓝溶液400 μL,室温搅拌10 min,4 000×g离心15 min,上清液稀释10倍后,595 nm处测吸光度A。空白为不加样的磷酸盐缓冲液。计算公式为:
溴酚蓝(μg)=200(A空白-A样品)/A空白
1.3.6 肌原纤维蛋白溶解度的测定
参考李文采等[19]的方法并稍加调整。在试验组1、2、3、4的肌原纤维蛋白中加600 mol·L-1磷酸缓冲溶液,将蛋白浓度稀释为6 g·L-1,震荡混匀。4 ℃冰箱放置10 h,7300×g离心15 min,取上清,测定蛋白溶液浓度,通过下列公式计算:
蛋白溶解度(%)=(上清蛋白浓度/原液蛋白浓度)×100%
1.3.7 SDS-PAGE凝胶电泳
参考Laemmil[20]的方法并稍作调整。浓缩胶和分离胶的浓度分别为4%和12%,取约5 g肌原纤维蛋白,12 000 r·min-1离心10 min,取上清20 μL上样,进行SDS-PAGE凝胶电泳。将电压设定70 V,电泳30 min后调到120 V恒压,电泳结束后考马斯亮蓝R-250染色,过夜脱色后在成像仪进行观察。
1.4 统计分析
采用SPSS软件对结果进行单因素方差分析(one-way ANOVA),使用最小显著差异法(LSD)进行显著性分析(P<0.05);使用Excel软件绘制图表,结果表示为:“平均值±标准误”。
2 结果与分析
2.1 宰后calpain-1活性变化
采用活性电泳法测定各组孵育不同时间calpain-1活性,如图1可见:随着孵育时间的延长,对照组条带的亮度逐渐减弱,72 h后无明显条带,说明calpain-1活性几乎消失;添加calpain-1组条带减弱变缓,120 h后无清晰条带;UK114+calpain-1组1 h时就有微弱条带,说明UK114可促进calpain-1的激活;与对照组相比,添加calpastatin组72 h时条带最清晰,表明加入calpastatin抑制了calpain-1的活性,使其在1~48 h内活性很低。与calpastatin处理组相比,UK114+calpastatin组在48 h有明显条带,calpain-1活性上升。

图1 宰后孵育不同时间calpain-1活性变化
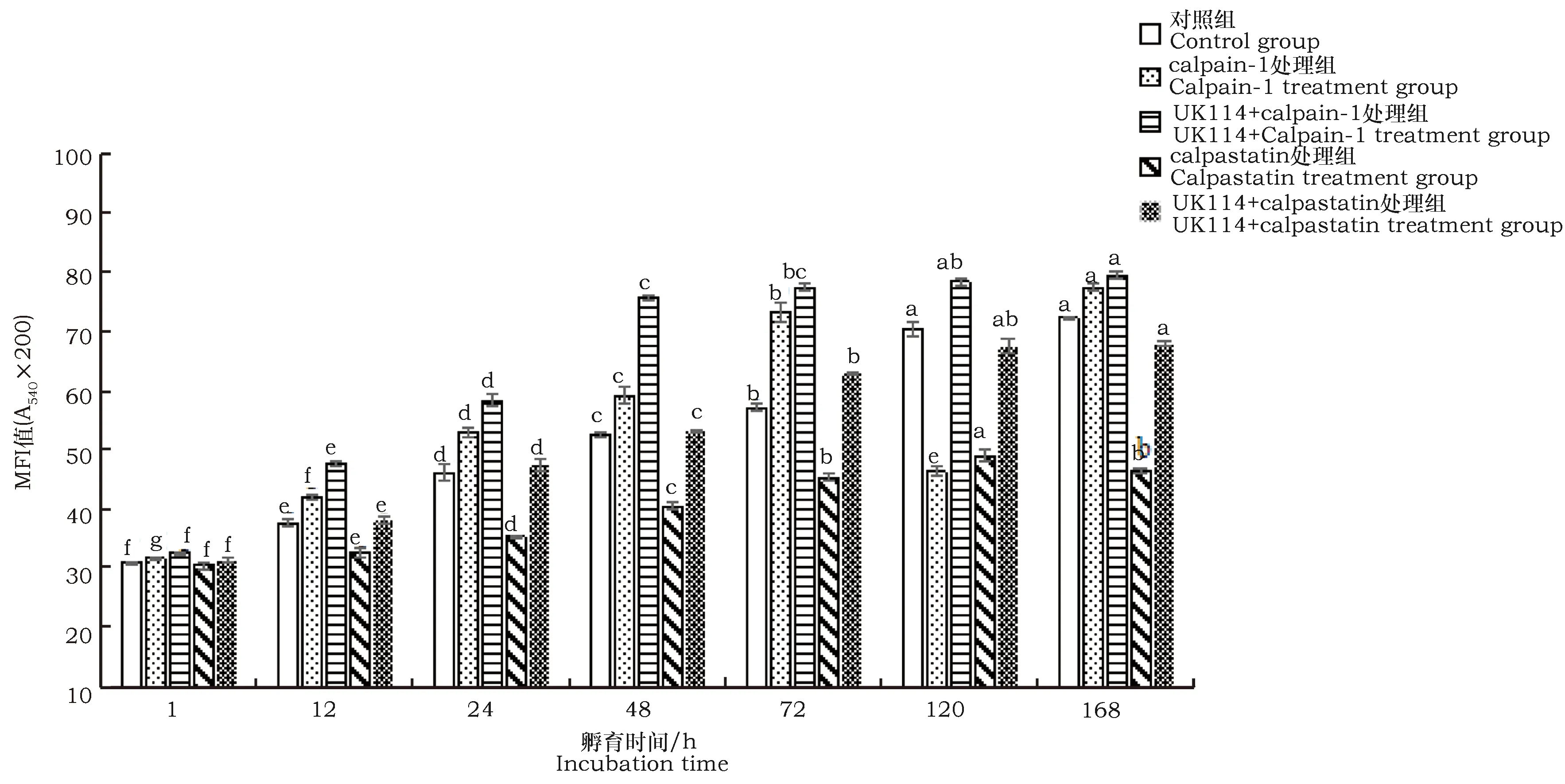
2.2 宰后肌原纤维小片化指数的变化
肌原纤维小片化指数(MFI)的大小可以反应肌原纤维蛋白结构完整性的破坏程度[21],MFI越大,肌原纤维蛋白被降解程度越大。由图2可见:宰后孵育过程中,肌原纤维小片化指数总体呈上升趋势。对照组和calpain-1处理组随着孵育时间延长,上升差异显著(P<0.05);对照组在72~120 h时显著上升(P<0.05),UK114+calpain-1组12~72 h显著上升(P<0.05),之后上升缓慢,说明UK114可以促进calpain-1对肌原纤维蛋白的降解,MFI增大;calpastatin处理组与其他组相比整体上升缓慢,但也存在显著差异(P<0.05)。UK114+calpastatin组48~72 h MFI指数增加最多,从53.07升到62.91,上升最快期与对照组相比有所提前,说明UK114可以降低calpastatin对肌原纤维蛋白降解的抑制作用。
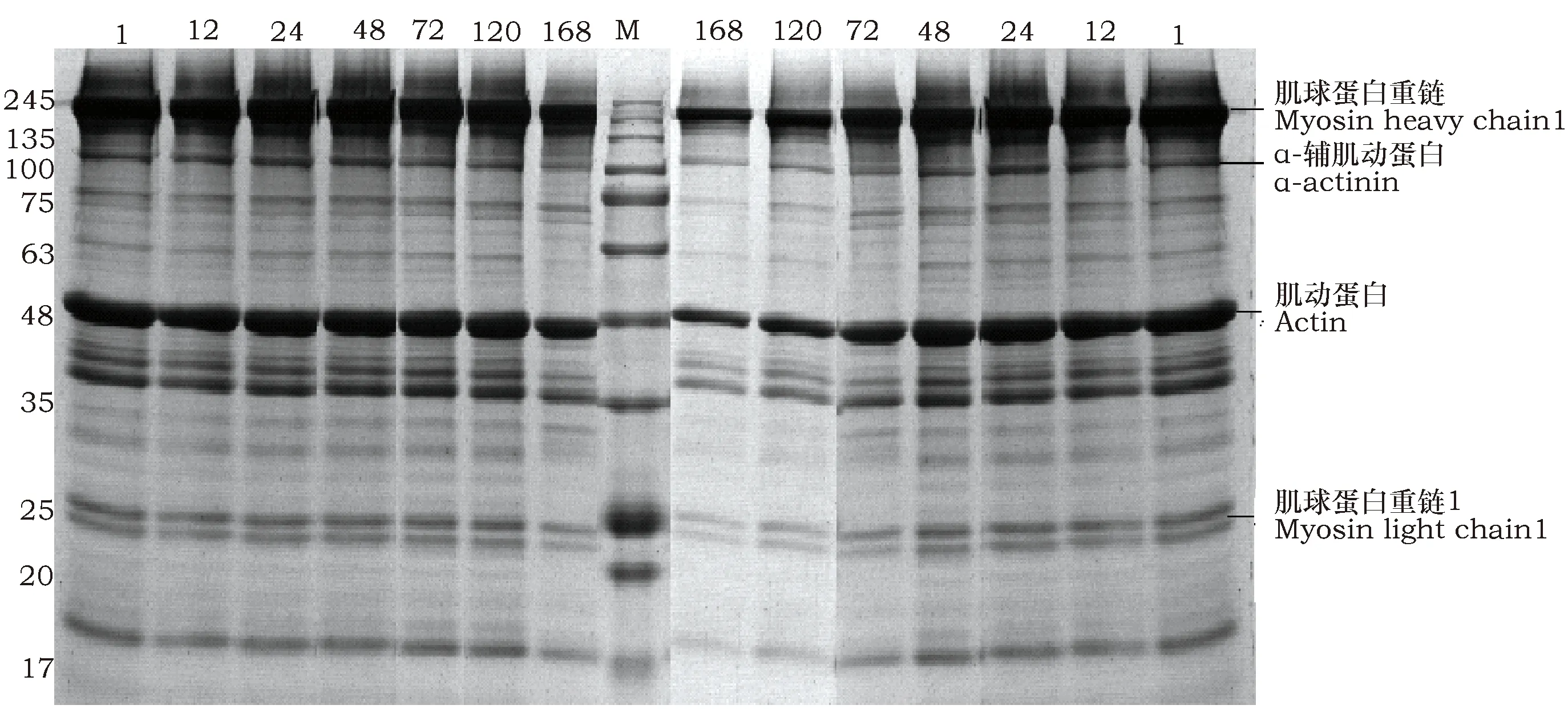
2.3 宰后孵育不同时间肌肉中肌原纤维蛋白的SDS-PAGE分析
采用SDS-PAGE凝胶电泳分析宰后孵育不同时间肌肉中肌原纤维蛋白降解情况,由图可见,随着孵育时间延长,部分条带模糊甚至几乎消失,说明这些蛋白发生了降解。如图3~图5中,从上到下主要条带分别为220 kDa的肌球蛋白重链,100 kDa的α-辅肌动蛋白,43 kDa左右的肌动蛋白和23 kDa的肌球蛋白轻链1。如图3对照组中1~72 h蛋白条带几乎无差异,120 h后蛋白开始降解。
由图4可见,与calpain-1处理组相比,UK114+calpain-1组48~168 h条带整体变浅,在72 h时,UK114+calpain-1组中蛋白条带明显弱于calpain-1组,表明UK114可加强calpain-1对肌原纤维蛋白的降解,小片化指数升高。
图5为calpastatin处理组和UK114+calpastatin处理组肌原纤维蛋白变化图,与对照组相比,calpastatin组1~120 h条带无明显差异,168 h时条带变弱,说明加入calpastatin抑制了肌原纤维蛋白的降解;UK114+calpastatin组72 h后条带逐渐变浅,与calpastatin组相比,72 h降解程度较大。以上结果表明calpain-1对肌球蛋白和肌动蛋白均可以降解。
2.4 肌原纤维蛋白表面疏水性的变化
蛋白质的表面疏水性可以反映蛋白结构的聚集程度,还可以衡量蛋白质变性程度。如图6所示,肌肉在不同条件孵育过程中肌原纤维蛋白表面疏水性先上升后下降,但总体呈增加的趋势。孵育初期处理组的疏水性都上升,其中UK114+calpain-1处理组上升具有显著差异(P<0.05),其他处理组上升均不显著(P>0.05);对照组在72 h时表面疏水性最高,结合溴酚蓝的量为23.51 μg,显著高于其他时间;UK114+calpain-1处理组在24 h表面疏水性达到最高值,随后显著下降;calpastatin组在120 h时表面疏水性最高,达到了24.99;1~24 h均存在上升,但差异不显著(P>0.05),而24~120 h升高具有显著差异。疏水性降低原因可能是calpain-1降解肌原纤维蛋白,导致蛋白解链速度大于其聚集速度,使蛋白质中的极性分子暴露,疏水性残基包埋,造成疏水性短暂下降。
a-b-c表示同一处理组不同时间点差异显著(P<0.05)。下同

M:Maker;孵育时间分别为1,12,24,48,72,120,168 h。下同
Maker的左侧为calpain-1处理组,右侧为UK114+calpain-1

Maker的左侧为calpastatin处理组,右侧为UK114+calpastatin处理组
2.5 肌原纤维蛋白溶解度的变化
蛋白溶解度是衡量蛋白质变性和聚集的一种方法,蛋白结构的改变会影响溶解度,蛋白溶解度与其亲水性呈正相关,良好的蛋白溶解度是其发挥功能特性的前提。如图7所示,由于肌肉宰后存在僵直现象,在不同条件孵育过程中肌原纤维蛋白溶解度呈先下降后上升的趋势。宰后孵育1 h各组之间的溶解性几乎没有差异,孵育1~24 h,各组之间都显著下降(P<0.05);对照组在72 h溶解性最低,与其他时间存在显著差异(P<0.05),72~168 h溶解性显著上升;添加calpain-1组在48 h溶解度最低,为85.49,和对照组最低时差异不显著,提前结束了僵直期;UK114+calpain-1处理组在24 h时溶解度达到最小值,随后上升,24 h和其余孵育时间都存在显著性差异(P<0.05);Calpastatin组的溶解性在1~120 h都在下降,下降差异显著(P<0.05),在120 h和168 h时溶解度极显著低于其他组,说明加入calpastatin后影响了肌原纤维蛋白的降解速度;UK114+calpastatin组的溶解性在48 h后开始上升,可能是由于UK114与calpastatin竞争性地、在同一位点与calpain结合,从而减弱了calpastatin的抑制作用。

图6 宰后孵育不同时间肌原纤维蛋白表面疏水性的变化

图7 宰后孵育不同时间肌原纤维蛋白溶解度的变化
3 讨论与结论
肌原纤维蛋白是牛肉中含量最高的蛋白质,在牛肉宰后加工、贮藏和运输中会发生不同程度降解,进而改变肉的品质,calpain-1是引起宰后肌原纤维蛋白降解的最主要内源酶[3]。动物宰后ATP减少,pH降低,肌质网的钙泵功能发生崩解,释放Ca2+,钙离子浓度升高,激活calpain-1[22]。对照组牛肉在宰后4 ℃贮存期间,calpain-1活性在48 h后几乎消失,可能是由于calpain-1自溶作用增强和Ca2+浓度下降。He等[23]研究发现,鱼肉中calpain-1在宰后5 h活性最高,之后迅速下降;Lee等[24]报道,鸡calpain-1活性在6 h之后几乎消失。
Koohmaraie等[25]报道,屠宰后24 h牛肉中calpain-1的活性下降了50%,与本研究对照组结果一致。说明不同物种宰后不同时间calpain-1活性不同,而影响calpain-1活性的主要因素是UK114和calpastatin。
UK114+calpain-1组与只添加calpain-1组相比,前者calpain-1在1 h活性较低,在12 h活性明显增强,说明UK114能显著提高calpain-1的活性;Melloni等人[26]报道,UK114是calpain-1的激活剂,通过改变蛋白酶构象,降低calpain-1激活所需的Ca2+浓度而发挥作用。添加calpastatin后calpain-1在48 h内活性较低,而UK114+calpastatin组中calpain-1的活性在48 h很高,说明UK114蛋白可以减弱calpastatin的抑制作用。此抑制现象的发生可能由于UK114蛋白与calpastatin竞争性地、在同一位点与calpain-1结合[27],本结果与He等人的研究结果一致。
肌原纤维蛋白的表面疏水性和溶解性决定了其水合特性。本研究通过测定肌原纤维蛋白的表面疏水性,发现其随孵育时间总体呈增大趋势,这一研究结果与惠小洋[28]等的研究结果一致。前期升高的原因可能是宰后初期,蛋白质氧化程度低,表面疏水性残基逐渐暴露出来。随着孵育时间的延长,calpain-1活性升高,蛋白降解增强,使疏水性残基包埋,亲水性基团暴露,疏水性下降。添加UK114+calpain-1后蛋白表面疏水性开始下降的时间比对照组和只添加calpain-1组均提前,极值点提前到24 h,而添加UK114+calpastatin后疏水性上升的时间延长,原因可能是UK114不仅对calpain-1降解肌原纤维蛋白有促进作用,对calpastatin的活性也有一定的抑制作用。
UK114蛋白可通过促进calpain-1的激活,以及影响calpastatin的抑制作用,从而促进宰后牛肉肌原纤维蛋白的降解。随着孵育时间的延长,calpain和UK114+calpain处理组疏水性和溶解性的极值点分别提前到48 h和24 h;calpastatin处理组疏水性和溶解性的极值点推迟到120 h;但UK114+calpastatin处理组在48 h达到极值点。可见UK114蛋白可通过影响calpain-1和calpastatin对肌原纤维蛋白的降解作用,影响肌原纤维蛋白的溶解性,改善疏水性,为后续研究牛肉的成熟嫩化提供一种新途径。
