杜氏盐藻番茄红素ε-环化酶基因DsLYCE表达载体构建及其在烟草中瞬时表达分析
2020-04-28王计平安茜段露露赵熙宁岳敏崔红利李润植
王计平,安茜,段露露,赵熙宁,岳敏,崔红利,李润植
(山西农业大学 分子农业与生物能源研究所,山西 太谷 030801)
杜氏盐藻(Dunaliellasalina)是一种单细胞无细胞壁、耐盐性极高的光自养真核绿藻,能在高光、高温和高盐等极端环境下大量积累类胡萝卜素,特别是β-胡萝卜素含量可高达细胞干重的14%[1]。杜氏盐藻还能富集藻多糖和油脂等高值化合物,是一种独特、可商业化的优质生物资源。
类胡萝卜素(carotenoids)是一种天然色素,可分为两类,即碳氢四萜类化合物(胡萝卜素)和含氧衍生物(叶黄素)[2]。常见的类胡萝卜素包括α-胡萝卜素(α-carotene)、β-胡萝卜素(β-carotene)、虾青素(astaxanthin)、番茄红素(lycopene)等[2]。类胡萝卜素是一种亲脂的萜类化合物,可溶于非极性有机溶剂,能与细胞膜发生特异性结合[3]。DNA序列比对研究发现,杜氏盐藻具有参与类胡萝卜素合成两条途径即甲羟戊酸(mevalonic acid, MVA)途径和甲基赤藓糖醇(methylerythritol phosphate, MEP)途径中的相关酶基因[4]。因此,一般认为杜氏盐藻可能经过这两个途径将八氢番茄红素C20的前体牻牛儿基牻牛儿基焦磷酸(GGPP)合成异戊烯焦磷酸(IPP),再经过一系列酶促反应最终合成类胡萝卜素[5~7]。对一些高等植物和藻类的研究显示,番茄红素环化是类胡萝卜素生物合成途径的一个重要环节。番茄红素β-环化酶(lycopene β-cyclase,LYCB)和番茄红素ε-环化酶(lycopene ε-cyclase,LYCE)均可催化番茄红素环化反应。LYCE催化番茄红素分子产生 δ-胡萝卜素(δ-carotene),再经过LYCB的催化,δ-胡萝卜素生成α-胡萝卜素(α-carotene)。在合成β-胡萝卜素时,LYCB先连续2次催化番茄红素成为γ-胡萝卜素,然后再生成β-胡萝卜素。
抗艳红等[8]以番茄(东农704、东农709、东农906、利生一号)4个品种的下胚轴和子叶为受体,通过根癌农杆菌介导法将LYCE基因转入番茄中并获得了完整的抗性植株,经PCR和PCR- Southern分析鉴定,初步证明外源基因LYCE已整合到番茄的基因组中。有研究表明,在盐胁迫条件下雨生红球藻(HaematococcusPluvialis)细胞α-胡萝卜素含量显著升高,表明雨生红球藻含有较强活性的HpLCYE;进一步通过分析HpLCYE和HpLCYB之间的竞争和协作控制代谢通量等表征,揭示了HpLCYE与HpLCYB的独特环化顺序,以及用于杂环类胡萝卜素的生物合成的可能性[9]。目前,多数藻类LYCE序列是通过序列比对及基因组分析获得的,仅对包括小球藻[10](Chromochloris)在内的少数LCYE酶功能进行了研究,多数藻类LCYE的功能及作用机制还鲜为人知。我们前期初步探讨了LYCB在杜氏盐藻β-胡萝卜素合成和积累的作用[11],还不清楚LYCE是否与LYCB竞争底物或协调相关代谢通量而影响杜氏盐藻β-胡萝卜素富集。
本研究以从运城盐湖分离的一株杜氏盐藻(YC-Ds011)为试材,采用RT-PCR分离杜氏盐藻DsLYCE基因cDNA克隆,构建植物组成型表达载体pCAMBIA1303-DsLYCE,并转入农杆菌GV3101菌株;通过烟草瞬时表达DsLYCE,研究DsLYCE功能以及异源表达对高等植物类胡萝卜素合成及相关生理生化表征的影响。本研究将为全面解析DsLYCE功能及其应用于高等植物类胡萝卜素合成等代谢调控奠定基础。
1 材料与方法
1.1 植物材料
本氏烟草(Nicotianabenthamiana)种子由山西农业大学分子农业与生物能源所提供,将其播种于土壤中,放置在25 ℃,12 h·d-1光照培养箱中培养。培养60 d后用于农杆菌介导的基因瞬时表达。
1.2 菌株、质粒及试剂
农杆菌GV3101、pCAMBIA1303质粒、大肠杆菌DH5α由山西农业大学分子农业与生物能源所保存。限制性内切酶XbaI和KpnI、DNA Ladder Marker 购自生工生物工程有限公司; 琼脂糖凝胶回收试剂盒、Trizol购自天根生物公司;PCR引物由安徽通用生物公司合成; 中量质粒提取试剂盒、5X All-In-One MasterMix(with AccuRT Genomic DNA Removal Kit)反转录试剂盒均购于 ABM 公司。
1.3 杜氏盐藻总RNA的提取
取DM液体培养基培养13天杜氏盐藻,离心收集处于对数生长期的藻细胞(约108数量级),按照Trizol法提取盐藻总RNA。-80 ℃保存,备用。
1.4 杜氏盐藻LYCE基因的扩增
参考反转录试剂盒使用方法进行操作。用经过浓度和纯度测定后的总RNA作为模板,反转录合成的cDNA。反应体系参照说明书,反应条件:25 ℃,10 min;42 ℃,15 min;85 ℃,5 min。依据实验室前期获得的DsLYCE基因转录本序列设计扩增全长ORF的引物LYCE-F:5’-ATGAATTCCCTTCACAGTGGGTGCTGCAGC-3’和LYCE-R:5’-CACAAGAGGAGAAGGAGGTTTCGCAGCTG TGA-3’。高保真RT-PCR 反应采用Pfu DNA Polymerase 酶,反应体系参照说明书。反应条件为:95 ℃预变性5 min,58 ℃退火30 s, 68 ℃延伸2 min 30 s,30 次循环,68 ℃ 保温 15 min,16 ℃ 15 min。将所有扩增片断纯化回收后连接到PMD18-T 载体上,转入感受态大肠杆菌DH5-α中,筛选出阳性克隆,提取质粒DNA送通用生物公司(安徽)测序。
1.5 构建植物表达载体pCAMBIA1303+DsLYCE
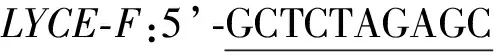
以携带DsLYCEORF 的PMD18-T克隆载体为模板,进行高保真PCR扩增。产物经过1% 琼脂糖凝胶电泳检测后,使用琼脂糖凝胶回收试剂盒回收并纯化目的片段。利用限制性内切酶XbaⅠ和KpnⅠ对PCR纯化产物及pCAMBIA1303质粒进行酶切,用T4 DNA连接酶将目标片段连接于pCAMBIA1303载体的MCS。然后将重组质粒转入大肠杆菌DH5α,筛选阳性克隆进行扩繁并提取质粒进行双酶切验证。植物表达载体pCAMBIA1303-LYCE的结构如图1所示。

图1 植物表达载体pCAMBIA1303-DsLYCE结构示意图
1.6 农杆菌介导的烟草瞬时表达分析
用质粒提取试剂盒提取质粒,利用热激法将构建好的超表达载体转入农杆菌GV3101中。平板培养,挑选单菌落进行检测后,在含有Rif和Kan的LB培养基中进行培养至OD600为0.6,用于烟草瞬时表达转化。配置含有乙酰丁香酮、MgSO4、MES的重悬液100 mL,重悬菌体浓度至OD600为0.2。室温放置4 h后,用注射器将农杆菌重悬液接种于烟草叶表面。接种后室温生长3 d后,提取叶片RNA。
1.7 烟草瞬时表达叶片GUS染色
取接种3 d后的烟草叶片进行GUS染色,将烟草叶片浸入X-GUS染液中,染色方法参照GUS染色试剂盒。
1.8 烟草瞬时表达的PCR检测
取烟草叶片利用液氮充分研磨,Trizol Reagent 提取总RNA,具体方法参照说明书。以RNA为模板,cDNA合成反应体系参照反转录试剂盒说明书,反应条件:25 ℃ 10 min;42 ℃ 15 min;85 ℃ 5 min。以获得cDNA为模板,用目的基因引物进行PCR扩增,产物用1%凝胶电泳检测。
1.9 烟草叶片色素提取及测定
取烟草叶片利用液氮研磨,加入80%的丙酮进行处理,定容至50 mL。4 ℃避光保存24 h至样品颜色发白,利用紫外分光光度计进行比色测定。转pCAMBIA1303空载烟草和未侵染的野生型烟草作为阴性对照。
2 结果
2.1 杜氏盐藻LYCE基因cDNA克隆
对源于杜氏盐藻藻株Ds-YC011藻细胞cDNA进行高保真RT-PCR扩增目标cDNA。扩增产物电泳分离结果(图2)显示,RT-PCR反应扩增出一条长度约为1 700 bp的目标条带。经测序获得1 686 bp的核苷酸序列。编码区序列与实验室中所获得杜氏盐藻LYCE基因序列比对结果表明,从Ds-YC011盐藻株系扩增的DsLYCEcDNA克隆与杜氏盐藻LYCE基因DNA序列有6%的差异,但推测的氨基酸序列无差异。这表明分离获得了正确的DsLYCEcDNA克隆。
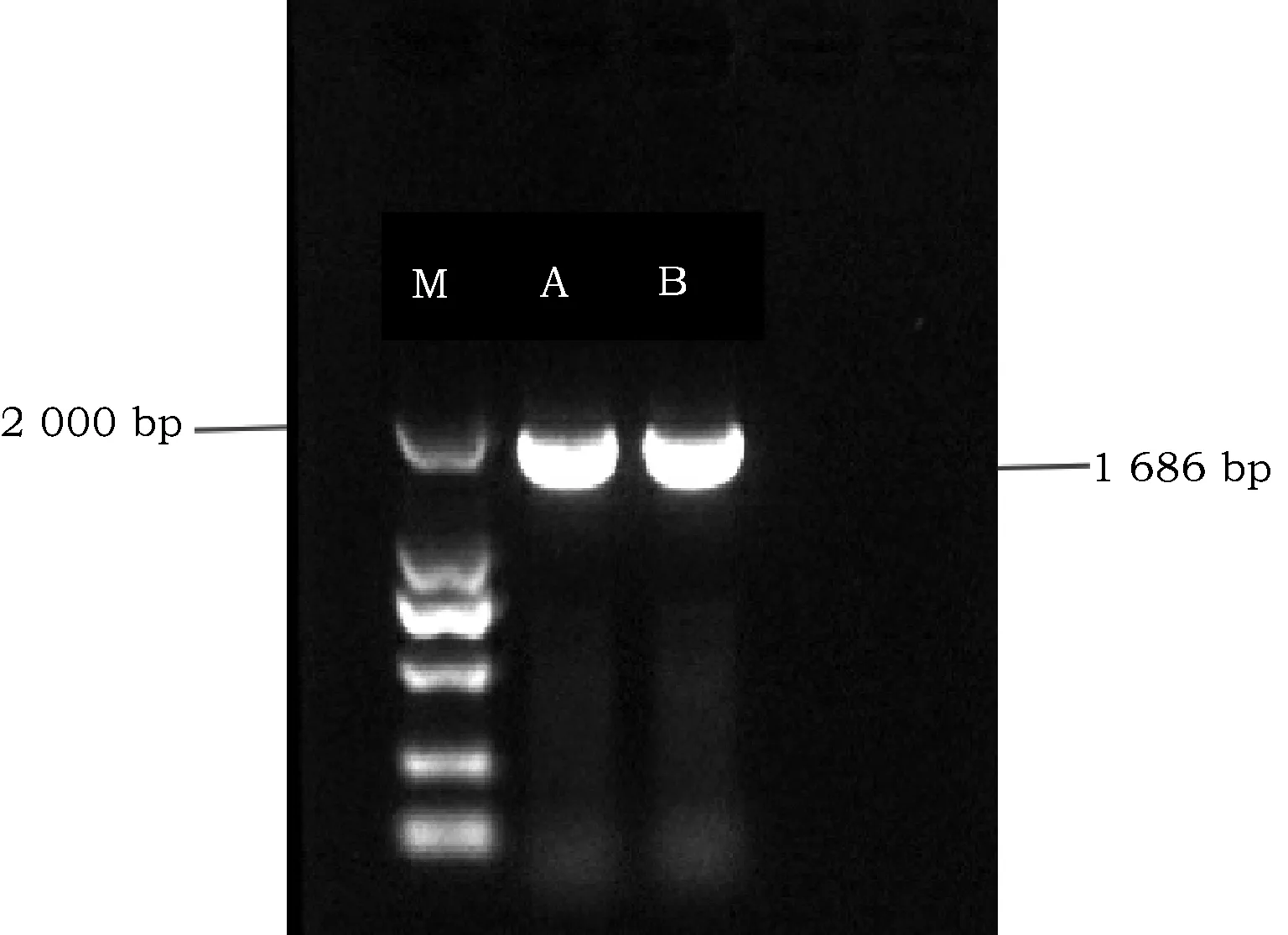
M为Marker;A、B为DsLYCE cDNA
2.2 pCAMBIA1303-DsLYCE表达载体的双酶切鉴定
经XbaⅠ和KpnⅠ对重组表达载体pCAMBIA1303-DsLYCE的酶切结果如图3所示,其中LYCE片段的大小约1 700 bp。

M:12 000 bp DNA Marker; A.XbaⅠ、KpnⅠ酶切pCAMBIA1303-DsLYCE质粒; B.pCAMBIA1303质粒
2.3 农杆菌转化检测结果
利用热激法转入农杆菌中,挑单菌落,进行菌液PCR检测。检测结果如图4所示,在1 700 bp处有目的条带,表明目的基因DsLYCE成功转入农杆菌中,保存并用于后续实验。

M:2 000 bp DNA Marker;泳道1、2、3、4、5为DsLYCE扩增片段
2.4 烟草叶片GUS染色
将野生型烟草叶片和DsLYCE瞬时表达的叶片在X-Gluc溶液中浸泡后镜检。如图5所示,A图为野生型烟草的GUS染色镜检结果,没有细胞呈现蓝色。B图为瞬时表达的烟草叶片GUS染色镜检结果,在视野中可以观察到细胞被染成蓝色,可见绿色荧光蛋白的表达与对照相比有明显差异。因此可以判断DsLYCE基因在烟草下表皮细胞中成功表达。
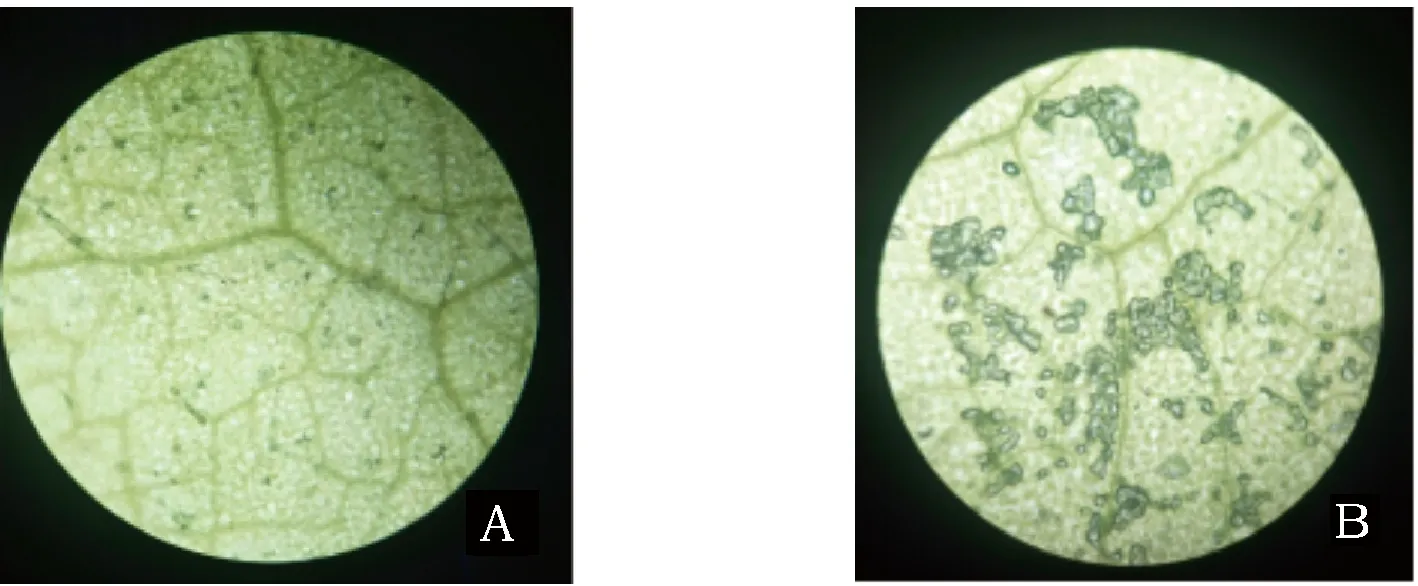
A野生型烟草;B 瞬时表达烟草
2.5 烟草瞬时表达PCR检测结果
提取各样品烟草叶片总RNA,并经核酸浓度仪测定其浓度及OD260/280值,OD260/280均在1.8~2.0之间,可用作后期cDNA合成和PCR检测DsLYCE基因表达。如图6所示,DsLYCE在烟草叶中有效表达。

M:2 000 bp DNA Marker;泳道1、2、3、4为DsLYCE扩增片段
2.6 DsLYCE瞬时表达对烟草叶片类胡萝卜素及叶绿素含量的影响
烟草叶片色素含量测定如图7所示,转入pCAMBIA1303空载烟草与野生型烟草叶片的类胡萝卜素、叶绿素a与叶绿素b的含量均没有明显的差异。转DsLYCE基因的烟草叶片中类胡萝卜素比野生型增加24%,类胡萝卜素含量差异达显著水平(P<0.05)。叶绿素a和叶绿素b含量较野生烟草及转空载的烟草叶片中的含量也显著提高。这说明DsLYCE能在异源烟草叶组织中行使催化功能,促进类胡萝卜素合成积累,同时还能提高叶绿素含量,有利于光合作用。
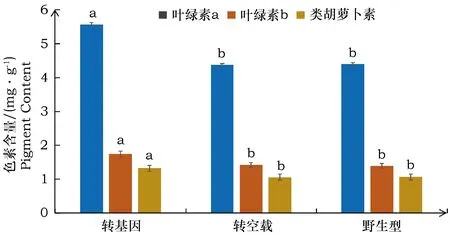
图中小写字母表示处理间存在显著性差异P<0.05
3 讨论
在植物类胡萝卜素合成途径中,番茄红素的环化是一个重要分支节点,番茄红素β-环化酶(LYCB)与LYCE的共同作用产生α-胡萝卜素。α-胡萝卜素是橘黄色脂溶性化合物,是合成叶黄素的生物前体。但目前关于α-胡萝卜素的合成机制研究甚少。在玉米中,已经克隆并鉴定了LYCE基因,属于单拷贝基因[12]。LYCE基因和LYCB基因共同表达的强弱,决定了α-胡萝卜素在类胡萝卜素中的比例[13]。有关研究表明:使用番茄红素环化酶抑制剂可降低LYCE基因的转录水平,可增加番茄红素的代谢量[14]。Halilu, Alhassan等人[15]利用分子标记法对类胡萝卜素生物合成过程中关键基因LYCE进行分析,结果表明:LYCE基因有利于玉米胚乳中维生素原A活性类胡萝卜素的增加。有关玉米天然类胡萝卜素变异的研究表明,降低LYCE等位基因的表达,可以增加β胡萝卜素的产量[12]。李群睿等[16]从自交系玉米B73克隆LYCE基因,并且发现该基因可在番茄红素的2个末端添加2个ε-紫罗兰酮环进而生成ε-胡萝卜素。江琳玉[17]成功地采用RT-PCR从中国水仙中克隆了LYCE基因。但是,目前关于LYCE基因在类胡萝卜素复杂的合成代谢途径中的具体分子机理研究,尤其是在微藻类胡萝卜素合成代谢中的作用鲜见报道。
为了深入研究DsLYCE在杜氏盐藻的类胡萝卜素合成过程中的分子机理,本文成功克隆到DsLYCE基因的cDNA,同时构建了pCAMBIA1303+DsLYCE植物表达载体,并采用农杆菌介导法在烟草瞬时表达以鉴定其功能。研究结果表明,转DsLYCE基因烟草叶片中类胡萝卜素比野生型增加24%,叶绿素a和叶绿素b含量也较野生型烟草及转空载的烟草叶片中的含量显著提高。这表明杜氏盐藻DsLYCE基因可编码具活性的酶蛋白,促进异源宿主烟草叶片中类胡萝卜素的合成与积累,以及提高叶绿素含量。叶绿素含量的提高可能是由于类胡萝卜素含量显著增加,保护叶绿素免受强光破坏,或者是由于DsLYCE过表达上调了叶绿素合成途径,具体作用机理有待进一步研究。
总之,本研究证明所分离的杜氏盐藻LYCE基因可编码具有活性的酶蛋白,在异源植物组织中超表达不仅能显著促进类胡萝卜素合成和积累,还有利于光合作用。这为解析包括微藻在内的植物类胡萝卜素生物合成的分子机制及相关色素代谢的遗传修饰提供了新知识和靶标分子。
