猪源奇异变形杆菌的分离鉴定及其Ⅰ类整合子的检测
2020-04-02石保秋张晓亮贾敬亮袁广富范京惠左玉柱
石保秋,张 迪,管 朔,张晓亮,贾敬亮,袁广富,王 晶,范京惠,左玉柱
(1.河北农业大学动物医学院,保定 071001;2.定州市动物防疫监督总站,定州 073000;3.衡水市畜牧技术推广站,衡水 053000)
变形杆菌是一种人畜共患的条件致病菌,属于肠杆菌科变形杆菌属,是一种无荚膜、无芽孢的具有迁徙生长能力的革兰氏阴性杆菌,包括普通变形杆菌、奇异变形杆菌、产黏变形杆菌、潘氏变形杆菌和豪氏变形杆菌五种,其中奇异变形杆菌(Proteus mirabilis,PM)致病性最强[1]。近年来,奇异变形杆菌引起的人和动物发病的报道不断增多[2-3],关于变形杆菌的耐药报道也不断增多[4-6]。细菌耐药与质粒、转座子、整合型噬菌体以及近年来在细菌中发现的一种天然的克隆表达系统整合子(integron)密切相关[7]。目前已经发现的整合子,依据整合酶氨基酸序列的不同可分为6类,与耐药相关的整合子主要是Ⅰ、Ⅱ、Ⅲ类,尤其是Ⅰ类整合子在革兰氏阴性杆菌中最为常见[8]。本研究对2018年7月分离自河北新乐市行唐县某猪场病料中的疑似变形杆菌菌株进行培养纯化、革兰氏染色、迁徙生长实验、16S rDNA 基因序列BLAST分析比对,确定两株细菌为奇异变形杆菌;本研究并对两株奇异变形杆菌进行小鼠致病实验,菌株体外药敏试验以及耐药基因Ⅰ类整合子的检测,以期丰富猪源奇异变形杆菌的病原资料,为生产实践中对该病的预防治疗提供依据。
1 材料与方法
1.1 样品和试验动物 来自石家庄新乐某猪场和行唐某猪场送检病死猪的肺脏、肝脏、脾脏、肾脏等组织。SPF级昆明小鼠45只,体重为18~22 g,购自河北医科大学动物实验中心。
1.2 培养基及主要试剂 胰蛋白胨大豆琼脂培养基(TSA)、胰酪大豆胨液体培养基(TSB)、营养琼脂购自北京奥博星生物技术有限责任公司;鲜血琼脂平板由本实验室配制;革兰氏染色液购自潍坊市康华生物技术有限公司;药敏片购自温州康泰生物技术有限公司;2×mix购自康为世纪公司;琼脂糖凝胶DNA回收试剂盒购自美国BIOMIGA公司;pMD19-T、DL2000 DNA marker、DL5000 DNA marker购自宝生物工程(大连)有限公司,大肠杆菌 DH5α由河北农业大学动物医学院预防兽医实验室制备保存。
1.3 细菌分离纯化染色镜检 无菌剪取深层组织涂布在TSA培养基上,置于37℃恒温恒湿培养箱24 h,挑取疑似菌落继续纯化培养,直至获得形态一致的单菌落时,进行涂片革兰氏染色镜检。挑取单菌落分别接种在营养琼脂平板和鲜血琼脂平板。新乐市分离株命名为XL株,行唐分离株命名为XT株。
1.4 迁徙生长试验 分别挑取两株纯化后菌落接种于TSA培养基平板的中心,过夜培养12 h,观察是否有迁徙生长现象。
1.5 16S rDNA序列测定及分析 将已纯化的细菌接种到TSB液体培养基,37℃、200 r/min 摇菌过夜12 h,取菌液1 mL,于13 201×g、4℃离心2 min,收集菌体,加150 μL ddH2O涡旋,煮沸10 min后,13201×g、4℃离心1 min,上清液作为模板,-20℃冰箱保存备用。细菌16S rDNA的通用引物,由生工生物工程(上海)股份有限公司合成。27F:5'-AGAGTTTGATCCTGGCTCAG-3',1492R:5'-TACGGCTACCTTGTTACGACTT-3'[9],预计扩增片段长度为1500 bp。PCR体系(20 μL):2×TaqPCR mix 10 μL,ddH2O 6 μL,上下游引物各1 μL,模板2 μL。PCR程序为:94℃预变性5 min,94℃变性30 s,52℃退火30 s,72℃延伸1 min 40 s,30个循环,72℃延伸10 min,将PCR回收产物连接到pMD19-T载体,转入大肠杆菌DH5α送北京中科西林公司测序。利用DNAStar软件对不同来源的奇异变形杆菌进行同源性分析,构建进化树。
1.6 小鼠致病试验 将小鼠随机分成9组,每组5只,其中1~4组分别腹腔注射倍比(10-3~100)稀释的XL株菌液0.2 mL,5~8组分别腹腔注射倍比(10-3~100)稀释的XT株菌液0.2 mL,9组为对照组,腹腔注射TSB液体培养基0.2 mL。接种后每天观察小白鼠发病、死亡情况并做好记录,及时解剖死亡小鼠,进行细菌分离,连续观察7 d。用平板计数法测得XL株菌液初浓度为2.3×108CFU/mL,XT株菌液初浓度为2.1×108CFU/mL。
1.7 药敏试验 采用药敏片琼脂扩散法(K-B法)对分离的菌株进行试验。将已纯化的XL株、XT株菌液用TSB液体培养基稀释至1.5×108CFU/mL,用无菌棉签沾取菌液均匀地涂布于营养琼脂培养基表面,用无菌镊子夹取20种药敏纸片贴至平板表面,37℃倒置培养18 h后测量抑菌圈直径,参照美国临床和实验室标准协会(clinical and laboratory standards institute,CLSI)手册2013版进行结果判定。
1.8 Ⅰ类整合子的检测 整合子的基本结构由5'保守末端(5'-conserved segment,5'-CS)、3'保守末端(3'-conserved segment,3'-CS)及中间的可变区组成(variable region,VR)[10]。依据两端保守区设计合成引物,int-F:5'-GGCATCCAAGCAGCAAG-3'和int-R:5'-AAGCAGACTTGACCTGA-3'[11],可变区为640~3500 bp[12]。扩增体系(20 μL):2×TaqPCR mix 10 μL,ddH2O 6 μL,上下游引物各1 μL,模板2 μL。扩增程序为:94℃预变性5 min,94℃变性30 s,58℃退火30 s,72℃延伸4 min,30个循环;72℃延伸10 min,PCR产物经琼脂糖凝胶电泳,回收目的基因并连接至pMD19-T载体,转入大肠杆菌DH5α进行克隆后,送北京中科西林公司测序,测序结果与NCBI公布相关序列比对。
2 结果
2.1 病原菌分离培养特征及迁徙生长现象 分离细菌XL株、XT株经多次纯化后获得色泽、形态单一的,呈圆形、扁平、半透明菌落,成扩散性生长,血琼脂平板出现溶血现象。革兰氏染色,油镜下镜检,发现分离菌株为两端钝圆的革兰氏阴性短杆菌(图1A)。迁徙生长试验结果出现了明显的同心圆环,每波圆环的外侧逐渐由半透明变为乳白色(图1B),出现典型的迁徙生长,符合变形杆菌的周期性群集运动特征[13]。XL株和XT株的形态和迁徙生长现象无明显区别,图片为XL株。
2.2 16S rDNA扩增 通用引物扩增16S rDNA结果(图2)所示,其扩增条带在1500 bp 左右,符合预期的片段长度。
2.3 16S rDNA序列同源性比较与系统进化树的构建 将测序结果在NCBI进行BLAST分析对比,利用DNAStar 软件进行核苷酸同源性分析,并构建系统进化发育树 ,从图3可以看出分离菌XL、XT株同源性为99.9%,亲缘关系非常近,两株细菌与猪源奇异变形杆菌(GenBank登录号:HQ259935.1,CP034091.1)的同源性最高,为99.9%~100%,在分子水平证实两株细菌为奇异变形杆菌。与潘氏变形杆菌(GenBank登录号:KM259958.1、AB682277.1)、豪氏变形杆菌(GenBank登录号:JX101457.1、KF733657.1)、产粘液变形杆菌(GenBank登录号:AB682280.1、AB273746.1)的同源性为98.0%~99.4%,与肺炎克雷伯菌(GenBank登录号:KT316422.1)、普罗维登斯菌(GenBank登录号:KC456564.1)的同源性较低,为93.1%~94.6%。进化树显示分离菌与猪源奇异变形杆菌在同一分支,见图4。

图1 奇异变形杆菌XL株的形态特征Fig.1 Morphological characteristics of Proteus mirabilis XL strain

图2 16S rDNA 扩增结果Fig.2 16S rDNA amplification results

图3 16S rDNA基因序列同源性比对Fig.3 16S rDNA gene sequence homology alignment

图4 分离菌XT、XL株16S rDNA 基因的系统发育树Fig.4 Phylogenetic tree of the strain XT and XL 16S rDNA genes
2.4 小鼠致病试验 将XL株菌液以2.3×108CFU/mL浓度腹腔注射的小鼠,8 h后出现精神萎靡、蜷缩、全身震颤、眼睛有分泌物且出血,16 h出现死亡;以2.3×106CFU/mL注射的小鼠,24 h后出现精神萎靡、粪便变稀粘连,48 h恢复正常。将XT株菌液以2.1×108CFU/mL浓度腹腔注射的小鼠,8 h后出现死亡,24 h小鼠全部死亡;以2.1×106CFU/mL注射的小鼠也有死亡,对照组全部正常存活,详细下表1。采用改良寇氏计算LD50方法,XL株的LD50为2.9×107CFU/mL,XT株的LD50为4.19×106CFU/mL。
2.5 药敏实验结果 药敏结果均见表2。两株细菌耐药性均很强,XL株对头孢曲松、丁胺卡那、大观霉素敏感,对米诺环素、庆大霉素中度敏感,对其他15种药物耐药。XT株仅对丁胺卡那敏感,对米诺环素、庆大霉素、氟苯尼考中度敏感,对其他16种药物耐药,说明两株细菌的耐药性有一定的差异。
2.6 Ⅰ类整合子的扩增结果 XL株和XT株均扩增出了整合子可变区条带,结果见图5,XL株扩增出3000 bp左右的条带,XT株在2000 bp上下各扩增出的一条带。经测序比对,XL株整合子携带的基因盒为“dfrA32+ereA+aadA2”,产生对甲氧苄氨嘧啶、红霉素类与氨基糖苷类的耐药性;XT株扩增出两整合子携带“aadA2+linF”和“dfrA17+aadA5”等基因盒,分别产生对甲氧苄氨嘧啶与林可霉素类的耐药性和对甲氧苄氨嘧啶与氨基糖苷类的耐药性。

表1 同样方式注射小鼠,小鼠实验的实验结果Table 1 Experimental results of mouse experiments
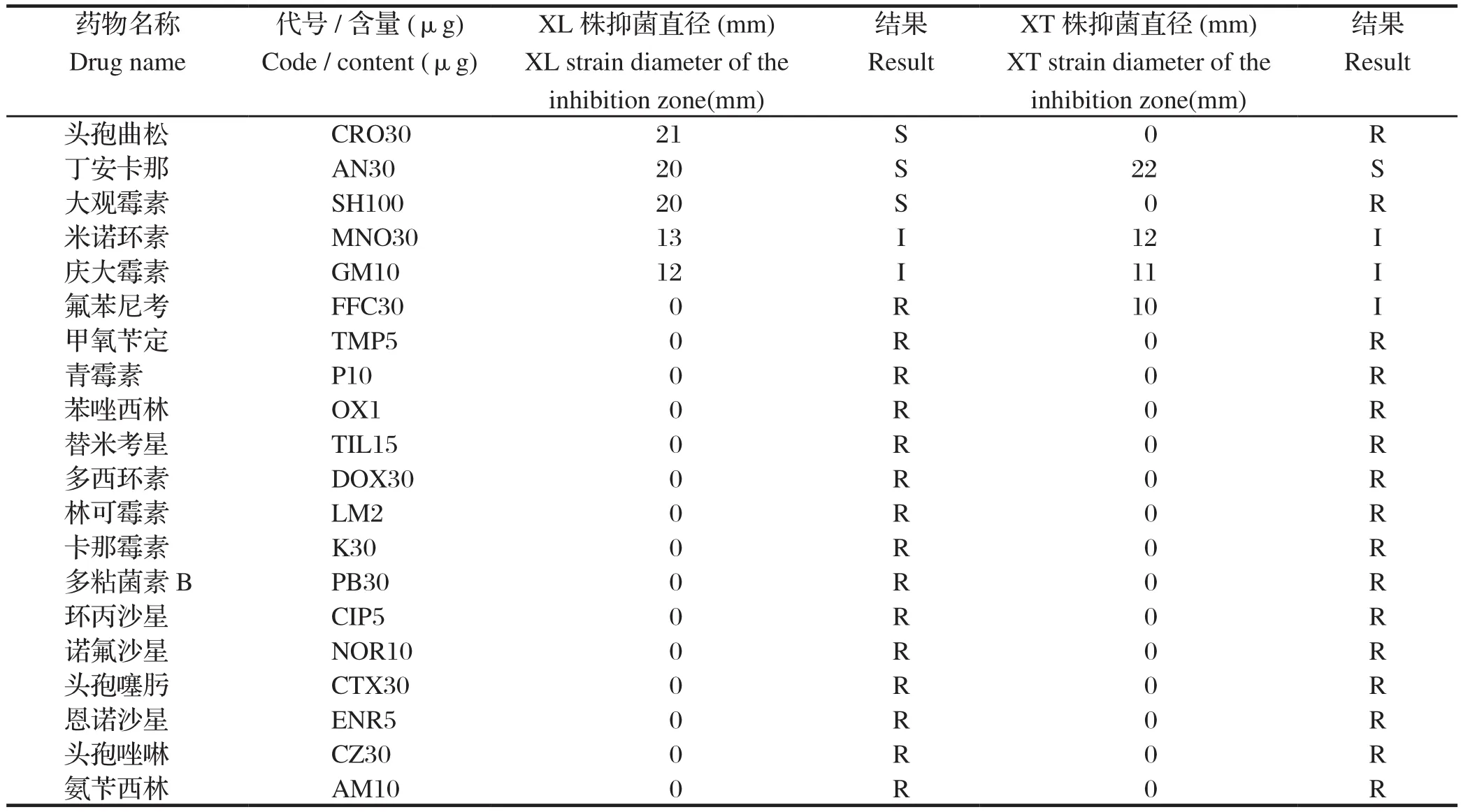
表2 药敏实验结果Table 2 Detailed results of drug susceptibility
3 讨论

图5 I类整合子的检测结果Fig.5 Test results of class I integrons
变形杆菌作为一种人兽共患的条件致病菌,在多种动物[3]、市场肉品[14]以及人的相关报道中不断增多,该菌的发病率和死亡率都较高,给人类和畜牧业发展带来较大的经济损失。有研究表明无论是发酵床养猪还是常规方式饲养,环境中均能分离到奇异变形杆菌,且发酵床中分离菌毒力更强[15]。本研究通过对不同来源的病死猪中分离到的细菌,进行纯化培养、染色镜检及16S rDNA的扩增测序比对,最终鉴定分离菌为奇异变形杆菌,分别命名为XL株、XT株。应用高度保守的细菌16S rDNA序列分析对细菌进行鉴定已经是国际上通的鉴定技术[16]。由于变形杆菌的生化实验与沙门氏菌相似,很容易误判[17],所以本实验没有进行生化实验,而是直接进行16S rDNA的扩增,从分子水平进行细菌种属的鉴定。从16S rDNA的序列比对中可以看出两株细菌同源关系很近,处在同一分支,与NCBI上登录的奇异变形杆菌的16S rDNA基因同源性高达99.9%~100%,与同属革兰氏阴性菌的肺炎克雷伯菌、普罗维登斯菌亲缘关系较远。小鼠致病试验结果显示,两株细菌致病性均很强,但毒力存在差异,XL株的LD50为2.9×107CFU/mL,XT株的LD50为4.19×106CFU/mL。这可能与两株细菌携带的毒力基因不同有一定的关系[18]。
两株细菌都多重耐药,国内外大量文献报道整合子与细菌的耐药性密切相关[19]。整合子在耐药基因的水平转移中起到了至关重要的作用,是细菌中的一种可移动性基因元件,5'-CS端有编码整合酶的基因int,它可使耐药基因盒从一个细菌传播到另一个细菌,或者从一个DNA分子传播到另一个DNA分子,从而引起耐药性的相互传播。本研究两株奇异变形杆菌均扩增出整合子,整合子所携带的基因盒存在一定的差异。两株细菌都扩增出了介导对甲氧苄氨嘧啶和氨基糖苷类等药物的耐药相关基因,但是XL株还携带介导对红霉素类耐药的基因,XT株携带介导对林可霉素类耐药的基因,XL株只有1个整合子而XT株有2个整合子。与宿主菌的耐药表型并不严格对应,如XL株没有扩增出介导耐林可霉素类药物的基因,而XT株扩增出了相关基因,但是药敏结果显示两株细菌都对林可霉素耐药,有研究表明变形杆菌还存在其他的耐药基因[20],对两株细菌的耐药性有待进一步深入研究。为了防止耐药基因的扩散,一方面要进一步研究整合子的整合机制,另一方面养殖场也要合理的使用抗生素,不滥用抗生素。本研究分离鉴定了两株猪源奇异变形杆菌,比对了他们16S rDNA同源性并构建了系统进化树,并对两株细菌的毒力、耐药性以及耐药相关基因做了初步探讨,为下一步生产实践中对该病的预防治疗提供了依据。
