flaA基因的缺失对绵羊脑炎单核细胞增生李斯特菌的细胞黏附、侵袭能力及生物被膜形成能力影响的研究
2020-04-02柴迎锦孔静雅韩猛立
柴迎锦 ,孔静雅 ,邬 琴 ,李 劼 ,周 霞 ,马 勋 ,韩猛立
(1.石河子大学动物科技学院,石河子 832003;2.新疆农垦科学院 省部共建绵羊遗传改良与健康养殖国家重点实验室,石河子 832000)
单核细胞增生李斯特菌(Listeria monocytogenes,LM)是人畜共患病的重要病原之一。人感染后有较高的死亡率,在兽医临床中牛羊感染后表现为 “转圈病”及孕畜发生流产等症状,给畜牧业生产带来较大的影响。在致病过程中细菌携带的鞭毛、菌毛、表面蛋白等[1]毒力因子对细胞的黏附和侵袭以及生物被膜(bacterial biofilm,BF)的形成发挥着重要作用。细菌的鞭毛在介导黏附时既能通过自身的运动性非特异性增加细菌与受体细胞接触机率,促进黏附并侵入宿主引发感染,也能通过鞭毛蛋白特异性与被感染细胞的鞭毛受体结合来完成细菌的黏附和侵袭[2-3]。脑炎大肠杆菌鞭毛基因缺失后对人脑微血管内皮细胞的黏附能力显著降低[4],大肠杆菌F18+的鞭毛缺失后对IPEC-1和IPEC-J2细胞的黏附能力也降低[5]。研究表明LM的鞭毛基因(flaA)过表达时能诱导强烈的细胞反应[6]。鞭毛介导细菌在液体中的泳动能在BF的形成中起到一定的作用,缺失了flaA基因后单核细胞增生李斯特菌GMYL1447的鞭毛形成缺陷、运动性能丧失,形成BF的能力明显降低,但缺失株在营养物质充裕的环境中却能过度生成BF[7-8]。
笔者所在实验室从发生“转圈病”的羔羊大脑中分离鉴定了一株LM,命名为LM90SB2。研究表明该分离株携带有多种毒力因子,能成功穿越血脑屏障,形成完整的BF,flaA基因缺失能影响细菌的半数致死量(lethal dose 50,LD50)[9-10],但对宿主细胞的黏附和侵袭作用以及BF形成规律的影响并不明确。本研究通过在前期研究基础上观察缺失flaA基因的LM LM90SB2-ΔflaA对小鼠巨噬细胞(RAW264.7)和小鼠脑微血管内皮细胞(mouse brain microvascular endothelial cells,MBMEC)的黏附和侵袭、不同时间段BF形成能力,分析flaA基因对LM毒力影响,为LM致病机制的进一步研究奠定基础。
1 材料与方法
1.1 材料 LM LM90SB2株由石河子大学预防兽医实验室分离鉴定保存,其flaA基因缺失株(LM90SB2-ΔflaA)由作者所在实验室构建;RAW264.7与MBMEC由新疆农垦科学院实验室保存;碘化丙啶(propidium iodide,PI)和异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的刀豆蛋白A(FITC-ConA)购自美国Sigma公司;高糖DMEM细胞培养液购自Hyclone公司。
1.2 对MBMEC的黏附、侵袭 将MBMEC置于9孔细胞培养板,在含有10%胎牛血清(fetal bovine serum,FBS)和双抗(100 U/mL 青霉素和10 μg/mL 硫酸链霉素)的DMEM(dulbecco's modified eagle's medium)中培养,置于含5%CO2的37℃细胞培养箱中。培养至细胞单层铺于培养皿时,将LM90SB2与LM90SB2-ΔflaA菌悬液分别加入细胞培养板,培养1 h后洗涤并加入裂解液TritonX-100,倍比稀释后计算黏附MBMEC的细菌数。
侵袭1 h后用含庆大霉素(100 μg/mL)的细胞完全培养液杀灭胞外细菌,经过2 h的作用后PBS洗涤细胞板,按照上述方法统计侵袭入MBMEC的细菌数。
1.3 对RAW264.7细胞的黏附、侵袭 操作方法同1.2。
1.4 BF定量测定 将LM90SB2与LM90SB2-ΔflaA接种于96孔板,分别培养2、6、10、12、24、36、48 h后,加入10%结晶紫染色,再用乙醇-丙酮溶液溶解,测定D595值,采用SPSS Statistics软件进行单因素方差分析。
1.5 激光共聚焦显微镜观察BF的形成 将LM90SB2与LM90SB2-ΔflaA接种于放置有盖玻片的6孔细胞板中,培养6、24 h后取出盖玻片,用FITC-ConA和PI染液避光孵育后,在激光共聚焦显微镜(200×)观察BF的形态。
1.6 小鼠肝脏、脾脏、肾脏载菌量的测定 将LM90SB2与LM90SB2-ΔflaA分别以LM90SB2的LD50的三分之二菌量感染小鼠,于感染后第24、48、72 h采集小鼠的肝脏、脾脏和肾脏进行载菌量计数分析。
2 结果
2.1 对MBMEC黏附和侵袭结果 黏附MBMEC 1 h后,LM90SB2-ΔflaA的黏附率(1.6%)显著低于LM90SB2黏附率(2.8%),差异具有统计学意义(P<0.05),见图1;2 h后,侵袭MBMEC细胞的LM90SB2-ΔflaA的侵袭率约为0.058%,LM90SB2侵袭率约为0.065%,两者差异不显著,不具有统计学意义(P>0.05),见图2。
2.2 RAW264.7细胞的黏附和侵袭结果 黏附RAW264.7细胞1 h后,LM90SB2-ΔflaA的率(5.0%)显著低于LM90SB2黏附率(8.9%)(P<0.05),差异具有统计学意义,见图1;2 h后,LM90SB2-ΔflaA的侵袭率(2.3%)显著低于LM90SB2侵袭率(3.3%)具有统计学意义(P<0.05),见图2。
2.3 BF形成量的测定结果 LM90SB2-ΔflaA与LM90SB2的BF形成规律基本相同,均从2 h形成BF,2~10 h BF逐渐增多,10 h时BF形成量进入平稳阶段,但BF总量两者存在显著差异(P<0.05),具有统计学意义;10 h后BF处于成熟阶段,总量略有下降但总体较平稳,解聚与形成过程处于动态平衡状态,10 h后各个时间点LM90SB2-ΔflaA的BF形成量均比LM90SB2形成的低(P<0.05),差异具有统计学意义,见图3。

图1 LM90SB2与LM90SB2-Δf l aA黏附率Fig.1 The adhension of LM90SB2 and LM90SB2-Δf l aA

图2 LM90SB2与LM90SB2-Δf l aA侵袭率Fig.2 The invasion of LM90SB2 and LM90SB2-Δf l aA

图3 LM90SB2与LM90SB2-Δf l aA形成BF的D595值Fig.3 D595 of BF produced by LM90SB2 and LM90SB2-Δf l aA
2.4 激光共聚焦显微镜观察BF的形态结构结果LM90SB2-ΔflaA细菌核酸(红色荧光)在6 h和24 h时明显少于LM90SB2,随着培养时间的延长,即24 h检测时红色荧光均明显增多,见图4。其多糖物质也随着培养时间的延长逐渐增多(绿色荧光),6 h时可观察到LM90SB2-ΔflaA带有绿色荧光多糖,而24 h则出现大量的多糖物质,见图5。与LM90SB2-ΔflaA相比较,LM90SB2也呈现相似规律,但在每个阶段死亡细菌的数量和多糖产生量明显多于LM90SB2-ΔflaA,见图4、5。

图4 LM90SB2与LM90SB2-Δf l aA不同时间的核酸量Fig.4 Polysaccharides produced by LM90SB2 and LM90SB2-Δf l aA at different time points

图5 LM90SB2与LM90SB2-Δf l aA不同时间的多糖形成量Fig.5 Polysaccharides produced by LM90SB2 and LM90SB2-Δf l aA at different time points
2.5 肝脏、脾脏、肾脏载菌量的测定结果 接种后两组小鼠均出现了精神不振、行动缓慢、被毛杂乱、眼睛分泌物增多等症状。分别在接种后第24、48、72 h对小鼠进行解剖,发现两组小鼠肝脏、脾脏、肾脏都出现了明显的肿大,脾脏病变明显,从接种48 h后两组小鼠均出现了脾脏大理石样变。
肝脏载菌量LM90SB2-ΔflaA组显著低于LM90SB2组,差异具有统计学意义(P<0.05),见图6A;脾脏载菌量LM90SB2-ΔflaA组在各个时间点均低于LM90SB2组的载菌量,但差异不显著,不具有统计学意义(P>0.05),见图6B;肾脏载菌量LM90SB2-ΔflaA组与LM90SB2组比较,差异不显著,不具有统计学意义(P>0.05),见图6C。
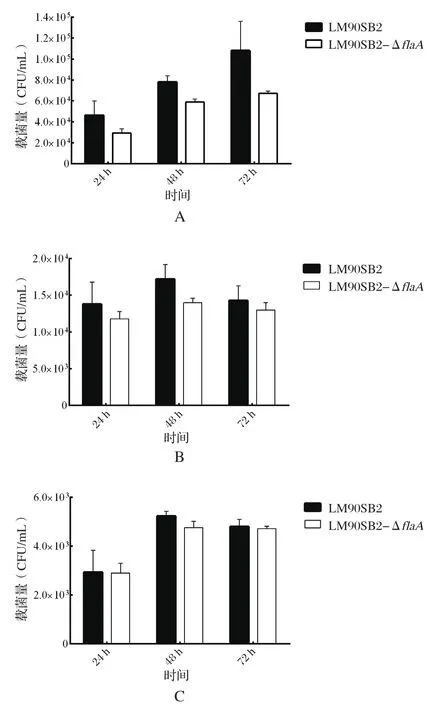
图6 LM90SB2和LM90SB2-Δ fl aA在小鼠体内的载菌量测定结果Fig.6 The microbial numbers of LM90SB2 and LM90SB2-Δ fl aA in mice
3 讨论
LM通过动物的血脑屏障引起中枢神经系统疾患。小鼠脑微血管内皮细胞(MBMEC)、小鼠巨噬细胞(RAW264.7)能够作为模式细胞进行LM相关研究[11-12]。鞭毛在细菌感染过程可通过自身特点参与宿主细胞的黏附和侵袭[13]。同时在BF形成中使浮游细菌趋化、克服载体表面张力、非活性载体表面的黏附、稳定BF结构等作用[14]。如大肠杆菌F18ab的fliC基因缺失后对细胞的黏附和侵袭能以及形成BF的能力降低[4]。编码LM细胞质合成酶的fliI基因缺失后鞭毛形成缺陷,黏附和侵袭上皮细胞与巨噬细胞能力降低[15]。本文通过构建LM90SB2flaA基因缺失株发现缺失株对MBMEC细胞的黏附数显著降低,而侵袭数差异不显著;对RAW264.7细胞的黏附数和侵袭数均显著降低。推测flaA在LM穿越血脑屏障时发挥重要作用,但并不参全过程,而flaA缺失能降低细菌对巨噬细胞的黏附和穿入作用。
很多能形成BF的菌株中flaA基因的检出率极高[16],比如,空肠弯曲杆菌、霍乱弧菌等缺失flaA基因后BF形成能力降低[17-20]。LM中flaA的表达受flgL基因的调控,缺失了flaA基因后的GMYL1447与缺失了flgL基因的GMYL1432的BF形成能力明显降低;但在氧气、特殊pH、营养充足的工业模型环境中的缺失flaA与flgL基因的LM能引发BF过度形成[8]。本研究通过检测flaA缺失株时发现BF形成量下降、BF中的多糖与核酸的含量也明显减少,表明flaA在一定程度上影响LM90SB2的BF形成。
相同菌量的LM90SB2和LM90SB2-ΔflaA通过腹腔注射感染小鼠后,分别在接种第24、48、72 h对小鼠的肝脏、脾脏、肾脏的载菌量检测发现,小鼠脏器含有的LM90SB2-ΔflaA量始终低于LM90SB2量。说明flaA基因的缺失会影响LM90SB2在各脏器中的增殖。
本研究发现flaA基因的缺失虽然没有完全丧失LM90SB2的致病性和毒力,但是flaA基因的缺失确实减弱了LM90SB2的致病性和毒力,同时影响了LM90SB2的BF形成和对细胞的侵害。由此,可初步推测flaA基因的缺失能影响单核细胞李斯特菌致病性等特性,但其中具体作用机制仍需进一步的试验研究。
