云南省新发猪圆环病毒3型感染状况调查与全基因进化分析
2020-04-02曾彩虹毕峻龙孙显国杨贵树尹革芬
曾彩虹,蓝 睿,毕峻龙,,陶 鑫,孙显国,赵 谦,杨贵树,尹革芬
(1. 云南农业大学动物医学院,昆明650201;2. 楚雄州动物疫病预防控制中心,楚雄 675000)
猪圆环病毒(Porcine circovirus,PCV)是无囊膜的环状DNA病毒,属于圆环病毒科圆环病毒属[1]。目前发现的圆环病毒有3个血清型,即PCV1、PCV2和新发现的PCV3。2015年6月,美国北卡罗来纳州猪场暴发了猪皮炎和肾病综合征(Porcine dermatitis and nephropathy syndrome,PDNS)疫情,Palinski等[2]通过NGS测序技术,从患有急性心肌炎和多系统炎症的保育猪中检测出一种新型病毒,该病毒与圆环病毒科其他成员具有类似基因组结构和遗传相似性,但衣壳蛋白氨基酸序列同源性低于70%,根据圆环病毒分类标准[3],将其归类为一种新的圆环病毒,命名为PCV3[2]。2017年,Shen等[4]报道了我国首例PCV3感染;Ku等[5]也开展了PCV3临床调查,发现PCV3与母猪繁殖障碍疾病具有关联性,国内11个省及地区均有PCV3分布;广东[6]、湖北[7]等中东部地区14个城市也有PCV3感染与流行[8],然而PCV3在云南省猪群中的流行情况未见报道。因此,目前非常有必要了解PCV3在云南省不同地区猪群中的流行情况。
本研究拟通过建立PCR方法,对2017~2018年云南省不同地区猪场采集的样品进行PCV3检测,并对扩增获得的全基因序列进行遗传进化分析。本研究结果为PCV3疫情的预防和控制提供一定的理论依据。
1 材料与方法
1.1 毒株及样品 PCV3阳性质粒由军事医学科学院兽医研究所惠赠。2017~2018年,样品采自云南省12个地市29个区县的规模种猪场,共计431份,保存于液氮中备用。
1.2 主要试剂 DNA提取试剂盒购自北京百泰克生物科技有限公司;DNA胶回收试剂盒和质粒提取试剂盒购自生工生物工程(上海)有限公司;2×Trans HiFi Super MixⅡ购自北京全式金生物技术有限公司;感受态细胞DH5α、pMD18-T载体、DNA marker等购自宝生物工程(大连)有限公司。
1.3 引物设计 参考NCBI公布的PCV3全基因组序列(GenBank登录号:KY075987.1),利用Primer Premier 6.0针对其保守序列设计特异性引物,PCV3-F:5'-TTACTTAGAGAACGGACTTGTAA CG-3'和PCV3-R:5'-ATAGGAGACACAGAGCT ATAGTCAG-3',扩增片段为651 bp,引物由昆明擎科生物有限公司合成。
1.4 PCR检测方法的建立
1.4.1 退火温度优化 参照PCR Mix说明书,配制PCR反应体系:HIFI Mix12.5 μL,上游、下游引物各0.5 μL,ddH2O 10.5 μL,PCV3质粒模板1 μL。PCR反应程序:95℃预变性5 min;94℃变性30s,退火温度50℃~59℃ 30 s,72℃延伸40 s,35个循环;72℃延伸5 min;取10 μL PCR扩增产物进行1.5%琼脂糖凝胶(含0.2%EB)电泳(120 V,30 min),在凝胶成像系统上观察结果,并拍照。
1.4.2 敏感性试验 将PCV3质粒模板作10倍梯度稀释,设置10个稀释梯度,分别取1 μL稀释后的质粒作为模板,按照最优反应体系和退火温度进行PCR扩增,在凝胶成像系统上观察电泳结果。
1.4.3 特异性试验 以圆环病毒Ⅰ型(Porcine circovirusⅠ,PCV1)、圆环病毒Ⅱ型(Porcine circovirusⅡ,PCV2)、副猪嗜血杆菌(haemophilus parasuis,HPS)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)的基因组及水作为模板,用设计的PCV3引物及最优反应体系和退火温度进行PCR扩增,在凝胶成像系统上观察电泳结果。
1.5 临床样品检测 对样品进行研磨、离心等处理后,按照DNA提取试剂盒要求提取基因组DNA,用建立的PCR检测方法对总DNA进行PCR扩增,取10 μL PCR产物进行1.5%琼脂糖凝胶(含0.2%EB)电泳(120 V,30 min),在凝胶成像系统上观察结果,并拍照。
1.6 全基因序列的扩增 选取来自于云南省东部、中部和西部三个不同地区,最初扩增到的3份病毒含量较高的阳性病料为模板,参照Ku等[5]所使用的全基因扩增引物和反应条件进行全基因序列扩增,胶回收PCR扩增正确的条带,将胶回收产物连接至pMD18-T载体,转化至感受态细胞DH5α中,涂板到LB(Amp)平板,挑取单个菌落扩大培养,用质粒提取试剂盒提取质粒,将酶切正确的重组质粒送往昆明硕擎生物公司测序。
1.7 序列分析 利用DNAStar中的MegAlign对测序获得的PCV3全基因序列与参考序列进行同源性分析,用MEGA7.0软件对测序拼接后的PCV3全序列构建遗传进化树,参考序列信息见表1。
表1 参考序列Table 1 Reference sequence
2 结果
2.1 反应条件的优化 通过优化PCR反应体系及反应程序,得到最佳的PCR反应体系:HiFi Mix 12.5 μL、DNA模板1 μL、上、下游引物各0.5 μL、ddH2O 10.5 μL,共25 μL。由图1知,最佳退火温度为56℃,PCR反应条件为:95℃预变性5 min;94℃变性30s,56℃退火30s,72℃延伸40s,共35个循环;72℃延伸5 min。
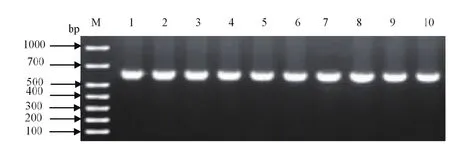
图1 PCV3 PCR扩增结果Fig.1 PCR amplification results of PCV3
2.2 敏感性试验 将PCV3质粒模板作10倍梯度递减稀释后,分别取1 μL稀释后的质粒作为模板,按照建立的PCR反应条件扩增,在凝胶成像系统上观察电泳结果,见图2。用所建立的检测方法能检测到稀释10-9倍、浓度为1.256×10-6ng/μL的质粒,提示所建立的检测方法具有较高灵敏性。
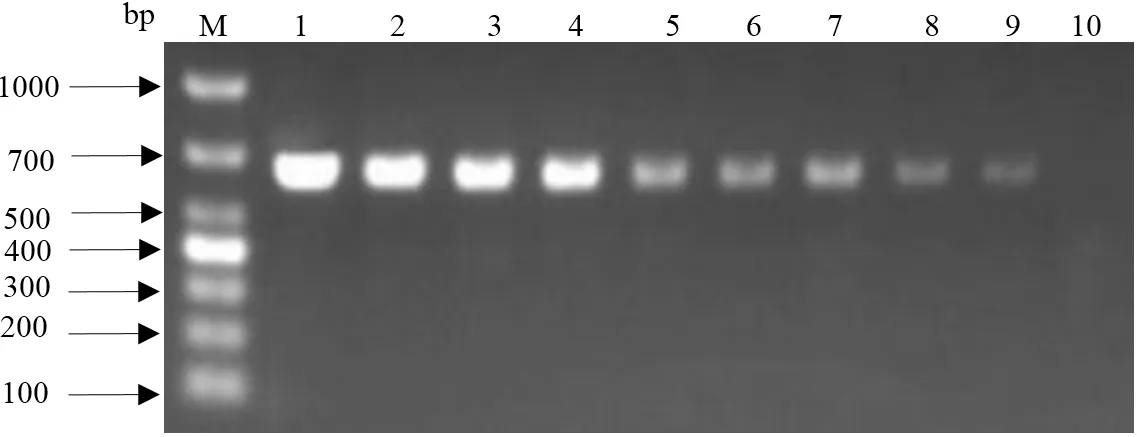
图2 敏感性试验结果Fig.2 Sensitivity test results
2.3 特异性试验 用所建立的检测方法检测5种常见的动物疫病病原体,只有PCV3在约650 bp处扩增出预期片段,PRRSV、PCV1、PCV2、HPS扩增结果均为阴性,表明所建立的检测方法有较好的特异性,见图3。

图3 特异性试验结果Fig.3 Specific test results
2.4 不同地区样品检测结果 对采集的样品进行PCR扩增,结果显示,云南省12个地市29个县(区)中,8个地(市)12个县(区)检测出PCV3阳性样品,地市阳性率66.67%,县(区)阳性率41.37%;431份样品中检测PCV3阳性样品43份,阳性率为9.98%,在采集的血液、组织、精液、粪便中均能检测到PCV3,其中组织检出率最高,为22.09%(19/86),结果见表2。
2.5 全基因序列的扩增 以部分PCV3阳性样品为模板,使用全基因扩增引物和优化后反应条件进行全基因序列扩增,分别在1275 bp和1075 bp处扩增出预期片段,见图4。将胶回收产物连接至pMD18-T载体,转化至感受态细胞DH5α中,挑取单个菌落扩大培养,用质粒提取试剂盒提取质粒,将酶切正确的重组质粒送至昆明硕擎生物公司测序。
2.6 全基因序列分析 测序获得3株PCV3全基因序列,并将其分别命名为YN0526CX1、YN0626CX2和YN81011CX3,与PCV3参考序列的同源性为98.6%~99.5%。利用MEGA 7.0软件对3株PCV3云南流行毒株全序列与国内外参考毒株进行序列比对并构建遗传进化树。结果显示,3株云南流行毒株形成一个小的分支,和国外毒株如意大利毒株(MF805722)、巴西毒株(MF079254)等及国内毒株江西毒株(KY075989)、广东毒株(MF589105)等均处于一个大分支上,属于PCV3a基因型。

图4 基因序列扩增结果Fig.4 Amplification of whole gene sequence

图5 PCV3基因组遗传进化分析Fig.5 Phylogenetic analysis of PCV3 genome
3 讨论
自2015年在美国不同地区猪场中检出PCV3以来[2,9],我国辽宁等多个省市猪群中检测到了PCV3,提示PCV3在国内外已呈现逐渐流行趋势,有必要进一步关注PCV3可能给规模化猪场带来的风险。本研究针对PCV3设计了一对特异性检测引物,并对反应条件进行优化以获得最佳反应条件;敏感性结果显示,建立的检测方法能够检测到浓度为1.256×10-6ng/μL标准品质粒;特异性结果显示,与4种常见的猪源病原体均无交叉感染,表明成功建立了PCV3的PCR检测方法。

表2 云南省不同地区样品检测结果Table 2 Detection in different areas of Yunnan province
Ku等[5]对中国安徽、福建等11省222份样品的检测结果表明PCV3阳性率为34.7%,某养殖场PCV3阳性率高达68.6%,同时还存在PCV2和PCV3混合感染。孙明等[10]对北京地区临床表现为繁殖障碍和患呼吸系统疾病的猪只进行PCV3调查表明,PCV3在猪群中普遍存在,阳性率为30.1%。本研究中云南省的12个地市29县(区)中,8个地(市)12个县(区)均检测出PCV3阳性样品,地(市)阳性率66.67%,县(区)阳性率41.37%,431份样品中检测PCV3阳性样品43份,阳性率为9.98%,提示该病在云南省多个地区感染和流行。在采集的血液、组织、精液和肝门拭子样品中均能检测到PCV3,提示PCV3可以通过不同的传播途径散毒;公猪精液中检测出PCV3阳性率为11.11%,进一步证实了PCV3通过精液垂直传播的风险很高[5,11-12]。
PCV3全基因组包含2 kb核苷酸,通过对PCV3全基因组及部分基组序列进化分析表明,我国PCV3包括2个亚群,PCV3a和PCV3b,其中PCV3b和美国参考PCV3毒株处于同一分支,具有很近的同源进化关系[11,13]。本研究获得的3株云南流行毒株之间氨基酸位点变异程度不大,与参考序列同源性较高;遗传进化分析显示,3株云南流行毒株在同一小分支上,并且和江西分离毒株(KY075989)亲缘关系最近,和国外毒株如意大利毒株(MF805722)、巴西毒株(MF079254)等及国内毒株上海毒株(KY8652431)、广东毒株(MF589105)等均处于一个大分支上属于PCV3a基因型;和美国毒株(KT869077)、瑞典毒株(MG765473)、福建毒株(KY075986)、河北毒株(KY778777)处于不同分支,亲缘关系较远。由于PCV3在云南多个地方发现,感染呈流行趋势,因此有必要进一步在云南省进行PCV3的分子流行病学调查,分析评估PCV3在多种病毒混合感染和繁殖障碍性疫病中所扮演的角色,并提出防控对策。
