FLCN在子宫颈鳞癌组织中的表达及其对子宫颈鳞癌SiHa细胞增殖及凋亡的影响
2020-03-02张煜杨佩芳陈霞栾晓瑾颜一丹于骏
张煜,杨佩芳,陈霞,栾晓瑾,颜一丹,于骏
(江苏大学附属医院妇产科,江苏 镇江 212001)
FLCN基因于2002年从Birt-Hogg-Dube综合征(Birt-Hogg-Dube syndrome,BHD)患者中克隆获得,其定位于17号染色体短臂(17p11.2)[1]。FLCN结构和功能高度保守,在多种生命过程中都发挥重要作用[2]。目前研究发现,FLCN基因在遗传性肾癌中发挥抑癌基因作用[3]。但是FLCN基因在子宫颈鳞癌中的致病机制仍不明确。本研究通过改变人子宫颈鳞癌SiHa细胞系中FLCN表达水平,探讨FLCN与子宫颈鳞癌的关系,及其对SiHa细胞增殖与凋亡的影响。
1 材料与方法
1.1 材料
1.1.1 研究对象 选取2017年12月至2018年11月于江苏大学附属医院妇科诊治的27例子宫颈鳞癌患者(子宫颈鳞癌组)和27例因妇科良性肿瘤行全子宫切除术者(对照组)。其中,子宫颈鳞癌组平均年龄(53.72±9.63)岁,对照组平均年龄(48.48±7.45)岁。所有患者均未接受任何抗癌治疗,标本均经病理证实。排除标准:鳞癌之外其他病理类型的子宫颈癌,合并内外科基础疾病,伴有其他恶性肿瘤疾病及服用特殊药物者,排除家族有遗传性疾病、特别是遗传性肾癌者。所有患者签署知情同意书,并经本院伦理道德委员会同意。
1.1.2 标本处理 对照组和子宫颈鳞癌组宫颈组织标本离体后立即用0.9%生理盐水冲洗去除血渍,剪成1~2 cm3,分成2份,其中1份于-80 ℃保存,用于实时荧光定量PCR(qRT-PCR);另1份立即行甲醛固定,送至江苏大学附属医院病理科,制成蜡块,经4 μm连续切片后行免疫组化检测。
1.1.3 主要试剂和仪器 子宫颈鳞癌SiHa细胞系(美国ATCC细胞库);Trizol试剂、反转录试剂盒、荧光定量PCR试剂盒(日本TaKaRa公司);qRT-PCR引物序列、兔抗FLCN多克隆抗体(生工生物公司);胎牛血清、DMEM、DPBS(南京福麦斯生物技术有限公司);Opti-MEM(美国Gibco公司);FLCN-eGFP(北京中原合聚经贸有限公司);FLCN siRNA(吉玛基因公司);磷酸化组蛋白H3(PH3)一抗(美国Cell Signaling Technology公司);cy3标记抗兔IgG(H+L)荧光二抗(美国Jackson公司);CCK-8细胞增殖试剂盒及TUNEL凋亡细胞检测试剂盒(诺唯赞公司)。
实时PCR仪(QuantStudio®5为美国Thermo公司);荧光显微镜(日本Olympus公司)。
1.2 组织实验
1.2.1 qRT-PCR检测宫颈组织FLCN mRNA表达 将收集的组织标本移至用液氮预冷的研钵中,研磨匀浆,加入Trizol试剂提取组织总RNA,反转录为cDNA。qRT-PCR总反应体系10 μL,包括SYBR Premix ExTaqⅡ 5 μL,上、下游引物各0.2 μL,cDNA模板0.4 μL,其余部分用灭菌双蒸水补充。循环参数:预变性95 ℃ 2 min,PCR扩增95 ℃ 15 s,60 ℃ 20 s,72 ℃ 60 s,共40个循环。以GAPDH作为内参,采用2-ΔΔCt方法计算目的基因相对表达水平。引物序列如下,FLCN上游引物:5′-CCTCCTCTCTCTCAGGCTGT-3′,下游引物:5′-TGTATGGGATGATGCGGACG-3′;GAPDH上游引物:5′-ACCCAGAAGACTGTGGATGC-3′,下游引物:5′-TTCAGCTCAGGGATGACCTT-3′。实验重复3次。
1.2.2 免疫组化SP法检测子宫颈组织中FLCN蛋白表达 蜡块标本经4 μm连续切片,烘片机中烘片30 min,常规脱蜡水化、抗原修复、去除内源性过氧化物酶、血清封闭处理。加兔抗人FLCN 抗体(1 ∶200),PBS代替一抗作为阴性对照,4 ℃孵育过夜;羊抗兔IgG(1 ∶200)室温孵育30 min;PBS洗3次,DAB显色及苏木精复染。乙醇脱水干燥,中性树胶封片,显微镜下观察拍片。
FLCN表达主要位于细胞核及细胞质,阳性表达呈棕黄色或棕褐色颗粒,阴性对照组中无着色。参考文献[4-5]免疫组化评分标准,根据着色细胞百分比及细胞着色深浅分别计分判定结果:阳性细胞百分比<10%为0分,10%~29%为1分,30%~49%为2分,≥50%为3分;细胞着色深浅:不着色为0分,浅棕色为1分,棕黄色为2分,深棕色为3分。两项得分相乘即为综合评分。
1.3 细胞实验
1.3.1 细胞培养 SiHa细胞采用含10%胎牛血清、青霉素(100 μg/mL)、链霉素(100 μg/mL)的DMEM,在37 ℃、含有5%CO2培养箱内进行孵育,细胞呈贴壁生长。隔天换培养基,每2 d或待细胞密度达到70%以上传代,取对数生长期的细胞进行后续实验。
1.3.2 RNA干扰 细胞分为阴性对照组(转染阴性对照siRNA)和实验组(转染FLCN siRNA-630)。转染前将SiHa细胞按1.5×105个/mL接种于6孔板,待细胞生长至汇合度达80%左右进行转染,操作按脂质体LipofectamineTM2000试剂说明书进行。siRNA序列如下,阴性对照 siRNA:正义链5′-ΜΜCΜCCGAACGΜGΜCACGΜTT-3′,反义链5′-ACGΜGACACGΜΜCGGAGAATT-3′;FLCN siRNA-630:正义链5′-GGGUGAGCAGGCGGAAGAATT′,反义链5′-UUCUUCCCGCCUGCUCACCCTT-3′。
1.3.3 瞬时转染 细胞分为空白对照组(转染空白质粒)和实验组(转染FLCN-eGFP质粒)操作同“1.3.2”。转染6 h后换为完全培养基,48 h后行qRT-PCR。
1.3.4 qRT-PCR检测SiHa细胞FLCN mRNA表达量 弃上述对照组及实验组SiHa细胞培养液,PBS清洗1次,每10 cm2加入1~2 mL Trizol试剂,移液器反复吹吸直至裂解液中无明显沉淀,提取组织总RNA后反转录为cDNA。qRT-PCR总反应体系及操作引物序列同“1.2.1”。
1.3.5 免疫荧光检测PH3蛋白表达 将上述对照组及实验组SiHa细胞转染24 h后,转种于放置有圆形玻片的24孔板内,继续培养24 h后进行免疫荧光实验。4%低聚甲醛固定20 min;含0.1% TritonX-100的PBS清洗3次,每次10 min;5%牛血清白蛋白封闭30 min;加入PH3一抗室温孵育1 h;含0.1% TritonX-100的PBS清洗3遍;cy3标记抗兔IgG(H+L)荧光二抗室温孵育1 h;含0.1% TritonX-100的PBS清洗,去除多余二抗;加入100 μL 1.0 mg/mL的Hoechst33342染DNA 15 min;防荧光淬灭剂封片;用荧光显微镜采集SiHa细胞免疫荧光图片,每幅图像取3个不同视野,并根据阳性细胞率进行分析。
1.3.6 CCK8检测细胞增殖 将上述对照组及实验组转染后SiHa细胞用不含EDTA的胰酶消化;接种于96孔板,每孔细胞数为2.5×103个;分别于转染后0 h、6 h、24 h、48 h加入10 μL CCK-8溶液,于孵箱内避光孵育1 h;酶标仪测定450 nm处光密度值,间接反映活细胞数量,每个样本做3个复孔。
1.3.7 TUNEL法检测细胞凋亡 将转染24 h后上述对照组及实验组SiHa细胞,接种于放置有圆形玻片的24孔板内,继续培养24 h后进行TUNEL检测。根据试剂盒操作说明进行试验,荧光显微镜下观察细胞凋亡数并拍照。用ImageJ记录凋亡细胞数,对结果进行统计分析。
1.4 统计学方法

2 结果
2.1 宫颈组织中FLCN mRNA和蛋白表达
子宫颈鳞癌组宫颈组织中FLCN mRNA表达明显低于对照组(t=4.49,P<0.05)。免疫组化结果显示,对照组宫颈组织中FLCN蛋白主要表达于细胞核及细胞质,表达强度较强;而子宫颈鳞癌组宫颈组织中FLCN蛋白主要表达于细胞质和细胞膜,表达强度较弱,见图1。两组间FLCN蛋白表达水平比较,FLCN在子宫颈鳞癌组中表达明显低于对照组,差异有统计学意义(Z=7.04,P<0.01)。

图1 FLCN mRNA和蛋白在两组子宫颈组织中的表达
2.2 RNA干扰或转染质粒后SiHa细胞中FLCN mRNA相对表达量
siRNA干扰后,SiHa细胞内FLCN mRNA表达量相对于对照组降低约70%(t=6.64,P<0.05);qRT-PCR结果显示,转染FLCN-eGFP质粒48 h后,FLCN mRNA表达较空白对照组显著升高(t=9.34,P<0.05),见图2。

图2 SiHa细胞中FLCN mRNA相对表达水平
2.3 FLCN siRNA促进SiHa细胞增殖,抑制SiHa细胞凋亡
与对照组相比,FLCN siRNA-630组中PH3蛋白阳性细胞数增多(t=4.47,P<0.05)。CCK-8检测结果显示,与对照组相比,FLCN siRNA-630组细胞450 nm处光密度值在6 h、24 h及48 h 均明显高于对照组(P均<0.01),见图3,由此表明,细胞增殖能力增强。与对照组相比,FLCN siRNA-630组TUNEL阳性细胞数明显减少(t=5.21,P<0.05),见图4。
2.4 FLCN过表达抑制SiHa细胞增殖,促进SiHa细胞凋亡
与对照组相比,FLCN过表达组中PH3蛋白阳性细胞数明显减少(t=12.35,P<0.01)。CCK8检测结果显示,与对照组相比,FLCN过表达组细胞450 nm处吸光度值在6 h、24 h及48 h均明显低于对照组(P<0.05或<0.01),见图5,表明细胞增殖能力减弱。与对照组相比,FLCN过表达组TUNEL阳性细胞数明显增多(t=59.55,P<0.01),见图6。

a:P<0.05,与同时间点阴性对照组比较

图4 转染FLCN siRNA-630后对SiHa细胞凋亡的影响
3 讨论
FLCN基因是目前已知的唯一同时与各类肾细胞癌有关的基因[6]。FLCN除了与遗传性肾癌密切相关外,还与结肠肿瘤[7]、嗜酸性腮腺瘤[8]和甲状腺肿瘤[9]等相关。本研究结果显示,在子宫颈鳞癌组织中,FLCN mRNA及蛋白表达水平均低于正常宫颈组织,表明FLCN参与子宫颈癌的发展。
肿瘤细胞增殖和凋亡由细胞内外多个信号通路共同参与完成,其调控机制失常是导致肿瘤发生和发展的重要因素之一[10]。Hasumi等[11]研究发现,在小鼠肾脏细胞中,干扰FLCN蛋白表达可促进细胞增殖。本研究结果显示,下调SiHa细胞中FLCN mRNA表达,PH3蛋白阳性细胞数增加;反之上调FLCN mRNA表达,PH3蛋白阳性细胞数减少,由此提示FLCN可抑制SiHa细胞增殖。凋亡是细胞正常程序性死亡过程,是调节机体细胞数量的一种生理机制,凋亡失衡是导致癌症发生的重要原因,而癌细胞的过度增殖对肿瘤的发展与恶化有促进作用[12]。本研究结果显示,下调SiHa细胞中FLCN mRNA表达,TUNEL蛋白阳性细胞数减少;反之上调FLCN mRNA表达,TUNEL蛋白阳性细胞数增加,由此提示FLCN可促进SiHa细胞凋亡;这与Piao等[13]针对小鼠肺泡上皮细胞研究结果一致。

a:P<0.05,b:P<0.01,与同时间点空白对照组比较
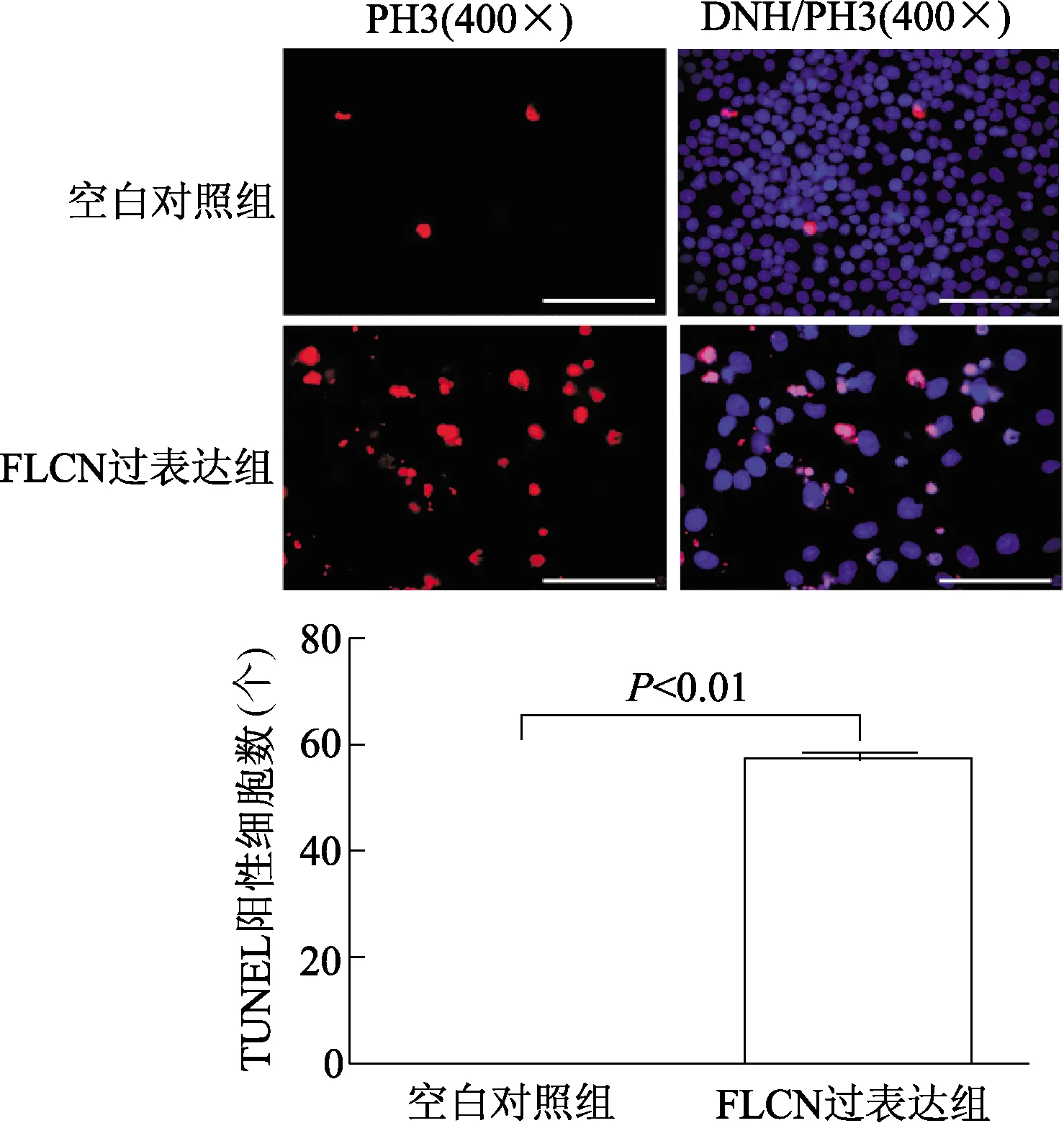
图6 转染FLCN质粒后对SiHa细胞凋亡的影响
综上所述,FLCN基因可抑制SiHa细胞增殖,促进细胞凋亡,说明FLCN是子宫颈鳞癌的抑癌基因。但本研究仅从体外实验研究细胞的增殖及凋亡,有一定的局限性,且其内在的具体分子机制尚不明确,还需要更多的研究来阐述。
