敲减cGAS基因对人食管鳞癌细胞TE-1增殖、迁移和凋亡的影响
2020-03-02王云帆戴东方傅聪陈德玉
王云帆,戴东方,傅聪,陈德玉
(1.江苏大学医学院,江苏 镇江 212013;2.江苏大学附属医院放疗科,江苏 镇江 212001)
环鸟苷酸-腺苷酸合成酶(cyclic guanosine monophosphate-adenosine monophosphate synthase,cGAS)是一种DNA传感器,在DNA识别领域有重要意义[1]。cGAS能够识别异常存在于细胞质内的双链DNA,催化生成环鸟腺苷酸(cyclic GMP-AMP, cGAMP),随后结合并激活STING蛋白,通过干扰素调节因子3(IRF3)和TANK结合激酶1(TBK1)促进Ⅰ型干扰素(IFN)表达发挥抗病毒作用[2]。越来越多的证据表明cGAS在抗病毒免疫、肿瘤发生、自身免疫性疾病中发挥了重要作用[3-5]。但对于实体肿瘤中cGAS如何影响肿瘤生物学行为及分子机制却少有研究。
食管癌是世界范围内最常见的肿瘤之一,在我国发病人数超过了全世界的50%[6]。我国90%以上的食管癌病理类型是食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)[7]。虽然手术、放疗、化疗等三大主要治疗方法都在进步,但食管癌的5年生存率仍不高[8]。cGAS既是DNA受体,也是一种酶类,它可以与药物小分子特异性结合,也许能成为抗肿瘤药物的作用靶点。本研究利用免疫组化分析了60例食管鳞癌患者的癌组织与癌旁组织中cGAS的表达情况;使用慢病毒转染食管鳞癌细胞株TE-1,构建稳定敲减cGAS基因的TE-1细胞系,探索敲减cGAS对细胞增殖、迁移和凋亡等生物学行为的影响。
1 材料与方法
1.1 材料
1.1.1 组织标本 收集2018年7月至12月在江苏大学附属医院胸外科手术切除且经病理证实的60例食管鳞癌标本,患者均签署知情同意书。所有入选患者术前均未行抗癌治疗。取癌组织与癌旁组织进行甲醛固定及石蜡包埋切片。
1.1.2 质粒与细胞 包装慢病毒的质粒pLKO.1 TRC 克隆载体、pMD2.G和psPAX2,HEK-293T、Het-1A、TE-1、KYSE-150细胞由本实验室保存。HEK-293T细胞用含有10%胎牛血清(Gibco公司)的 DMEM 培养基(Gibco公司)培养;Het-1A、TE-1、KYSE-150细胞用含10%胎牛血清的1640培养基(Gibco公司)培养。
1.1.3 主要试剂与仪器 cGAS、β-肌动蛋白、HRP标记的山羊抗兔 IgG抗体购自CST公司;CCK8试剂购自日本同仁公司;凋亡检测试剂盒购自福麦斯生物技术有限公司;质粒小提试剂盒购自天根生化科技有限公司。
1.2 方法
1.2.1 免疫组织化学染色观察食管鳞癌组织中cGAS表达 将石蜡包埋的食管鳞癌组织切片常规脱蜡,水化,抗原修复,3%过氧化氢孵育培养,加入1 ∶250稀释的cGAS一抗4 ℃孵育过夜。阴性对照用磷酸盐缓冲液(PBS)代替一抗孵育。HRP山羊抗兔二抗室温孵育后DAB显色,苏木素复染,脱水后封片。两名病理医师在显微镜下随机挑选5个视野(×200倍)观察,cGAS表达强度评分如下,① 阳性染色细胞百分比:阳性细胞的比例<5%为0分,5%~20%为1分,21%~50%为2分,51%~75%为3分,76%~100%为4分;② 染色强度:无显色为0分,浅棕色为1分,棕色为 2 分,深棕色为 3 分。若两项评分的乘积≥6分则定义为cGAS高表达,若两项评分的乘积<6分则定义为低表达。
1.2.2 实时荧光定量PCR检测cGAS mRNA表达水平 提取Het-1A、TE-1、KYSE-150细胞以及cGAS敲减和空载对照TE-1细胞总RNA,测RNA样品浓度和纯度,使得D(260 nm/280 nm)在1.8 ~ 2.0间。反转录得到cDNA。引物序列如下:cGAS上游引物5′-CACGAAGCCAAGACCTCCG-3′,下游引物5′-GTCGCACTTCAGTCTGAGCA-3′;β-肌动蛋白上游引物5′-ACTCTTCCAGCCTTCCTTCC-3′,下游引物5′-CGTACAGGTCTTTGCGGATG-3′。反应条件:95℃ 2 min预变性;95 ℃ 15 s 变性,60 ℃ 20 s 退火/延伸,40个循环。采用2-△△Ct法计算cGAS的mRNA相对表达量。
1.2.3 蛋白质印迹检测食管鳞癌细胞cGAS蛋白的表达 分别取Het-1A、TE-1、KYSE-150细胞,以及cGAS敲减和空载对照TE-1细胞各2×106个,用RIPA裂解细胞,提取蛋白质,BCA试剂盒蛋白定量。SDS-PAGE电泳后,恒流转膜2 h,脱脂奶粉封闭1 h,4 ℃ cGAS抗体(1 ∶1000)孵育过夜,TBST洗膜3次,每次10 min。HRP标记的山羊抗兔二抗(1 ∶5 000)室温孵育1 h,TBST洗膜3次,每次10 min。蛋白显像并重复3次实验。
1.2.4 慢病毒包装及感染TE-1细胞 设计cGAS基因的敲减靶序列1:CTTTGATAACTGCGTGACATA,靶序列2:GATGCTGTCAAAGTTTAGGAA,将对照组空载质粒pLKO.1 TRC克隆载体、cGAS敲减的质粒与pMD2.G和psPAX2共转染至HEK-293T,36 h后收集上清病毒液。取1×106个处于对数生长期的TE-1细胞种于6孔板中,贴壁后血清培养基1.75 mL、病毒液750 μL和聚凝胺20 μg混合感染TE-1细胞,10 h后换正常培养基。感染48 h后,以流式分选将GFP阳性细胞收集后培养。使用荧光显微镜观察细胞转染阳性率。分别命名稳定敲减TE-1细胞为sh1-cGAS、sh2-cGAS。
1.2.5 CCK8检测敲减cGAS后TE-1细胞的增殖 取稳定敲减和对照细胞消化计数,按每孔5 000个细胞接种在96孔板中,每组设3个复孔,于24、48和72 h检测。检测前每孔加10 μL CCK8,37 ℃、5% CO2培养箱中4 h后酶标仪450 nm测定光密度,绘制生长曲线。
1.2.6 克隆形成实验检测敲减cGAS后TE-1细胞的增殖 取稳定敲减和对照细胞按每孔300个细胞接种在6孔板中,每组设3个复孔。完全培养基连续培养14 d,定期换液后,弃培养基,用甲醇固定15 min,随后结晶紫染色15 min,用PBS轻轻漂洗3次。拍照后用Image J软件计克隆数分析。
1.2.7 细胞划痕实验检测敲减cGAS后TE-1细胞的迁移 将稳定敲减和对照细胞接种至24孔板,取5×105个细胞均匀铺入,人工划笔直的划痕约2 mm,划痕后0 h、24 h拍照,重复3次实验。
1.2.8 Transwell实验检测敲减cGAS后TE-1细胞的迁移 无血清培养基重悬稳定敲减和对照细胞。调整细胞密度至2×105/mL。500 μL 含10%胎牛血清的完全培养基加入小室下部,小室上部加入100 μL细胞悬液,细胞培养箱中培养24 h。取出小室,用棉签擦去残留在上室内的细胞,甲醇固定细胞15 min,0.1%结晶紫染色20 min,镜下随机选取5个视野,计数穿膜细胞数。
1.2.9 流式细胞术检测敲减cGAS后TE-1细胞的凋亡 将稳定敲减和对照细胞种入6孔板,每孔5×105个细胞,每组细胞设置3个复孔。过夜贴壁24 h使用Annexin V/PI双染后进行流式检测,使用Flowjo分析数据。
1.3 统计学分析

2 结果
2.1 cGAS在食管鳞癌组织中的表达
免疫组化结果显示,cGAS主要在食管鳞癌的细胞胞质中表达,呈现为棕黄色颗粒。在食管鳞癌组织中,有39例(65%)cGAS呈现高表达;21例(35%)cGAS呈现低表达。在癌旁组织中,cGAS均呈现为低表达甚至阴性。见图1。
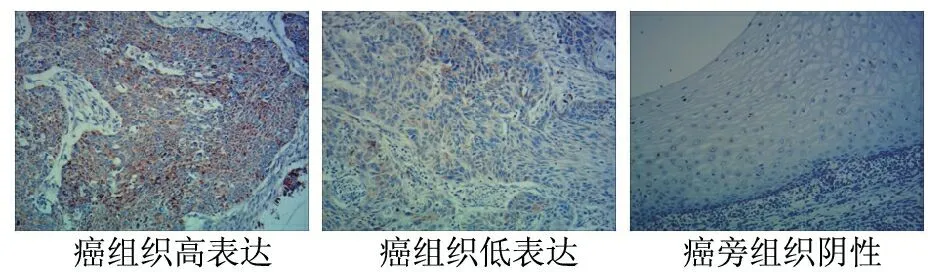
图1 cGAS在食管鳞癌组织中的表达(免疫组化×200倍)
2.2 cGAS在食管鳞癌细胞中的表达
实时定量PCR结果显示,食管鳞癌细胞系TE-1、KYSE-150中cGAS mRNA的表达明显高于食管正常上皮细胞Het-1A(t值分别为10.35、6.86,P<0.01,图2A);蛋白质印迹结果显示TE-1、KYSE-150细胞cGAS蛋白表达高于Het-1A(图2B)。
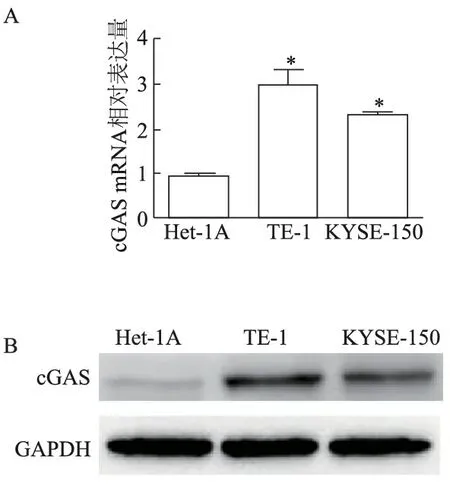
A:荧光定量PCR;B:蛋白质印迹;*:P<0.01,与Het-1A细胞比较
图2 cGAS在食管正常上皮细胞和食管鳞癌细胞系中的表达
2.3 重组慢病毒质粒细胞感染及cGAS敲减的鉴定
选取cGAS表达量高的细胞系TE-1,将对照空载体病毒和敲减cGAS病毒分别感染TE-1细胞后72 h,流式分选收集GFP阳性细胞培养,传代3次,在荧光显微镜观察,可见各组细胞GFP阳性率均在90%以上。荧光定量PCR结果显示,sh1-cGAS、sh2-cGAS细胞cGAS mRNA均明显降低(t分别为6.46、5.96,P<0.01)。蛋白质印迹结果亦表明敲减后TE-1细胞cGAS蛋白表达降低。结果表明成功构建了稳定的sh1-cGAS、sh2-cGAS细胞系。见图3。
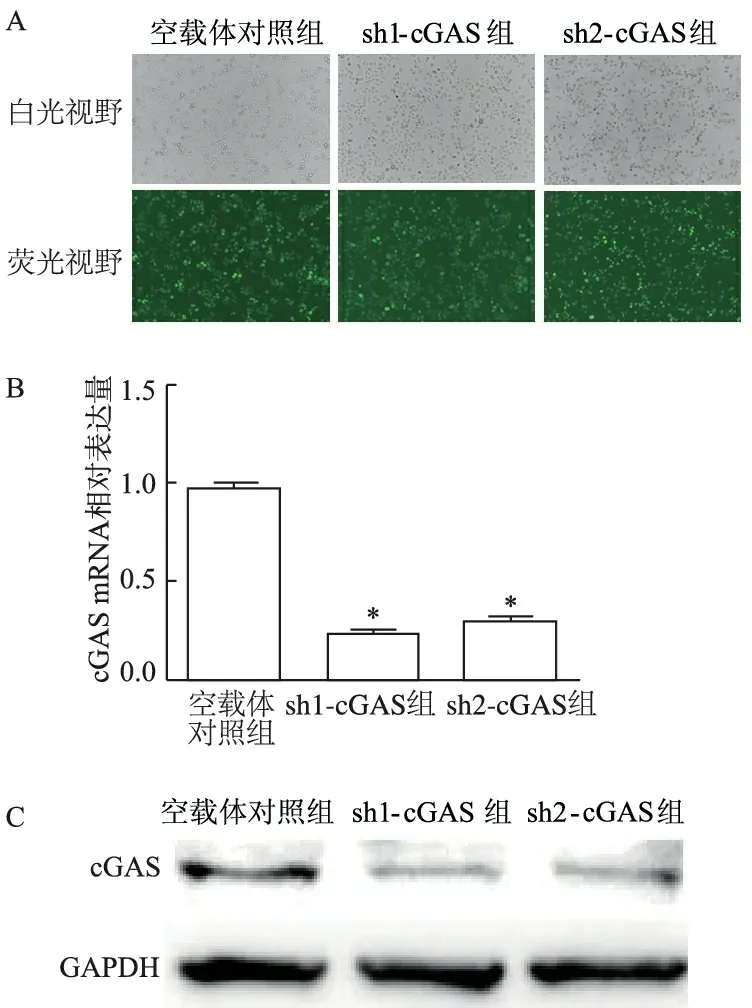
A:荧光转染效率(×200倍);B:荧光定量PCR;C:蛋白质印迹;*:P<0.01,与空载体对照组比较
图3 验证TE-1细胞中cGAS敲减效果
2.4 敲减cGAS对TE-1细胞增殖能力的影响
取食管鳞癌细胞TE-1稳转细胞系sh1-cGAS、sh2-cGAS,CCK8增殖实验显示,敲减组细胞增殖较对照组显著抑制(P<0.01,图4)。克隆形成实验表明,sh1-cGAS、sh2-cGAS组克隆形成数目较对照组明显降低(t分别为27.02、21.19,P<0.01),见图5。
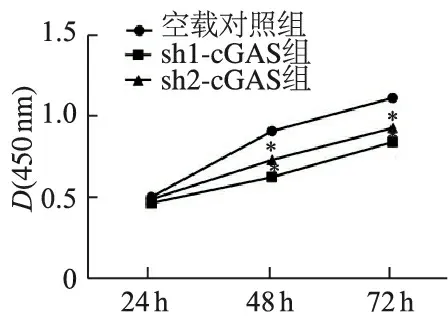
*:P <0.01,与空载体对照组比较
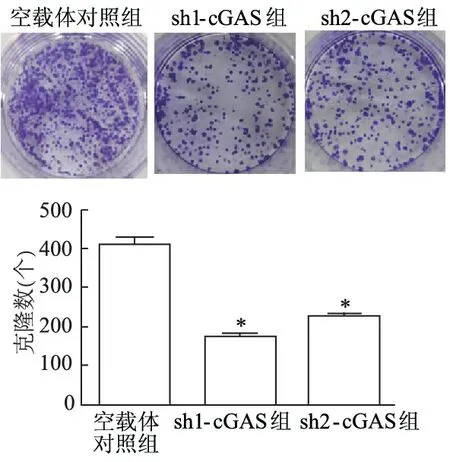
*:P<0.01,与空载体对照组比较
2.5 敲减cGAS对TE-1细胞迁移能力的影响
细胞划痕和Transwell迁移实验结果显示,sh1-cGAS、sh2-cGAS组伤痕愈合率明显降低(t分别为10.55、5.74,P<0.01),穿膜细胞数量明显减少(t分别为11.46、8.59,P<0.01)。见图6和图7。
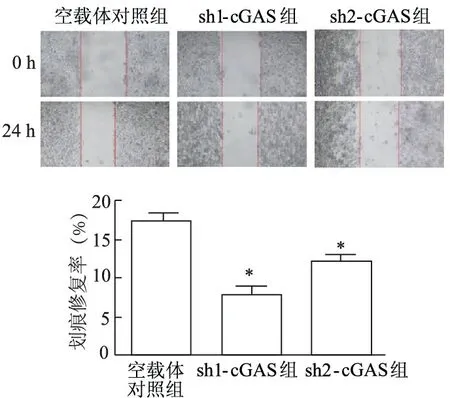
*:P<0.01,与空载体对照组比较
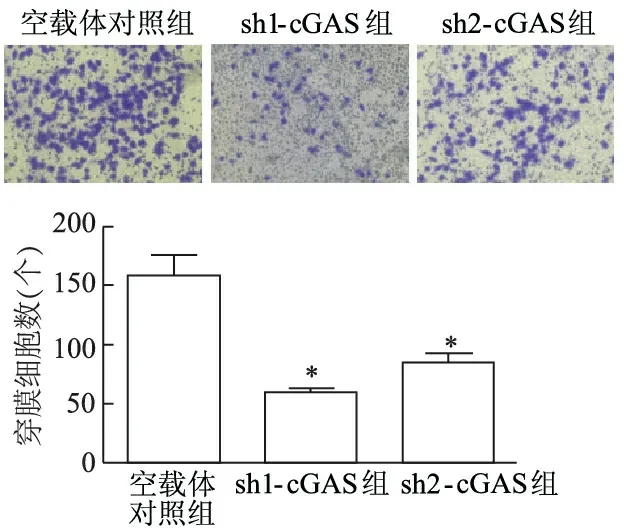
*:P<0.01,与空载体对照组比较
2.6 敲减cGAS对TE-1细胞凋亡的影响
流式细胞术检测结果显示,sh1-cGAS、sh2-cGAS组TE-1细胞早期凋亡和晚期凋亡细胞所占百分比较对照组明显增加(t分别为16.16、11.68,P<0.01),见图8。
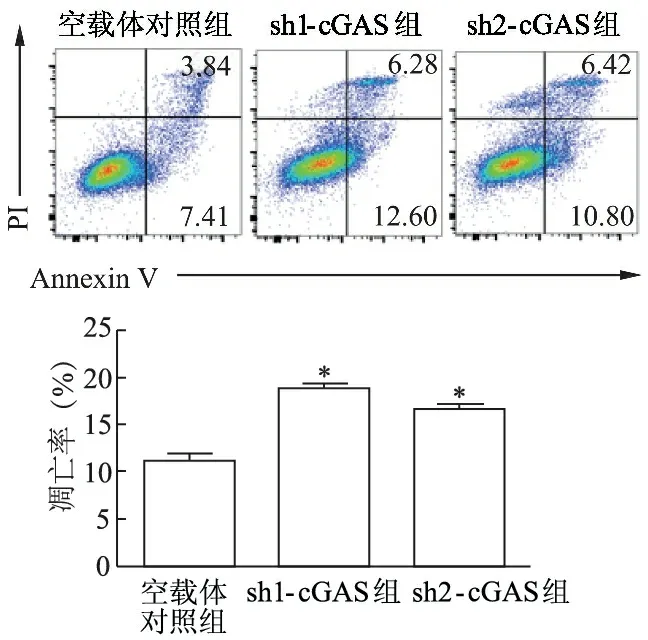
*:P<0.01,与空载体对照组比较
3 讨论
基因组不稳定性是导致肿瘤发生发展的关键因素,通过同源重组准确修复DNA双链断裂可以保留基因组完整性并抑制肿瘤发生,cGAS是一种胞质DNA传感器,可通过启动STING-IRF3-Ⅰ型IFN信号传导级联来激活先天免疫[1,9]。以往的研究大多集中于探索cGAS在固有免疫细胞中的功能与调节机制,近年来的研究也发现其在肿瘤细胞中发挥了一定的调节作用。cGAS在细胞质内可结合因损伤而积累的双链DNA,进而激活下游的cGAS-STING信号通路,并最终促进包括促炎因子在内的多种基因表达,将MHC-Ⅰ分子结合肽呈递在肿瘤细胞表面,使肿瘤细胞可被CD8+T细胞识别[10],进而促进了抗肿瘤免疫的功效。也有研究表明肿瘤放射线处理后可以通过cGAS-STING途径诱导细胞表面PD-L1表达的上调,进而改变肿瘤微环境并抑制肿瘤杀伤性T细胞的功能[11]。本研究结果显示,cGAS在食管鳞癌组织中的表达较癌旁组织明显升高,且进一步在永生化的食管鳞癌细胞系和食管正常上皮细胞中对应地证明了这一点,提示其在食管鳞癌中可能发挥了调节功能。
最近的研究表明,在肿瘤细胞发生DNA损伤的情况下,cGAS会进入到细胞核中,并被招募至DNA双链断裂部位,并直接与组蛋白变体γH2AX发生直接相互作用,进而参与断裂DNA的同源重组与损伤修复。对应的,过度表达的cGAS增加了体外肿瘤细胞的恶性潜能,而肺癌细胞中敲除cGAS后减少了小鼠中形成的肿瘤体积[4,12]。本研究中cGAS敲减后显著抑制了食管鳞癌细胞的增殖与迁移能力,且敲减的细胞凋亡明显增加。我们推测cGAS可能作为一种新的癌基因促进肿瘤的发生发展,因此cGAS可作为癌症治疗新的潜在分子靶点[13-14]。但是cGAS在食管鳞癌细胞中是否也参与了DNA的损伤修复还有待进一步的实验来确定。后续我们将进一步扩大临床样本,深入地研究cGAS在食管鳞癌中的调节功能与相关的分子机制,并评估cGAS与临床食管鳞癌治疗效果和预后的关系。
