微小RNA在自身免疫性甲状腺疾病中的研究进展
2020-03-02丁祥梅彭辉勇柳迎昭
丁祥梅,彭辉勇,柳迎昭
(江苏大学附属人民医院 1.内分泌科,2.检验科,江苏 镇江 212002)
自身免疫性甲状腺疾病(autoimmune thyroid disease, AITD)是免疫介导的一组器官特异性自身免疫疾病,其中Graves病(Graves′ disease, GD)和桥本甲状腺炎(Hashimoto′s thyroiditis, HT)为两种主要的临床分型[1]。尽管GD的主要临床表现是甲状腺亢进而HT主要表现为甲状腺功能减退,但两者均以甲状腺淋巴细胞浸润和甲状腺自身抗体的产生为特征,可能与特定易感基因、环境暴露的复杂以及多因素相互作用有关,导致自身耐受性受到破坏和而后自身免疫性疾病的发展[1-3]。
近年来多项研究[3-5]表明,微小RNA(miRNA)参与肿瘤、自身免疫性疾病等多种疾病的发病。本文将综述miRNA在AITD中的研究新进展。
1 miRNA简介
miRNA是一类内源性非编码小RNA分子,由18~25个核苷酸组成,参与调控人类近1/3的基因,因此在大多数生理和病理过程中起着至关重要的作用,包括细胞生长和分化,新陈代谢,癌症以及自身免疫等[2-5]。miRNA通过与其对应的靶基因结合从而沉默或降解目标mRNA,转录后水平负性调节基因表达,但是,miRNA对靶基因的调控受多种因素影响,包括与靶基因结合位点及其作用方式、Dicer 酶剪切位点等[5]。研究发现一种miRNA能够调控数个甚至数百个靶基因,而一些基因也会被数个miRNA同时调控[5-6]。近年来多项研究[3-4]发现,miRNA调控多种机体生物学功能,如细胞增殖、分化,细胞凋亡,炎症和免疫反应等。
2 miRNA与免疫细胞
免疫细胞主要在机体抵抗病原体感染、清除突变细胞及维持免疫稳态中发挥作用,其中包含淋巴细胞、树突状细胞(dendritic cells, DC)、中性粒细胞、自然杀伤细胞等。大量研究[5-7]发现,miRNA参与各类免疫细胞的增殖、分化及活化等一系列过程。
2.1 miRNA与Th细胞
CD4+T细胞是T淋巴细胞的主要亚群,其在抗原和共刺激信号作用下分化成不同类型T细胞,包括辅助性T细胞(T helper cell, Th)和调节性T细胞(regulatory T cell,Treg),前者如Th1细胞、Th2细胞、Th17细胞等;这些Th细胞亚群能够分泌各种不同的细胞因子,进而参与细胞和体液免疫应答[7-8]。
胰岛素受体底物(insulin receptor substrate-1, IRS-1)是IRS家族成员之一,作为胞内重要的信号转导中间体,IRS-1主要功能是连接细胞表面激活受体传递的跨膜信号和下游效应器,该信号蛋白与ERK、AKT及NF-κB信号传导途径密切相关[9]。早期研究[10-11]发现,IRS-1与代谢性疾病的发生和肿瘤产生紧密相关。近来研究发现,IRS-1在T细胞活化中发挥重要作用[12]。miR-126位于EGFL7内含子内,在血管、心脏、肺的内皮细胞中高表达。Chu等[13]发现,miR-126敲除小鼠CD4+T细胞的活化、增殖及干扰素γ水平均显著高于野生型小鼠,进一步研究发现miR-126的靶基因IRS-1在miR-126缺陷的CD4+T细胞中表达上调,同时伴有ERK,AKT和NF-κB信号途径的转导改变。由此可见,敲除miR-126后IRS-1信号通路激活促进CD4+T细胞活化,同时促进向Th1细胞分化。
Th1细胞主要产生IFN-γ,介导细胞免疫应答,其主要转录因子是T细胞中表达T盒转录因子(T-box expressed in T cell,T-bet)。miR-92a属于miR-17-92簇,也称为oncomiR-1,miR-17-92簇是位于13号染色体(13q31-Q32)长臂C13orf25基因座的第三内含子中的miRNA簇,其在自身免疫疾病患者体内异常表达[14]。Rezaei等[15]在自身免疫性脑脊髓炎模型小鼠的研究中发现,miR-92通过靶向调节TSC1或DUSP10表达促进Th1细胞分化(图1)。促炎型Th1细胞大量存在于炎症组织中,参与风湿性疾病中慢性炎症反应;Bardua等[16]研究发现,miR-31通过TCR-趋化因子受体-整合素信号传导在下游的肌动蛋白细胞骨架重排中调控基因表达,从而降低促炎性Th1细胞的运动性;抑制miR-31表达可增加反复活化的Th1细胞的迁移活性。此外,T-bet和FOXO1分别为T细胞受体介导的miR-31表达的正调节剂和负调节剂[17],三者构成促炎性Th1细胞迁移的调控网络(图1)。
Th17细胞是一群分泌IL-17的T细胞亚群,其在诱导炎症反应和自身免疫性疾病中发挥一定作用,Th17细胞的经典调控途径为IL-6/转化生长因子β(transforming growth factorβ, TGF-β)/视黄酸相关孤独核受体(retinoid-related orphan receptor gammat, RORγt)途径,此外还有IL-21/TGF-β/RORγt途径和IL-23/IL-22扩增途径等[14]。多项研究[18-21]表明,miR-326负向调控Ets-1进而促进Th17细胞分化,继而参与系统性红斑狼疮、多发性硬化等自身免疫性疾病的发生。Zhao等[20]在碘致甲状腺炎的小鼠模型中发现,miR-326抑制Ets-1表达并促进Th17细胞分化,同时miR-326抑制剂能够促进Th17细胞产生和Ets-1蛋白表达(图1)。miR-146a是免疫调节中的重要调控因子,多项研究[22-26]表明其参与多种自身免疫性疾病。miR-146a可以通过靶向调节TRAF 6、IRAK 1和STAT 1等间接调控一系列信号通路,共同阻止CD4+T细胞产生促炎性Th1和Th17反应,并诱导T细胞介导自身免疫[24-25]。Li等[26]研究发现,miR-146可以阻断自分泌的IL-6和IL-21诱导的自身反应性CD4+T细胞的Th17分化途径,从而参与自身免疫病的发生发展。Wu等[27]研究发现,miR-10a在炎症性肠病炎症黏膜中表达降低,其机制是抑制IL-12/IL-23p40和NOD2表达,从而阻断Th1/Th17细胞的免疫反应,进而降低炎症反应。
2.2 miRNA与Treg细胞
CD4+CD25+FoxP3+Treg细胞在维持机体对自身抗原的免疫应答和抑制,以及宿主的过度免疫应答中发挥着重要的作用,其细胞功能主要依赖于叉头样螺旋转录因子的表达,分泌TGF-β、IL-10、IL-35等免疫性细胞因子,参与免疫耐受机制的建立。有研究发现[28],多种自身免疫性疾病与效应T细胞的功能失调有关。在功能上,Th1和Th2细胞在转录因子水平上互相抑制,Th17和Treg细胞类似地相互制约[29]。Treg细胞对AITD起保护作用,Treg细胞耗竭可促进实验性自身免疫性甲状腺炎的发生,在多个AITD患者和甲状腺炎动物模型研究[30-32]中,检测到Treg细胞数目减少和(或)功能缺陷。miR-210可通过与Foxp3的3′-UTR区域结合,抑制Foxp3核酸和蛋白表达,继而减弱Treg免疫抑制功能[33](图1)。Hiratsuka等[34]报道,与健康对照组相比,GD患者中miR-210水平增加约3倍。Zheng等[23]发现,GD患者血清miR-210水平较高,其与甲状腺大小呈正相关,与Foxp3表达呈负相关,同时GD患者中Foxp3表达较健康对照组降低。由此表明,GD患者体内miR-210水平增高可能通过靶向抑制Foxp3表达,继而削弱Treg细胞功能,从而参与GD发生发展。
2.3 miRNA与DC
DC是机体最重要的抗原提呈细胞,参与T细胞免疫应答。Hoye等[35]在自身免疫性脑脊髓炎小鼠模型中发现,miR-31可直接抑制IL-34表达,而IL-34是小胶质细胞存活以及维持血脑屏障完整性的关键组成部分,同时发现miR-31在通过血脑屏障的骨髓来源的DC中异常表达,表明在炎症过程中,miR-31可能起着调节DC通过血脑屏障转运的作用。由此说明,在自身免疫性脑脊髓炎小鼠模型中,miR-31可能通过调节DC进入中枢神经系统从而参与多发性硬化等中枢神经系统自身免疫性疾病的发病。Huang等[36]研究发现,miR-34a过表达的小鼠体内常规DC和浆细胞样DC增加,进一步探索发现miR-34a可促进浆细胞样DC分化为常规DC和浆细胞样DC,而不影响DC的增殖和凋亡;同时发现miR-34a过表达的DC中TCF1表达量显著下调及RORγt表达量上调,而WNT/β-catenin/TCF1通路调节中枢和外周免疫系统中的T细胞功能。上述发现表明,miR-34a/WNT/TCF1通路可能参与DC细胞对T细胞的分化调控。
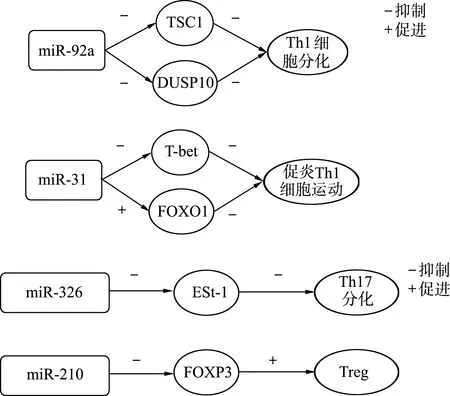
图1 免疫细胞中miRNA调节
在miRNA的免疫机制研究中,不仅可以关注miRNA在免疫细胞中信号通路,也可以把某些miRNA作为疾病的检测指标。
3 miRNA与AITD
AITD 是一种常见的自身免疫性疾病,主要包括GD和HT两种疾病。近年来,大量研究[37-39]发现,miRNA在AITD患者异常表达(表1),在AITD的发生发展中发挥作用。

表1 AITD中miRNA的异常表达[37-44]
注:↑表示miRNA在AITD中相对于健康对照组上调,↓表示miRNA在AITD中相对于健康对照组下调
3.1 miRNA异常表达在GD发病中的作用
GD是AITD中最常见的一种疾病,以弥漫性甲状腺肿和甲亢为特征。GD患者体内miRNA变化可能在GD的发病机制中起作用。Chen等[37]对未经治疗GD患者研究发现,GD患者甲状腺组织、外周血单个核细胞、血清中let-7b相对表达水平较健康对照组相比显著上调,同时发现let-7b与GD的临床指标促甲状腺激素受体抗体水平呈高度相关,进一步研究发现,let-7b可能靶向调控PLZF,而PLZF是属于BTB/POZ家族的转录因子,通过将多蛋白复合物募集到调节基因元件而发挥作用,从而阻止促甲状腺激素受体的产生,进而影响促甲状腺激素受体抗体的产生,参与GD发生发展。
Chen等[38]通过对23例GD患者,其中11例为缓解期GD患者,24例为健康对照者的血清进行研究分析,发现miR-346表达在GD患者中下调,其靶基因Bcl-6恰好相反,同时miR-346过表达致CD4+CXCR 5+T细胞功能减弱。GD患者血清miR-346水平与CD4+CXCR5+T细胞百分率呈负相关[39]。此外,GD患者外周血CD4+T细胞中miR-346表达水平与血清中促甲状腺素受体抗体、抗甲状腺过氧化物酶抗体、抗甲状腺球蛋白抗体等水平呈负相关。miR-346通过抑制滤泡辅助T细胞的阳性调节因子Bcl-6进而调控CD4+CXCR5+T细胞(图2),从而参与GD的发病过程。
Yamada等[40]发现GD患者血清miR-16水平显著高于健康受试者。Caselli等[41]发现,在通过HHV-6 A诱导AITD期间,HHA-6V感染的T淋巴细胞诱导miR-16显著增加。上述研究表明miR-16可能在AITD发病机制中起重要作用,但具体机制尚需进一步研究。
Qi等[42]在GD患者的CD4+T细胞中发现miR-4443直接抑制TRAF4表达,进而通过NF-κB途径诱导CD4+T细胞因子异常分泌和增殖。TRAF4是TRAF超家族的成员之一,与其他成员不同,其可以负调节免疫信号传导,其与NOD2、TRAF6以及TRIF相互作用以抑制NF-κB活化;同时发现,初发GD患者中的miR-4443异常表达与FT3、FT4、TRAB呈高度相关[42],由此可见,miR-4443可能通过负向调控TRAF4从而参与GD的发病过程。
3.2 miRNA异常表达在HT发病中的作用
HT是AITD中另一种较常见的疾病。Zhao等[6]通过对100例HT患者及健康对照组进行检测发现,HT患者外周血中miR-205,miR-20a-3p,miR-375,miR-296,miR-451和miR-500a 6种miRNA表达水平明显高于健康者;其中miR-451,miR-375和miR-500 a 3种miRNA与促甲状腺激素水平相关,而miR-20a-3p与甲状腺球蛋白抗体(Thyroglobulin antibody,TgAb)水平相关;miR-451异位表达可能通过caspase-3依赖的方式降低细胞活力,促进细胞凋亡,也参与HT患者体内细胞凋亡的外部途径;同时发现血浆中miR-375和miR-500a高表达与TSH水平呈负相关,miR-20a-3p与TgAb水平呈负相关[6]。miR-375,miR-500a,miR-20a-3p在HT患者中的作用机制尚不明确,尚需进一步对miRNA靶基因及功能分析。
miR-142是造血特异性分子之一,在造血细胞分化成熟中发挥重要作用,其有miR-142-5p和miR-142-3p两种成熟形式,其中miR-142-5p主要存在于Treg细胞,在多种自身免疫性疾病进展中发挥着一定的作用[42]。Zhu等[44]通过对20例HT患者甲状腺组织标本中的miRNA进行筛选发现,miR-142-5p,miR-142-3p和miR-146均高表达,结合HT患者临床数据分析发现miR-142-5p与TgAb呈正相关;同时对HT患者的血清和滤泡上皮细胞行定量PCR分析发现,miR-142-5p相对表达量较健康者显著升高,并证实其可直接与CLDN1非编码序列结合位点结合,从而抑制CLDN1表达。CLDN1作为一种膜蛋白,属于claudin家族,是紧密连接的组成部分,可充当物理屏障,防止溶质自由通过旁细胞间隙[45]。miR-142-5p可能通过抑制CLDN1表达从而破坏细胞旁屏障,使自身抗原如TPO、TG等被免疫系统识别[42]。因此,miR-142-5p可能通过CLDN1参与HT的发生。
Peng等[46]发现,HT患者外周血中miRNA-125a-3p相对表达量较健康者明显降低,同时IL-23R mRNA水平升高,且与TgAb水平呈负相关;进一步研究发现,miR-125a-3p与IL-23受体3′-UTR结合从而抑制IL-23受体表达(图2)。IL-23对维持Thl7细胞的存活和增殖起重要作用,其主要通过IL-23受体发挥对细胞的调控作用[47],可见IL-23受体对Thl7细胞的调节发挥关键作用。上述结果提示miR-125a-3p可能通过影响IL-23受体表达调控Th17细胞功能,从而参与HT的发生发展。
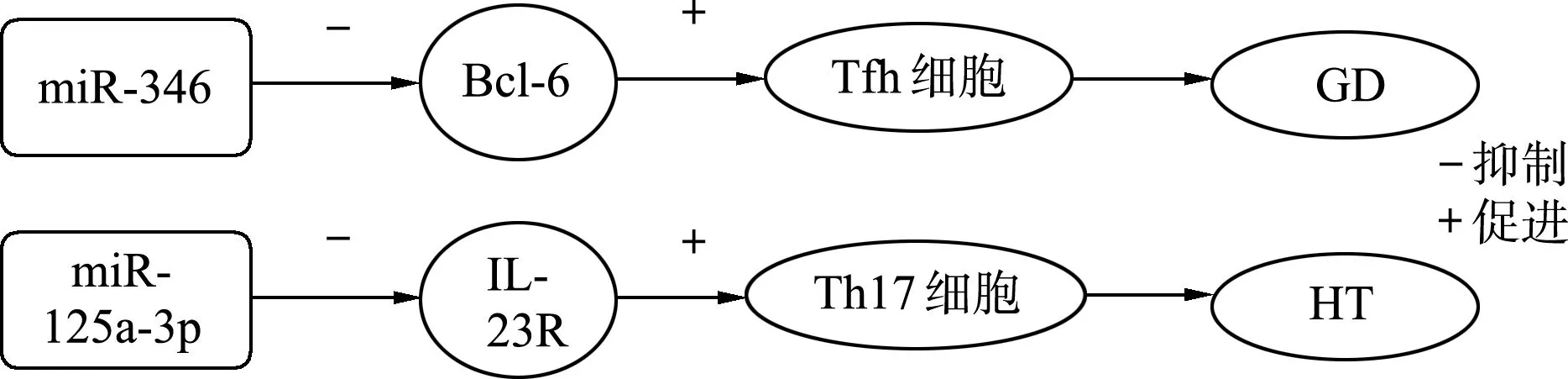
Tfh细胞:滤泡辅助T细胞
4 展望
综上所述,miRNA通过各种调控通路影响免疫细胞增殖、分化以及凋亡,同时miRNA还可以通过调控不同的信号通路来影响免疫细胞的数量和功能,参与自身免疫性疾病的发病,未来可通过对miRNA靶基因的鉴定和功能分析,分析免疫细胞的过度免疫和免疫功能缺损的分子机制,解释自身免疫性疾病的发病机制。
