CXCL12-CXCR4轴促进胶质母细胞瘤前神经-间质转化
2020-03-02许学文宋廉杨晓晓石卉龚爱华王鸣张礼荣
许学文,宋廉,杨晓晓,石卉,龚爱华,王鸣,张礼荣
(1.江苏大学附属医院影像科,江苏 镇江 212001;2.江苏大学医学院,江苏 镇江 212013)
胶质母细胞瘤(glioblastoma, GBM)是成人最常见的原发性脑肿瘤,中位生存期为12~15个月,5年生存期低于5%[1]。尽管GBM的放疗、化疗及其他辅助治疗对改善患者的生存期具有一定的效果,但其复发率仍然较高[2]。当前基于基因表达图谱将GBM分为4个亚型:前神经型(33%)、神经型(12%)、经典型(20%)及间质型(32%)[3];其中间质型具有恶性程度高、预后差的特点,且前神经型具有间质型转化的特征,即前神经型-间质型转化(proneural-mesenchymal transition, PMT)[4],然而其确切的分子机制仍不是十分清楚。
趋化因子及其受体在胶质瘤发生、发展中的机制已成为目前研究的热点[5]。CXC趋化因子受体4(CXC chemokine receptor 4,CXCR4)属于趋化因子受体CXCR亚家族,CXC趋化因子配体-12(CXC chemokine ligand 12,CXCL12)是其唯一配体,CXCL12-CXCR4轴在促进干细胞归巢、诱导血管生成及肿瘤侵袭转移等方面具有重要的作用[6]。但是,CXCL12-CXCR4轴在胶质瘤中的作用尚不完全清楚,本研究拟探讨CXCL12-CXCR4轴在胶质母细胞瘤PMT中的作用。
1 材料与方法
1.1 主要材料
人胶质瘤LN428,U87MG细胞株(中国科学院上海生命科学研究院);CXCL12(美国Genscript公司);普乐沙福(美国 MedChem Express公司);高糖DMEM、PBS(美国Hyclone公司);澳洲胎牛血清(美国Gibco公司);兔单克隆抗体N-钙黏蛋白、E-钙黏蛋白、几丁质酶-3样蛋白-1(chtinase-3-like-1 protein,CHI3L1/YKL-40)、波形蛋白、β-微管蛋白(美国Cell Signaling Technology公司);鼠单克隆抗体少突胶质细胞转录因子2(oligodendrocyte lineage transcription factor 2,OLIG2),羊抗兔二抗,羊抗鼠二抗(美国Santa Cruz公司);基质胶、Transwell小室(美国Corning Incorporated公司);ECL发光液(美国Millipore公司);牛血清白蛋白(德国 BioFroxx公司);CCK8试剂盒(日本Dojindo公司)。
1.2 细胞培养
人胶质瘤LN428、U87MG细胞株均培养于含10%胎牛血清的高糖DMEM,置于37℃、5%CO2培养箱中,细胞生长至80%~90%融合时用0.25%胰蛋白酶消化传代。
1.3 免疫印迹实验检测细胞前神经型和间质型相关蛋白
1.3.1 选择CXCL12在细胞中最佳作用浓度 取对数生长期细胞,0.25%胰蛋白酶消化重悬,接种入6孔板,每孔培养基补足至2 mL,于37℃、5%CO2培养箱中观察;次日细胞贴壁后,观察细胞状态良好,细胞接种密度为60%~70%;将细胞分为CXCL12不同浓度(0、20、40、60、80、100 ng/mL)处理组,共培养48 h后收集各组细胞;预冷PBS清洗,立即加入蛋白裂解液提取总蛋白,100℃煮沸10 min;4 ℃行12 000×g离心10 min,上清液即为蛋白样品。以每个泳道20 μg蛋白样品上样,行10%变性SDS-PAGE;将蛋白转移至PVDF膜;5%牛血清白蛋白室温封闭30 min;加入一抗4℃摇床孵育过夜,TBST洗膜3次,每次5 min;加入二抗室温摇床孵育1 h;TBST洗膜3次,每次5 min;ECL 发光试剂显影,在凝胶成像系统上曝光并使用Image J软件对蛋白条带进行定量分析,与内参β-微管蛋白比较。一抗N-钙黏蛋白、E-钙黏蛋白、波形蛋白、YKL-40、β-微管蛋白稀释比均为1 ∶1 000、一抗OLIG2的稀释比为1 ∶500;二抗稀释比均为1 ∶10 000。每组实验独立重复3次。根据蛋白表达量选择CXCL12最佳作用浓度。
1.3.2 检测普乐沙福对细胞前神经型和间质型相关蛋白的影响 将细胞分为对照组,CXCL12组,普乐沙福组,CXCL12+普乐沙福组,分别予以PBS,80 ng/mL CXCL12,20 μmol/L普乐沙福,80 ng/mL CXCL12+20 μmol/L普乐沙福处理。采用免疫印迹法检测相关蛋白的表达。具体实验操作方法同“1.3.1”。每组实验独立重复3次。
1.4 Transwell实验检测细胞迁移和侵袭能力
取对数生长期细胞,0.25%胰蛋白酶消化重悬,接种入6孔板,每孔培养基补足至2 mL,于37℃、5%CO2培养箱中培养;次日细胞贴壁后,观察细胞状态良好,细胞接种密度为60%~70%。将细胞分为对照组,CXCL12组,CXCL12+普乐沙福组,分别予以PBS, 80 ng/mL CXCL12,80 ng/mL CXCL12+20 μmol/L普乐沙福处理。共培养48 h后收集各组细胞。在侵袭实验前,小室上层铺100 μL 1 ∶20稀释的基质胶,置于细胞培养箱,待胶凝固后备用。迁移实验无须铺胶。将3×104个胶质瘤细胞用100 μL无血清高糖DMEM重悬置于小室上层,小室下层加入500 μL含10%胎牛血清的高糖DMEM。将小室置于37℃、5%CO2培养箱中培养14 h;4%低聚甲醛固定30 min;用棉签轻轻拭去小室内面细胞;用0.1%结晶紫染色液浸染30 min,风干后置于显微镜下观察并拍照;运用Image J软件计算穿膜细胞数。每组实验独立重复3次。
1.5 CCK8法检测细胞增殖率
制得单细胞悬液,以1 000个/孔密度接种于96孔板;次日细胞贴壁后,实验分组同“1.4”,同时设空白组(只含DMEM)进行校正,每组设3个复孔。按说明书要求,每天加入10 μL CCK8试剂,放置培养箱中孵育2 h,用酶标仪测定450 nm处的光密度值。以培养时间为横轴,相对增殖率为纵轴,绘制细胞生长曲线。每组实验独立重复3次。
1.6 克隆形成实验检测细胞克隆形成能力
取对数生长期细胞,制备单细胞悬浮液,并以1 000个/孔密度接种于6孔板,每孔加入2 mL培养基,待细胞贴壁后,实验分组同“1.4”。每隔3至4天半换液1次,静置培养2~3周;当出现肉眼可见克隆时,终止培养;4%低聚甲醛固定30 min;0.1%结晶紫染色30 min;拍照并计算克隆数。每组实验独立重复3次。
1.7 生物信息学分析
通过Cancer Brower下载TCGA中胶质瘤患者的mRNA表达及临床相关数据,分析CXCR4 mRNA在健康者与患者以及在GBM患者不同亚型中的表达水平,进一步分析CXCR4 mRNA与CXCL12、N-钙黏蛋白、E-钙黏蛋白、波形蛋白、YKL-40、OLIG2 mRNA的相关性。以平均值为界,将高于和低于平均值分别定义为高表达组和低表达组。
1.8 统计学分析

2 结果
2.1 CXCR4在胶质瘤中的表达及病理分析
TCGA-GBM(AffyU133a)数据库样本共539例,其中健康者脑组织样本10例,脑胶质瘤组织样本529例(前神经型139例,间质型158例,经典型145例,神经型87例)。与健康者脑组织相比,脑胶质瘤组织中CXCR4 mRNA表达水平显著增高(t=7.346,P<0.01);CXCR4高表达组(n=262)胶质瘤患者总体生存率明显低于低表达组(n=262,χ2=5.056,P<0.05);CXCR4 mRNA在前神经型中表达明显低于间质型(t=10.53,P<0.01)。基因表达热图分析表明,CXCR4 mRNA与CXCL12、N-钙黏蛋白、波形蛋白、YKL-40 mRNA成正相关,与E-钙黏蛋白、OLIG2 mRNA成负相关。见图1。
2.2 选择CXCL12在胶质瘤细胞中最佳作用浓度
免疫印迹实验结果显示,不同浓度CXCL12(0、20、40、60、80、100 ng/mL)预处理后,与0 ng/mL相比,80 ng/mL CXCL12处理后细胞内OLIG2(LN428:t=14.62,U87MG:t=8.46,P均<0.05)、E-钙黏蛋白(LN428:t=18.03,U87MG:t=6.27,P均<0.05)的表达显著降低,YKL-40(LN428:t=11.02,U87MG:t=11.57,P均<0.01)、N-钙黏蛋白(LN428:t=5.83,U87MG:t=12.79,P均<0.05)、波形蛋白(LN428:t=5.30,U87MG:t=10.58,P均<0.05)的表达显著增高。综合考虑,选择80 ng/mL CXCL12作为最佳实验浓度进行后续实验。见图2。
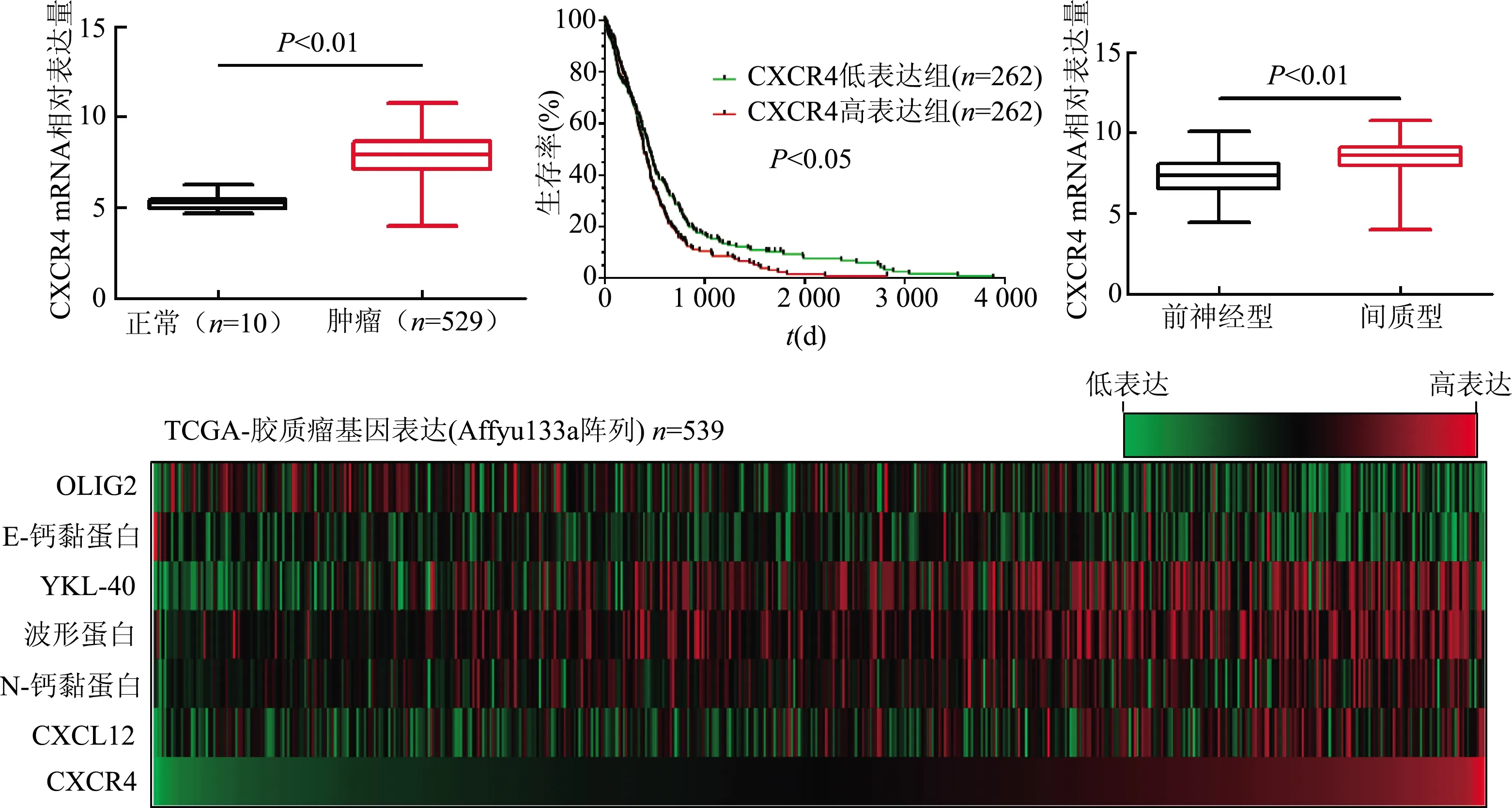
图1 TCGA胶质瘤(AffyU133a)数据库分析CXCR4 mRNA在胶质瘤中的表达
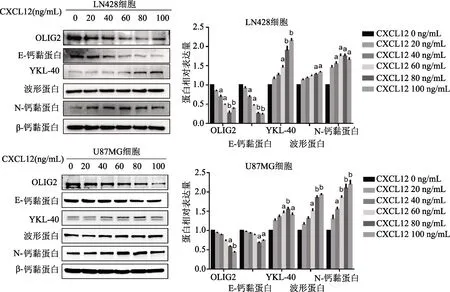
a:P<0.05,b:P<0.01,与对照组比较
2.3 CXCL12-CXCR4轴促进胶质瘤细胞PMT
免疫印迹实验结果显示,胶质瘤细胞经80 ng/mL CXCL12处理后,OLIG2蛋白表达水平较对照组显著降低(LN428:t=5.66,U87MG:t=12.53,P均<0.05),YKL-40蛋白表达水平较对照组显著上升(LN428:t=8.66,U87MG:t=15.30,P均<0.01);而经20 μmol/L普乐沙福和80 ng/mL CXCL12+20 μmol/L普乐沙福分别处理后,与CXCL12组对比,OLIG2蛋白表达水平显著升高(LN428:t=13.98,9.82,U87MG:t=16.42,10.73,P均<0.01),YKL-40蛋白表达水平显著降低(LN428:t=22.52,24.45,U87MG:t=16.38,18.40,P均<0.01)。见图3。
2.4 CXCL12-CXCR4轴促进胶质瘤细胞侵袭和迁移
Transwell结果显示,80 ng/mL CXCL12预处理48 h后,胶质瘤细胞迁移(LN428:t=11.46,U87MG:t=16.52,P均<0.01)和侵袭(LN428:t=6.03,U87MG:t=10.05,P均<0.01)数量显著多于对照组;给予普乐沙福处理后,与单纯 CXCL12组比较,细胞迁移(LN428:t=9.22,U87MG:t=11.42,P均<0.01)和侵袭(LN428:t=5.37,U87MG:t=8.53,P均<0.01)数量则显著降低。见图4。
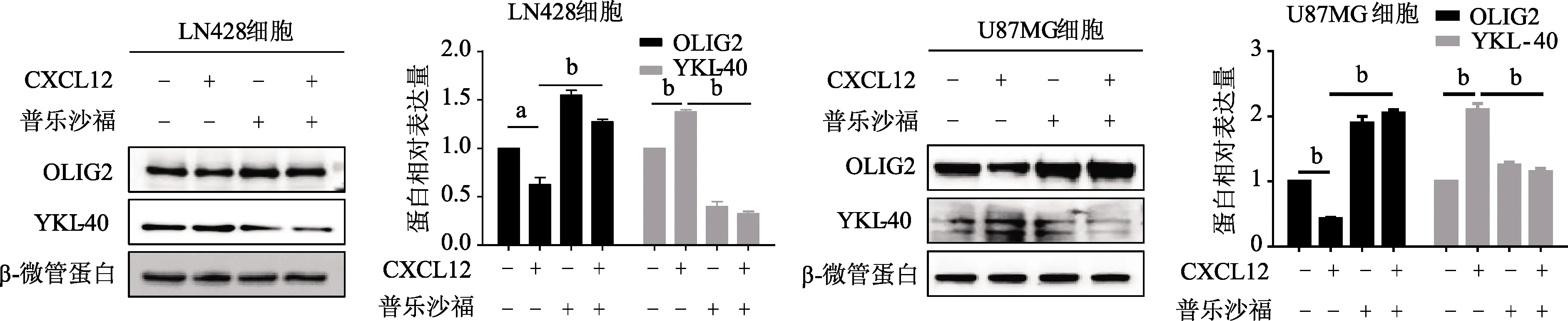
a:P<0.05,b:P<0.01
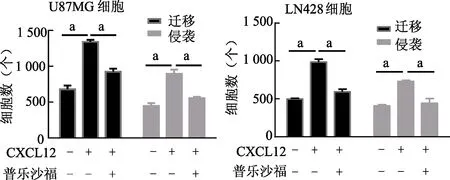
a:P<0.01
2.5 CXCL12-CXCR4轴促进胶质瘤细胞增殖
克隆形成实验显示,与对照组相比,胶质瘤LN428细胞CXCL12组形成的克隆数显著增多(t=28.46,P<0.01),加入普乐沙福后,细胞克隆数显著减少(t=35.10,P<0.01)。由于胶质瘤U87MG细胞株弥漫性生长方式导致细胞的克隆不明显,与对照组相比,CXCL12组细胞克隆数显著增多(t=10.50,P<0.01),加普乐沙福后,细胞克隆数显著降低(t=16.50,P<0.01)。此外,CCK8实验结果显示,与对照组相比,胶质瘤LN428和U87MG细胞CXCL12组细胞增殖率显著增高(LN428:t=8.28,U87MG:t=3.98,P均<0.01),加入普乐沙福后,细胞增殖率显著降低(LN428:t=8.252,U87MG:t=9.60,P均<0.01)。见图5。
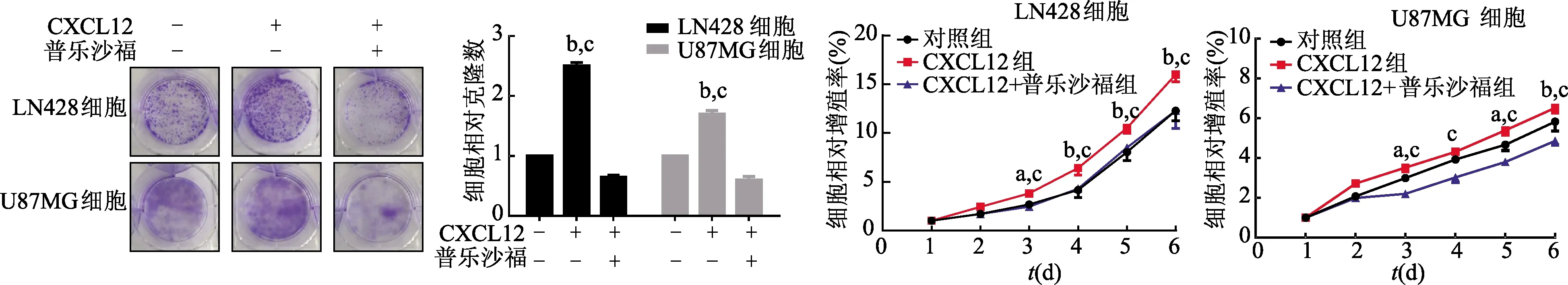
a:P<0.05,b:P<0.01,与对照组比较;c:P<0.05,与CXCL12+普乐沙福组比较
3 讨论
胶质瘤肿瘤细胞前神经型和间质型可以互相转换,并受周围微环境的精确调控[7]。CXCR4是一种高度保守的7次跨膜G蛋白偶联受体,首次在外周血白细胞中发现,在多种细胞类型中呈高表达,包括淋巴细胞、造血干细胞、基质成纤维细胞和癌细胞[8]。本研究结果显示,与健康者相比,胶质瘤患者CXCR4 mRNA表达增高,且与患者生存率呈负相关;基因表达热图结果显示,CXCR4 mRNA和CXCL12 mRNA与间质型指标YKL-40、N-钙黏蛋白、波形蛋白mRNA呈正相关,与前神经型指标OLIG2、E-钙黏蛋白mRNA呈负相关。由此表明,CXCL12-CXCR4轴可能与肿瘤恶性生物学行为有关。但是,CXCL12-CXCR4轴是否参与胶质瘤其他生物学行为,如PMT、增殖、转移等,还需进一步研究。
研究发现,PMT是胶质母细胞瘤局部浸润和转移的关键因素[9];另有研究表明,胶质瘤细胞从前神经型向间质型的转化过程中,YKL-40的升高和OLIG2的降低代表细胞向间质型转化[10]。本研究结果显示,在胶质瘤LN428和U87MG细胞中加入外源性CXCL12后,YKL-40蛋白表达显著升高,OLIG2蛋白显著降低,且细胞的侵袭、迁移能力显著增高。由此表明,CXCL12-CXCR4轴可以促进胶质瘤细胞PMT,从而增强胶质瘤局部浸润和远处转移。在抑制CXCL12-CXCR4信号传导的药物中,选择性CXCR4拮抗剂普乐沙福是研究最多、临床应用最广的化合物[11]。本研究结果显示,予以普乐沙福处理后,胶质瘤LN428和U87MG细胞的间质型相关指标YKL-40蛋白表达显著降低,前神经型相关指标OLIG2蛋白表达显著升高,且细胞的迁移和侵袭能力显著受到抑制。由此表明,普乐沙福可以阻断CXCL12-CXCR4轴,从而抑制胶质瘤细胞PMT。
研究表明,肿瘤细胞具有无限增殖的能力,最终导致恶性肿瘤形成[12]。为了进一步验证CXCL12-CXCR4轴与胶质瘤的恶性生物学行为相关,本实验进行了克隆形成实验和CCK8法检测胶质瘤细胞的增殖能力。结果显示,予以胶质瘤LN428和U87MG细胞外源性CXCL12处理,细胞的克隆形成能力和相对增殖率显著增高;普乐沙福处理后,胶质瘤LN428和U87MG细胞的克隆形成能力和相对增殖率显著降低。由此表明,CXCL12-CXCR4轴可以提高胶质瘤细胞的增殖能力,阻断CXCL12-CXCR4轴可以降低胶质瘤细胞的增殖能力。
此外,有研究发现,CXCL12依赖性刺激肿瘤细胞上的CXCR4,从而激活包括PI3K/AKT/mTOR在内的关键下游通路,参与肿瘤的生存、增殖、转移等过程[13];另有研究表明,在胶质瘤中PI3K/AKT/mTOR信号通路异常活化,抑制通路后可以有效地延长胶质瘤患者生存时间[14]。结合之前的研究,无论CXCL12-CXCR4轴在癌症中的确切机制如何,该轴在脑胶质瘤的发生进展过程中起着重要作用。CXCL12-CXCR4轴在胶质瘤细胞PMT过程中可能激活PI3K/AKT/mTOR信号通路。
综上所述,本研究利用一定浓度的CXCL12及普乐沙福作用于体外培养的胶质瘤LN428和U87MG细胞株,表明CXCL12-CXCR4轴可以促进胶质瘤细胞PMT;普乐沙福通过阻断CXCL12-CXCR4轴,可有效抑制胶质瘤细胞增殖、侵袭和迁移,具体分子机制还有待进一步研究。
