敲减lincRNA-p21的巨噬细胞对结肠癌细胞CT26生物学功能的影响
2020-03-02周李宁刘月琴苏兆亮周峰许化溪
周李宁,刘月琴,苏兆亮,周峰,许化溪
(1.江苏大学医学院免疫学研究室, 江苏 镇江 212013;2.南通市第一人民医院检验科,江苏 南通 226001;3.江苏大学第四附属医院中心实验室,江苏 镇江 212001)
巨噬细胞是一类具有较强可塑性的免疫细胞[1]。在不同的环境下,巨噬细胞可极化为具有不同表型及功能的细胞,主要包括M1型巨噬细胞和M2型巨噬细胞[2]。M1型巨噬细胞可以分泌大量的促炎因子如IL-6、IL-12、肿瘤坏死因子(TNF-α)、活性氧(ROS)和一氧化氮合酶(iNOS)等,具有很强的促炎功能,而M2型巨噬细胞可以分泌多种抑炎因子如IL-4、IL-10和转化生长因子(TGF-β)等,可促进炎症消退,具有免疫抑制功能[3]。巨噬细胞在肿瘤的发生发展中发挥着重要作用,许多研究表明在癌症早期,肿瘤发生部位的巨噬细胞大多是M1型巨噬细胞,发挥抗肿瘤作用;当疾病恶化,病变部位的巨噬细胞将转变为M2型巨噬细胞,发挥促进肿瘤增殖、侵袭及转移的作用。目前,调控肿瘤相关巨噬细胞M2型极化的具体分子机制尚不明确[4]。长链非编码RNA(long non-coding RNA, lncRNA)是一类不编码蛋白且转录本长度超过200个核苷酸的RNA分子[5]。近年来表明,lncRNA可调控细胞的分化和增殖,但能否调控巨噬细胞M2型极化尚不清楚[6]。本研究通过干扰巨噬细胞中长链基因间非编码RNA-p21(lincRNA-p21)的表达,分析其对结肠癌细胞增殖和肿瘤生长的影响,为干预肿瘤相关巨噬细胞M2型极化提供潜在的靶点。
1 材料与方法
1.1 材料
10只6~8周龄C57BL/6品系小鼠,雌性,体重(20±2)g,购于江苏大学实验动物中心(合格证编号:NO.201806076)。小鼠CT26结肠癌细胞株及RAW264.7小鼠单核巨噬细胞购于上海生命科学研究院细胞库。DMEM和胎牛血清(美国Gibco公司);反转录试剂盒、荧光定量试剂盒(日本TaKaRa公司);LipofectamineTM2000(美国Invitrogen公司);lincRNA-p21 siRNA、阴性对照(NC)siRNA(苏州吉玛股份有限公司);Annexin-V/PI凋亡检测试剂盒(杭州联科生物技术有限公司);Transwell小室(美国Corning公司);0.4 μm共培养小室(美国Millipore公司);正置荧光显微镜(日本Nikon公司);流式细胞仪(美国BD公司)。
1.2 目的基因表达水平的检测
CT26肿瘤细胞用高糖DMEM培养基(10%胎牛血清)培养,将细胞置于37℃、含5%CO2的恒温细胞培养箱中培养,当细胞生长良好,达到80%~90%汇合度时进行细胞传代。收集CT26肿瘤细胞的培养上清液,于4℃、500×g离心5 min;再用0.22 μm滤器进行过滤,-20℃保存。将RAW264.7巨噬细胞接种于24孔板内,当细胞密度至50%~60%时,分为两组:对照组和CT26肿瘤上清液刺激组。对照组常规培养,CT26上清液刺激组则加入800 μL CT26细胞培养上清液继续培养48 h。收集细胞,加入1 mL的Trizol裂解细胞,提取RNA。将RNA逆转录为cDNA后以β-肌动蛋白为内参,实时荧光定量PCR检测lincRNA-p21的表达水平。所用引物序列:β-肌动蛋白上游5′-AGCCATGTACGTAGCCATCC-3′,下游5′-GCTGTGGTGGTGAAGCTGTA-3′;IL-4上游5′-CCTCTGTGGGCTGTCTGATTTT-3′,下游5′-GGGCTCACCCAGGACCTT-3′;IL-6上游5′-TAGTCCTTCCTACCCCAATTT-3′,下游5′-TTGGTCCTTAGCCACTCCTTC-3′;IL-10上游5′-CCAA-GCCTTATCGGAAATGA-3′,下游5′-TTTTCACAGGGGAGAAATCG-3′;lincRNA-p21上游5′-CCTGTCCAC-TCGCTTTC-3′,下游5′-GGAACTGGAGACGGAATG-TC-3′。扩增反应条件为95℃预变性5 min;95℃变性10 s;60℃退火30 s;72℃延伸30 s;进行40个扩增循环;72℃再延伸10 min。待实时荧光定量PCR扩增结束后,根据反应测得的Ct值计算2-ΔΔCt值分析目的基因的相对表达量。
1.3 RAW264.7的转染
委托公司设计针对小鼠来源的lincRNA-p21的siRNA(si-lincRNA-p21)及阴性对照siRNA(NC)。转染前1天将状态良好的RAW264.7转种到24孔板中37℃、5% CO2培养24 h,使细胞汇合度达到60%~70%。转染前,配制转染复合物,同时弃去24孔板中旧的培养液,加入400 μL无血清DMEM培养液。将100 μL的混合液加入到24孔板中,37℃、5% CO2培养6 h。转染6 h后,更换培养液为含10%胎牛血清的DMEM培养液,继续培养24~48 h,再进行转染后的其他检测。
1.4 流式细胞术检测CT26的凋亡
接种CT26细胞于24孔板中,37℃、5%CO2下培养12 h,将0.4 μm共培养小室置于24孔细胞培养板内,分为两组,上室分别加入转染NC siRNA的RAW264.7和转染si-lincRNA-p21的RAW264.7,37℃、5% CO2共培养48 h。取出上室,1 mL的PBS清洗下室CT26细胞,收集两组下室CT26细胞,4℃、2 000 r/min离心5 min,弃去上清液,取100 μL缓冲液重悬细胞沉淀。每管分别加入5 μL Annexin-V-APC抗体和10 μL PI抗体,轻柔混匀,4℃避光染色15 min,最后加入400 μL缓冲液混匀细胞,于1h内上机检测。根据流式细胞术的结果,(AnnexinV-APC)-/PI+为坏死细胞,(AnnexinV-APC)-/PI-为活细胞,(AnnexinV-FITC)+/PI-为早凋细胞,(AnnexinV+FITC)+/PI+为晚凋细胞,(AnnexinV-FITC)+/PI-和(AnnexinV+FITC)+/PI+的细胞比例即凋亡细胞比例。
1.5 Transwell检测CT26细胞的迁移能力
在24孔板内接种转染NC siRNA的RAW264.7和转染si-lincRNA-p21的RAW264.7,37℃、5% CO2共培养12 h,弃去培养液,更换800 μL含10% 胎牛血清的DMEM培养液,取Transwell小室置24孔板内,计数CT26细胞,每个小室接种1.5×105个肿瘤细胞,并用200 μL无血清DMEM混匀,使肿瘤细胞均匀分布于上室,于37℃、含5% CO2的恒温细胞培养箱中培养24 h。培养结束后,取出上室,用棉签擦除小室内没有穿过微孔的细胞,再将小室置于4%多聚甲醛中固定30 min,结晶紫染色10 min,PBS洗3次,每次10 min,倒置小室待干,显微镜观察并计数穿过微孔的细胞数量。
1.6 划痕实验检测CT26细胞的迁移能力
在24孔细胞培养板下室培养CT26,每孔接种1×105个肿瘤细胞。同时将0.4 μm共培养小室放置于24孔细胞培养板,将1×105个转染后的RAW264.7均匀分布于上室,将细胞置于37℃、5% CO2的恒温细胞培养箱中培养48 h。共培养结束后,取出上室,用PBS缓冲液清洗下室肿瘤细胞后,更换下室培养液为无血清的DMEM培养液,并用小号枪头于24孔板中轻轻划出一道横线。将24孔细胞培养板置于倒置显微镜下拍照,记录划痕宽度及面积,再将细胞置于37℃、5% CO2的恒温细胞培养箱中继续培养36 h。培养结束后,用PBS缓冲液清洗下室肿瘤细胞3次,将24孔细胞培养板置于倒置显微镜下拍照,记录划痕宽度。
1.7 荷瘤小鼠模型的建立及肿瘤生长相关指标的检测
培养CT26肿瘤细胞,当细胞生长良好时,收集细胞并计数。选取12只C57BL/6小鼠,随机分为2组(n=6),用酒精棉球对其背部皮肤进行消毒,用镊子轻轻夹起其背部一侧皮肤,用1 mL注射器吸取含1×106个CT26肿瘤细胞的PBS缓冲液100 μL,注射入小鼠皮下。1×106个转染si-lincRNA-p21的RAW264.7注射于实验组小鼠的荷瘤部位,每周1次,连续4周。对照组小鼠荷瘤部位注射1×106个转染NC siRNA的RAW264.7。待可触及小鼠皮瘤肿块时,每隔3天用游标卡尺测量小鼠肿瘤块的长径及宽径。根据公式V= 1/2×a×b2(a为长径,b为短径,单位为mm)计算小鼠肿瘤块的体积。4周后处死小鼠,剥取其皮下肿瘤组织,用电子分析天平测量小鼠瘤块质量。
1.8 统计学分析
应用SPSS 16.0软件处理并进行统计学分析,两组样本间均数差异分析采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 CT26上清液刺激导致RAW264.7巨噬细胞极化
实时荧光定量PCR检测表明,与常规培养的RAW264.7(对照组)相比,CT26肿瘤上清液刺激的RAW264.7 IL-6表达明显下调(t=8.829,P<0.01);而IL-4(t=10.030,P<0.01)和IL-10的表达上调(t=8.405,P<0.01),见图1。结果提示,CT26肿瘤上清液刺激巨噬细胞后可促进巨噬细胞向抑炎的M2型极化。

图1 实时荧光定量PCR检测巨噬细胞IL-6、IL-4及IL-10的表达
2.2 CT26上清液刺激导致RAW264.7的lincRNA-p21表达上调
实时荧光定量PCR检测表明,与对照组相比,CT26肿瘤上清液刺激的RAW264.7 lincRNA-p21表达明显上调(t=5.736,P<0.01)。而转染si-lincRNA-p21后,则lincRNA-p21的表达下调(t=7.745,P<0.01),见图2。
2.3 抑制巨噬细胞lincRNA-p21的表达对巨噬细胞极化的影响
实时荧光定量PCR检测表明,与NC组相比,CT26肿瘤上清液刺激的转染si-lincRNA-p21的RAW264.7 IL-6表达明显上调(t=8.341,P<0.01);而IL-4(t=5.750,P<0.01)和IL-10的表达下调(t=6.493,P<0.01),见图3。结果显示抑制巨噬细胞lincRNA-p21的表达可促进巨噬细胞向促炎的M1型极化。

图2 实时荧光定量PCR检测lincRNA-p21的表达

图3 实时荧光定量PCR检测转染后巨噬细胞IL-6、IL-4及IL-10的表达
2.4 抑制巨噬细胞lincRNA-p21的表达对CT26凋亡和迁移的影响
Transwell小室和划痕实验结果显示,与NC组相比,转染si-lincRNA-p21的RAW264.7与CT26共培养后,其迁移能力减弱(t= 3.384,P<0.05),见图4、图5。流式细胞分析表明,与转染si-lincRNA-p21的RAW264.7共培养后,早期凋亡和晚期凋亡的CT26细胞凋亡率总和增加(t= 4.608,P<0.01),见图6。
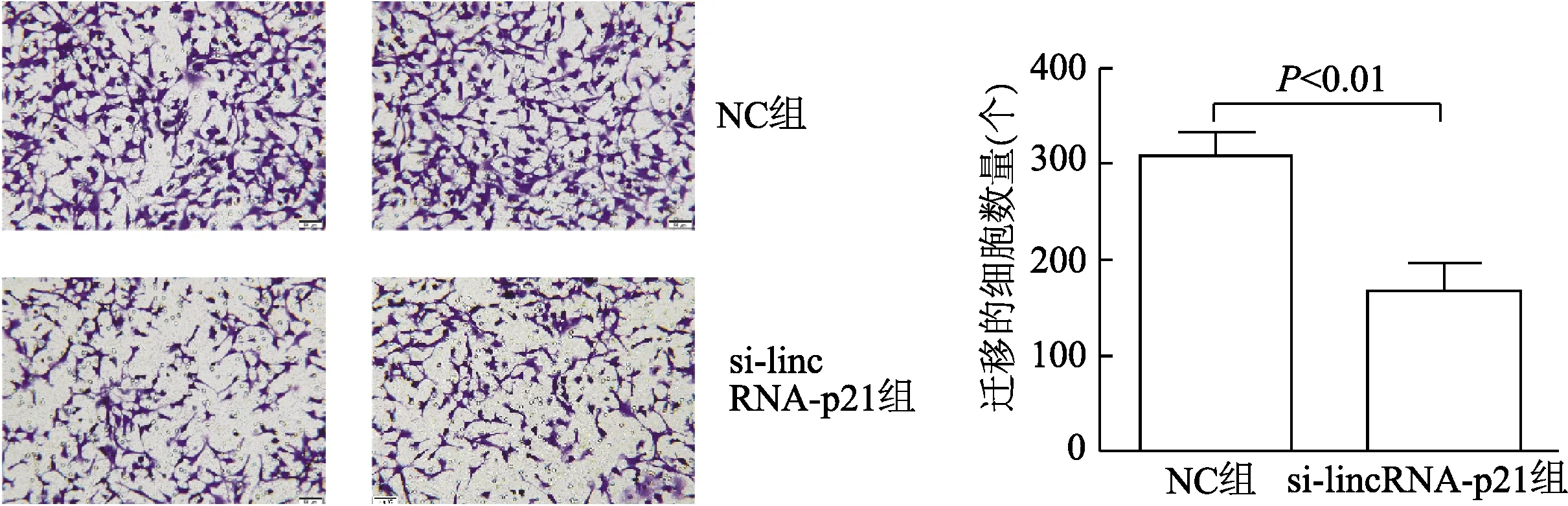
图4 Transwell检测CT26的迁移能力(结晶紫染色×100)
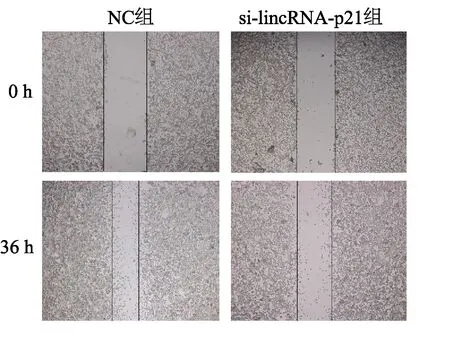
图5 划痕实验检测CT26的迁移能力
2.5 抑制巨噬细胞lincRNA-p21表达可延缓荷瘤小鼠皮下瘤的生长
与NC组相比,注射转染si-lincRNA-p21的RAW264.7的小鼠,第19、22和25天肿瘤体积明显减小(t分别为2.877、3.205、3.421,P<0.05)。4周后,肿瘤重量也明显减少(t= 3.151,P<0.05),见图7。

图6 流式细胞术检测CT26的凋亡

*:P<0.05,与NC组相比
3 讨论
肿瘤微环境包括肿瘤细胞、基质细胞、免疫细胞及细胞外基质中的非细胞成分,其中巨噬细胞不仅参与固有免疫应答,还可通过抗原提呈作用介导特异性免疫应答[7]。但是越来越多的研究表明,在癌症的中后期,巨噬细胞在肿瘤微环境的驯化下,可极化为与M2型巨噬细胞类似的肿瘤相关巨噬细胞,其抗原提呈能力减弱,进而发挥免疫抑制功能,促进肿瘤的发展及转移[8]。同时肿瘤相关巨噬细胞还分泌大量的细胞因子抑制T细胞的活性进而影响其发挥抗肿瘤免疫。此外,肿瘤相关巨噬细胞还分泌多种趋化因子,募集更多的巨噬细胞到达肿瘤部位促进肿瘤发展[9]。有研究表明,肿瘤相关巨噬细胞的数量与结肠癌的预后相关,减少肿瘤相关巨噬细胞的数量可抑制肿瘤的发展及转移[10]。
LncRNA作为一类不编码蛋白质且长度超过200个核苷酸的RNA分子,一直被认为是转录组的“噪音”,近年来大量研究表明,lncRNA具有许多生物学功能,可以调控细胞的分化和发育[11]。关于lncRNA调控巨噬细胞分化仍不明确。我们先期的研究发现,经结肠癌细胞CT26培养上清液刺激,巨噬细胞可高表达lincRNA-p21,由此推测lincRNA-p21可调控巨噬细胞向M2型转化。有文献报道,lincRNA-p21位于调节细胞周期的p21基因的上游,可调控细胞增殖、凋亡和DNA损伤,是p53的转录靶标[12]。同时lincRNA-p21也可通过募集不均一核糖核蛋白K至p21启动子处,调控p21的表达[13]。但是关于lincRNA-p21调控巨噬细胞分化还鲜见报道。本研究发现,抑制巨噬细胞中lincRNA-p21的表达后,再与结肠癌细胞共培养可促进结肠癌细胞的凋亡,同时也可抑制结肠癌细胞的迁移能力。动物实验的结果也显示,抑制巨噬细胞lincRNA-p21的表达可有效延缓荷瘤小鼠肿瘤的生长。
综上,本研究发现lincRNA-p21具有潜在调控巨噬细胞分化的功能,抑制其表达,可促进巨噬细胞发挥抗肿瘤免疫,促进肿瘤细胞的凋亡。但lincRNA-p21调控巨噬细胞发生极化和促进肿瘤细胞凋亡的机制尚不明确,仍需进一步研究。
