伤寒沙门菌不同生长期和不同应激下非编码RNA ArpH的表达
2020-03-02熊昌艳李雪娇黄新祥
熊昌艳,李雪娇,黄新祥
(江苏大学医学院,江苏 镇江 212013)
伤寒沙门菌(Salmonellaentericaserovar Typhi,S.Typhi)是沙门菌属中一种重要的人类致病菌,多种毒力基因的作用可引起轻度腹泻甚至是严重的全身性感染[1]。伤寒沙门菌在感染过程中通过调节毒力基因的表达而迅速适应环境的变化。伤寒沙门菌的致病过程很复杂,涉及相关基因的活化和抑制以适应新的环境[2]。此外,各类调节因子,双组分调节系统(two-component regulatory systems,TCSs),蛋白修饰水解酶和σ因子等均参与了致病过程[3]。近年来随着研究的深入,和大肠埃希菌一样,伤寒沙门菌已成为重要的模式生物,其对环境应答的基因表达,特别是与宿主作用的毒力因子的表达调节网络机制,已成为研究的热点。
许多非编码RNA(non-coding RNA, ncRNA)通过多种机制参与调节不同生物过程中相关基因的表达[4-5]。本实验室应用深度测序分析发现了数个细菌中的ncRNAs[6-8],其中包括与rpoHmRNA互补的顺式编码ncRNA ArpH[9]。本研究利用RNA印迹和qRT-PCR等技术,对ArpH在不同生长时期和不同应激条件下的表达、双组分调节系统和氧应激调节因子对其调控作用进行分析,以期探讨ArpH在伤寒沙门菌致病中的作用。
1 材料与方法
1.1 菌株
伤寒沙门菌GIFU 10007、ompR缺陷株(ΔompR)、rcsB缺陷株(ΔrcsB)和oxyR缺陷株(ΔoxyR)由本实验室保存。
1.2 主要试剂与材料
酵母提取物、胰蛋白胨粉(英国Oxoid公司);NaCl、NaOH、HCl、无水乙醇、异丙醇、枸橼酸钠、EDTA-Na2·2H2O(国药集团上海化学试剂公司);特异性引物和探针(苏州泓迅生物科技有限公司);DIC Northern试剂盒(瑞士Roche公司);HybondTM-N+尼龙膜(美国GE Healthcare公司);RNA提取试剂盒(德国Qiagen公司);PrimeScript反转录试剂盒(日本TaKaRa公司)。
1.3 主要仪器
PCR仪2720 Thermal Cycler(美国ABI公司);琼脂糖电泳仪(南京新校园生物技术研究所);Northern核酸杂交仪(英国Roller-Blot公司);荧光定量PCR仪CFX96TMReal-Time System和PAGE凝胶电泳槽(美国Bio-Rad公司)。
1.4 细菌培养和总RNA提取
挑取单克隆细菌于LB液体37℃过夜培养,按1 ∶100转接于相同条件LB液体培养基,分别培养至不同生长时期[D(600 nm)为0.3、0.8、1.3和2.0分别代表对数早期、对数期、对数晚期和稳态期],收集细菌。采用TRIzol法提取细菌总RNA后,用2 μL(1 U/μL)DNA酶Ⅰ 37℃ 30 min、1 μL(1 U/μL)DNA酶Ⅰ 80℃ 2 min去除混杂的少量DNA,酚仿-乙醇法纯化。取适量RNA用1.2%的琼脂糖凝胶电泳检测RNA质量。
将伤寒沙门菌培养至对数期后分别给予酸、高渗、氧应激培养30 min和42℃热应激(10、20、30 min),分别收集细菌,上述方法提取RNA。酸应激组细菌添加浓盐酸,使最终pH=4.5;高渗应激组添加5 mol/L的NaCl溶液1.06 mL;氧应激组添加30%的H2O210 μL;对照组不做处理。
1.5 RNA印迹检测ArpH RNA表达
用ArpH特异性cDNA探针检测ArpH。利用Oligo 6软件,根据arpH的核苷酸序列设计RNA印迹探针ArpH-NR(5′-AGGGCGATCTGGAAGCAGCT-AAAACGCTGATCCTGTCTCACCTGCGCTTTGTTG-3′)。5S rRNA为内参(5S-NR:5′-CTACCATCGGCGCTACGGCGTTTCACTTCTGAGTTCGGCATGGGGTCA-GGTGGGA-3′)。取200 ng纯化的探针DNA用DIC Northern试剂盒体外转录并标记探针。反应完成后加入1 μL(10 U/μL)DNA酶Ⅰ 37 ℃消化30 min,2 μL 0.2 mol/L EDTA终止反应。加入DEPC水使总体积达到50 μL。加入1/10体积的5 mol/L乙酸铵和3倍体积预冷的无水乙醇,-20 ℃放置2 h,12 000 r/min、4 ℃离心20 min,75%乙醇漂洗,空气干燥。用50 μL DEPC水溶解,应用核酸检测仪检测探针浓度;应用10%的尿素变性PAGE电泳检测探针质量。剩余探针加入20 U RNA酶抑制剂,-80 ℃保存待用。在含有7 mol/L尿素的6%聚丙烯酰胺凝胶上分离出10~20 μg总RNA,并电印迹到HybondTMN+尼龙膜上(300 mA 40 min)。转膜完成后用2×SSC洗膜2次。80 ℃干燥2 h,固定RNA。膜固定后,用DEPC水洗膜3次,加入5 mL Rhoche杂交液,55 ℃预杂交1 h。弃去杂交液,加入5 mL新的杂交液,将探针90 ℃变性后添加到杂交液中过夜。次日洗膜并孵育地高辛抗体,用化学发光凝胶成像仪曝光显影。
1.6 qRT-PCR检测ArpH RNA表达
利用Oligo 6软件,根据arpH的核苷酸序列设计特异性引物RT-PA(5′-CTCATCGTCCGAAGACAT-3′)和RT-PB(5′-CGTTAAAGTCGCAACCAC-3′)。5S rRNA为内参(5S-A:5′-TTGTCTGGCGGCAGTAGC-3′;5S-B:5′-TTTGATGCCTGGCAGTTC-3′)。提取不同生长时期和不同应激(酸、氧、高渗)条件下的细菌总RNA各4 μg,用随机引物将RNA反转录成cDNA,再以ArpH RT-PA/RT-PB进行qRT-PCR。使用qRT-PCR仪监测反应,并使用2-ΔΔCT方法进行标准化[10]。
将伤寒沙门菌培养至对数期后分别给予42 ℃热应激10、20、30 min,提取不同时间段RNA做qRT-PCR。选择ompR、rcsB和oxyR基因缺陷变异株培养至生长对数期,提取RNA后消化残余DNA,用随机引物反转录成cDNA后进行qRT-PCR。
1.7 统计学分析
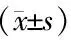
2 结果
2.1 不同生长期伤寒沙门菌ArpH的表达
qRT-PCR结果显示(图1A),ArpH在细菌生长的对数晚期时表达量最高,从对数早期到对数晚期的过程中,表达量逐渐增加,而进入稳态期后有所回落。
RNA印迹结果显示(图1B),ArpH在对数晚期条带最浓,对数早期条带最淡,与定量结果一致。
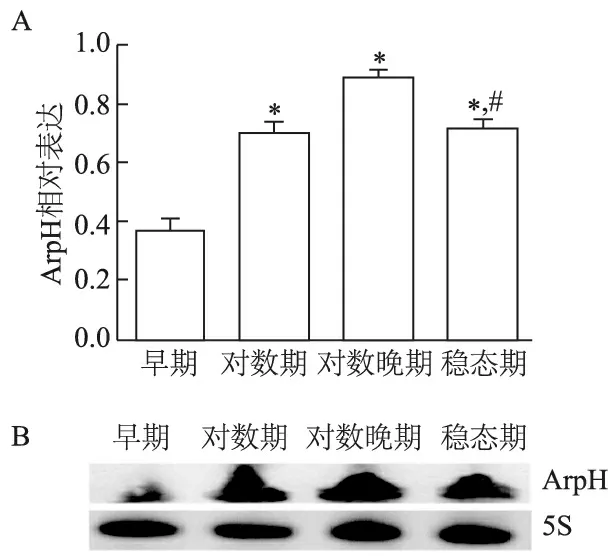
A: 实时定量PCR;B: RNA印迹
2.2 酸、高渗、氧应激下伤寒沙门菌ArpH的表达
RNA印迹(图2A)和qRT-PCR(图2B)结果显示,ArpH表达水平在酸应激下明显下降(P<0.01),氧应激下明显增高(P<0.01),而高渗应激下则无明显变化。
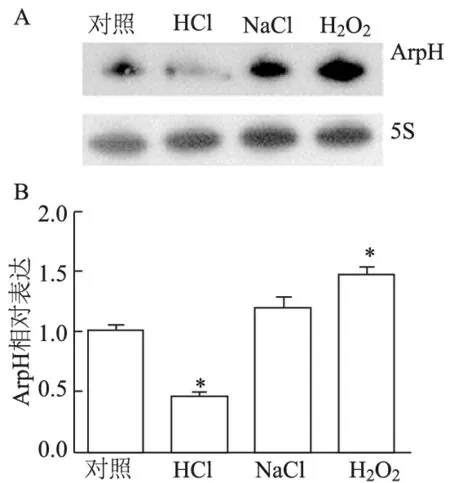
A: RNA印迹;B: 实时定量PCR
2.3 热应激下伤寒沙门菌ArpH的表达
如图3所示,42℃热应激10、20、30 min对ArpH表达无明显影响(F=1.066,P=0.430 9)。
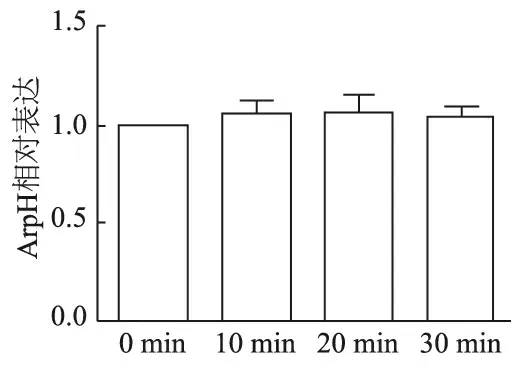
图3 热应激下伤寒沙门菌ArpH的表达
2.4 ompR、rcsB和oxyR基因对伤寒沙门菌ArpH表达的影响
qRT-PCR结果显示,ompR、rcsB和oxyR基因缺失时,伤寒沙门菌ArpH表达量均明显下调(图4)。
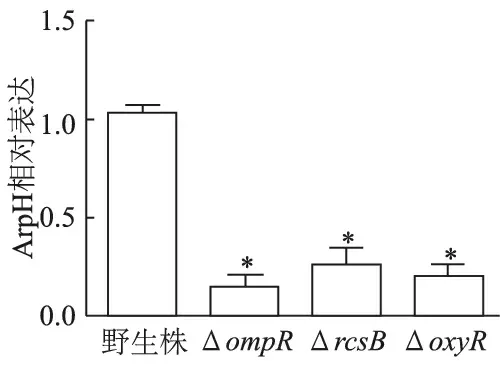
*:P<0.01,与野生株比较
3 讨论
ncRNA对细菌适应特定生长环境具有调节作用[11]。沙门菌和其他细菌一样,拥有一套适应环境的调节系统,该系统允许它在感染动物的每个阶段的恶劣环境下进行繁殖。例如被摄取后,沙门菌必须首先应对温度升高之后胃的酸性环境,在肠内又受到渗透压增加、氧分压降低等因素影响,以及与肠道正常菌群的竞争[12]。沙门菌随后可以进入非吞噬细胞和吞噬细胞并在其中增殖,细菌抵抗细胞内防御,该过程涉及抗菌肽、含沙门菌液泡的酸化、活性氧和氮的产生等机制。为了应对这些应激条件,伤寒沙门菌必须快速调节其转录前体,这可能与ncRNA介导的快速基因调节有关。监测ncRNA表达可以揭示与沙门菌在宿主细胞内生存策略相关的诱导模式[13]。
随着arpH基因位置的确定[9],本研究进一步分析了ArpH的表达特性,结果显示ArpH在细菌生长的对数晚期表达量最高,从对数早期到对数晚期的过程中,表达量逐渐增加,而进入稳态期后有所回落。这表明ArpH可能在伤寒沙门菌生长的对数晚期发挥了重要作用。
本研究在体外模拟了伤寒沙门菌感染人体时可能遭遇胃酸、高渗肠道液及吞噬细胞内活性氧这3种不同的应激环境,RNA印迹和qRT-PCR结果显示,ArpH表达水平在酸应激下明显下降,氧应激下明显增高,而高渗应激下则无明显变化。这提示细菌可能通过下调ArpH的水平来参与伤寒沙门菌对酸的应激。而在氧应激下,ArpH表达上调有助于细菌在宿主细胞内发挥抗氧化作用。
在暴露于热应激后,几乎所有生物体的细胞瞬时增加了一组热休克蛋白(heat shock proteins,hsps)的合成,这些分子通常是分子伴侣和蛋白酶。这种反应称为热休克反应,最大限度地减少了热变性和蛋白质聚集所造成的损害。大肠埃希菌的RNA聚合酶含有σ32(rpoH的基因产物),它参与了许多热休克蛋白基因的转录。有实验表明当温度从30°C突然升至42°C时,6 min后σ32的水平增加了约17倍,15 min后下降至5倍[14]。arpH基因定位图显示ArpH完全覆盖了rpoH的编码区,提示rpoH可能是ArpH的靶基因[9]。因此,我们探讨了热应激不同时间ArpH的表达水平。结果表明热应激并未影响ArpH的表达。上述结果表明ArpH可能并不参与热应激时rpoH的表达调控。但在其他高温或低温情况下是否发挥作用尚待进一步研究。
细菌的基因表达还可受各种调节(蛋白)因子的影响。双组分调节系统由位于细菌胞膜上的感受蛋白和胞内效应调节蛋白构成,在各种应激环境的基因表达调节中至关重要。感受蛋白多为ATP依赖性蛋白激酶,在外部环境的刺激下,胞内近C末端的组氨酸残基可磷酸化,然后再将磷酸基团特异性地传递给胞内特殊的调节蛋白天门冬氨酸残基,使其磷酸化并改变蛋白构象及活性,从而影响对相关基因的转录表达[15]。OmpR与EnvZ构成双组分调节系统,除调节膜通道蛋白OmpC和OmpF表达外,还与沙门菌SPI-1和SPI-2基因表达调节有关[16]。本研究分析了伤寒沙门菌双组分调节系统(OmpR、RcsB)和氧应激调节因子OxyR对ArpH的影响。实验结果表明,当ompR、rcsB和oxyR基因缺失时,ArpH表达量均明显下调,表明伤寒沙门菌双组分调节系统OmpR、RcsB和氧应激调节因子OxyR对ArpH均有正向调控作用。
综上所述,本研究初步探讨了伤寒沙门菌在不同生长时期和不同应激条件下ncRNA ArpH的表达特性。结果提示ArpH参与了伤寒沙门菌对酸、氧应激的调节;双组分调节系统OmpR、RcsB和氧应激调节因子OxyR对ArpH均有正向调控作用。本研究为进一步深入探讨ArpH的作用机制提供了基础。
