CD4+CD29+T细胞含量及其免疫检查点水平与非小细胞肺癌患者的化疗效果及远期存活率的关系
2020-03-02田文高敬华张菁华李永生
田文, 高敬华, 张菁华, 李永生
肺癌是临床上十分常见的恶性肿瘤之一,其临床死亡率、发病率均居高不下,非小细胞肺癌是肺癌中最常见的病理类型[1]。虽然手术切除是目前最主要的治疗方案,但非小细胞肺癌术后极易复发常需接受药物治疗,其中化疗药物是重要的治疗药物[2]。有研究指出,非小细胞肺癌患者在采用化疗方案治疗初期其化疗敏感性较高,但极易复发,而可用的二线治疗药物较少且其耐药机制尚未完全明了[3]。近年来随着肿瘤免疫学研究的深入,程序坏死因子1(programmed death 1,PD-1)、细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen 4,CTLA-4)及程序坏死因子配体1(programmed death ligand 1,PD-L1)是人体内重要的免疫检查点受体,恶性肿瘤患者血中CTLA-4、PD-1及PD-L1水平常处于异常表达状态,且与患者肿瘤发生及发展密切相关[4-5]。外周血淋巴细胞亚群是现阶段临床中评估机体免疫功能的重要指标[6]。放疗、化疗、手术等治疗方案均可能对肿瘤患者免疫功能造成严重的不良影响,但患者免疫功能与非小细胞肺癌患者化疗效果的关系鲜有报道,本研究旨在分析非小细胞肺癌患者的CD4+CD29+T细胞含量及CTLA-4+T、PD-1+T、PD-L1+T细胞表达水平与患者化疗效果及远期存活率的关系。
1 资料与方法
1.1 一般资料 选取2015年1月至2017年1月沧州市中心医院收治的非小细胞肺癌患者100例。纳入标准:① 病理检查确诊为ⅢB期或Ⅳ期非小细胞肺癌;② 预计生存期大于1年;③ 可耐受化疗;④ 美国东部肿瘤协作组(ECOG)状态评分0~2分[7];⑤ 对本研究知情并签署同意书。排除标准:① 合并有不稳定性心绞痛、高血压控制不佳、活动性感染、充血性心衰、肝肾功能异常;② 肿瘤转移;③ 5年内曾患有其他恶性肿瘤;④ 中途退出本研究。本组100例中男59例、女41例,年龄18~76(48.9±7.2)岁,肿瘤分期ⅢB期62例、Ⅳ期38例,淋巴转移58例、未转移42例,手术治疗78例、未行手术治疗22例,行放疗60例、未行放疗40例。本研究经我院伦理委员会批准同意。
1.2 方法 所有患者均采用美国国立综合癌症网络指南(NCCN)[8]推荐的给药剂量,选用顺铂/卡铂+紫杉醇/多西他赛、顺铂/卡铂+培美曲塞二钠、依托泊苷+卡铂/顺铂、卡铂/顺铂+长春瑞滨、卡铂/顺铂+吉西他滨等化疗方案进行治疗。
所有患者化疗后采集空腹静脉血,用流式细胞术检测外周血单个核细胞(PBMC)中CD4+CD29+T、CTLA-4+T、PD-1+T及PD-L1+T细胞水平,所用抗体均购自南京福麦斯生物科技有限公司。对患者随访2年,记录患者生存及死亡情况,其中存活79例,死亡21例,依照RECIST Version 1.1标准[9]对患者化疗效果进行评估,并按此分为缓解组54例,进展组46例。
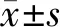
2 结果
2.1 不同疗效患者血中各检测指标比较 缓解组的CD4+CD29+T、CTLA-4+T及PD-1+T细胞水平均高于进展组,PD-L1+T细胞水平低于进展组,差异均有统计学意义(P<0.001),见表1。
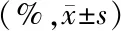
表1 缓解组与进展组患者的血中各检测指标比较
2.2 血中各指标与患者疗效的关系 CD4+CD29+T、CTLA-4+T、PD-1+T细胞水平与患者化疗疗效呈正相关(rs=0.543、0.492、0.602,P<0.01),PD-L1+T细胞水平与患者化疗疗效呈负相关(rs=-0.564,P<0.01)。
2.3 不同生存情况患者血中各检测指标比较 存活组的血中CD4+CD29+T、CTLA-4+T及PD-1+T细胞水平均高于死亡组,PD-L1+T细胞水平低于死亡组,差异均有统计学意义(P<0.001),见表2。
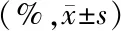
表2 存活组与死亡组患者的血中各检测指标比较
2.4 血中各指标与患者远期存活率的关系 CD4+CD29+T、CTLA-4+T、PD-1+T细胞水平与患者远期存活率呈正相关(rs=0.564、0.617、0.593,P<0.001),PD-L1+T细胞水平与患者存活率呈负相关(rs=-0.495,P<0.001)。
3 讨论
肺癌是全球范围内死亡率和发病率居高不下的严重恶性肿瘤之一。近年来随着免疫学的发展,有学者提出免疫编辑学说,且研究表现肺癌发生、发展及患者预后质量与机体免疫功能密切相关,也与肿瘤免疫微环境的改变密切相关[10]。一般情况下,淋巴细胞亚群是机体免疫系统中重要的细胞群,在特异性细胞免疫杀伤和机体免疫功能调节等方面扮演着十分重要的角色[11]。临床中可通过检测患者外周血淋巴细胞亚群水平对其免疫功能及免疫状态进行评估,对预测患者预后质量、检测肿瘤复发、指导患者免疫治疗均具有重要意义[12]。CD4+T细胞在机体免疫功能的调节过程中起到十分重要的作用,其中CD4+CD29+T细胞是重要的调节性T细胞亚群,能有效反映患者的免疫功能[13]。CD29是重要的整合素家族成员,该分子是细胞外基质蛋白受体,CD4+T细胞表面若同时表达CD29分子则该T细胞则被认为是辅助诱导T细胞。CD4+CD29+T细胞属于辅助性T细胞(Th1细胞),在炎性因子及物质刺激下被激活,后分泌肿瘤坏死因子及干扰素等,上调免疫应答从而能增强其免疫功能[14]。有研究指出,在肿瘤患者体内CD4+CD29+T细胞常处于功能低下状态,且CD4+CD29+T细胞状态可能与患者预后质量密切相关[15]。
T淋巴细胞是体内起到抗肿瘤作用的主要免疫效应细胞,其表面多表达共刺激或共抑制分子的共信号,也能决定T细胞免疫功能及免疫应答的生物学及生理学效应。近年来随着研究的深入,效应性T细胞表面多伴随PD-1、CTLA-4等免疫检查点分子表达量上调[16]。PD-L1是肿瘤细胞及抑制性T细胞表面表达的PD-1特异性配体,其可与T细胞表面PD-1特异性结合降低患者效应性T细胞的活性水平。有研究指出,PD-1、PD-L1、CTLA-4等免疫检查点分子可有效调节T细胞活性及患者的免疫功能,并在介导肿瘤细胞逃避免疫监视过程中起到十分重要的作用[17]。因此有效检测血中PD-1、PD-L1、CTLA-4等免疫检查点分子水平在评估患者病情变化过程中起到十分重要的作用。
本研究结果发现,化疗缓解组和随访2年存活组患者的CD4+CD29+T细胞、CTLA-4+T细胞、PD-1+T细胞水平显著高于进展组和死亡组,PD-L1+T细胞水平显著低于进展组和死亡组,且CD4+CD29+T、CTLA-4+T、PD-1+T细胞水平与化疗疗效呈正相关,PD-L1+T细胞水平与化疗疗效呈负相关。分析原因可能是,非小细胞肺癌患者血CD29、PD-1及CTLA-4水平处于低表达状态,PD-L1处于高表达状态,提示患者体内免疫功能常处于抑制状态,其效应性T细胞活化程度较低,使T淋巴细胞无法有效识别肿瘤细胞,进而导致肿瘤细胞逃避免疫监视,从而降低其临床疗效,缩短患者生存期并导致患者死亡率增高。
